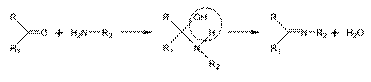Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Спецкурс «биохимия растений». Зачет.Содержание книги
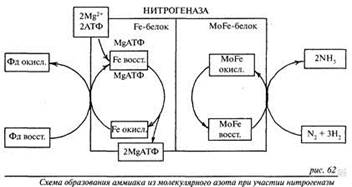
Поиск на нашем сайте СПЕЦКУРС «БИОХИМИЯ РАСТЕНИЙ». ЗАЧЕТ. Особенности азотного обмена у высших растений. Молекулярный азот не усваивается растениями и может переходить в доступную форму для них только благодаря деятельности микроорганизмов-азотофиксаторов: - свободноживущие - симбиотрофные (эффективнее) Химизм фиксации атмосферного азота Конечным продуктом фиксации азота является аммиак. В процессе восстановления азота до аммиака участвует мультиферментный комплекс - нитрогеназа. Нитрогеназа состоит из двух компонентов: - MoFe-белок (содержит молибден, железо и серу и осуществляет связывание и восстановление азота) - Fe-белок (содержит железо и серу; участвует в транспорте электронов от их доноров (ферредоксин) на MoFe-белок)
Источником протонов и электронов для восстановления азота служит дыхательная электрон-транспортная цепь. Это указывает на связь усвоения азота атмосферы с процессами дыхания и фотосинтеза (источника углеводов). Для восстановления N2 до NH3 требуется шесть электронов: Процесс требует АТФ как источника энергии: для восстановления одной молекулы N2 требуется не менее 12 молекул АТФ. Для работы нитрогеназы требуются анаэробные условия. Вместе с тем в клетках высшего растения кислород необходим для поддержания дыхания. В связи с этим роль леггемоглобина заключается в связывании О2 в организме бактерий и создании условий для работы нитрогеназы. Структура, свойства и распространение в растениях основных представителей моносахаридов и полисахаридов. Все углеводы подразделяются на две группы: Простые — моносахариды. Моносахариды не способны гидролизоваться с образованием более простых соединений. По числу атомов углерода в цепи различают триозы, тетрозы, пентозы, гексозы и гептозы, содержащие соответственно 3, 4, 5, 6 и 7 атомов углерода. В природе наиболее распространены гексозы и пентозы. Физ. св-ва.: Моносахариды — кристаллические вещества белого цвета, хорошо растворимые в воде, сладкие на вкус. Несахароподобные полисахариды не имеют сладкого вкуса, не растворимы в воде, а в горячей воде образуют вязкие коллоидные растворы (Мутаратация - Это явление характерно только для свежеприготовленных растворов сахаров. Суть его заключается в том, что сразу после растворения сахара удельное вращение водных растворов моносахаридов начинает изменяться, достигая лишь через некоторое время постоянной величины. Это объясняется тем, что происходит взаимные превращения различных форм углеводов.) Пиролиз моносахаридов Нагревание моно-, а также дисахаридов выше 100 °С приводит к их пиролизу с образованием множества ароматобразующих темноокрашенных продуктов, обладающих определенными запахом и вкусом К веществам, образующимся при карамелизации, относятся альдегиды, кетоны, дикетоны, мальтол, производные фурана и циклопептана, а также высокомолекулярные горькие вкусовые вещества невыясненной природы.В большинстве случаев реакции карамелизации идут одновременно с реакциями меланоидинообразования, образуя сложный комплекс взаимосвязанных превращений, определяющих цвет, вкус, аромат, пищевую и биологическую ценность получаемых продуктов. Моносахариды Глюкоза С6Н2О6 (виноградный сахар) — самая распространенная из моноз как в растительном, так и в животном мире. Содержится в свободном виде во всех зеленых частях растений, в семенах, различных фруктах и ягодах. В больших количествах глюкоза содержится в винограде — отсюда происходит ее название — виноградный сахар. Особенно велика биологическая роль глюкозы в образовании полисахаридов — крахмала, целлюлозы, построенных из остатков D-глюкозы. Глюкоза входит в состав тростникового сахара, гликозидов, таннина и других дубильных веществ. Глюкоза хорошо сбраживается дрожжами. Фруктоза С6Н12О6 (плодовый сахар) содержится во всех зеленых растениях, в нектаре цветов. Особенно ее много в плодах, поэтому ее второе название — плодовый сахар. Фруктоза гораздо слаще других сахаров. Она входит в состав сахарозы и высокомолекулярных полисахаридов, таких, например, как инулин. Как и глюкоза, фруктоза хорошо сбраживается дрожжами.
Сложные — полисахариды. Полисахариды подразделяют на: Низкомолекулярные – сахароподобные, или олигосахариды, или полисахориды первого порядка. Высокомолекулярные, или несахароподобные, или полисахариды второго порядка. (При гидролизе полисахаридов в качестве конечных продуктов образуются моносахариды.) Полисахариды первого порядка также подразделяют на две группы: Дисахариды, наиболее известным представителем которых является сахароза; Собственно олигосахариды, представляющие соединения сахарозы с одним, двумя и тремя остатками моносахарида галактозы — рафиноза, стахиоза, вербаскоза — соответственно три-, тетра- и пентасахариды. Полисахариды второго порядка подразделяют на: Запасные — крахмал, животный и растительный гликоген; Структурные — целлюлозы, гемицеллюлозы, пектиновые вещества, слизи и др. (рис 1).
Дисахариды Сахароза С12Н22О11 (дисахарид) чрезвычайно широко распространена в растениях, особенно много ее в корнеплодах свеклы а также в стеблях сахарного тростника. Сахароза состоит из D-глюкопиранозы и D-фруктофуранозы, соединенных за счет гликозидныхгидроксилов. Сахароза не содержит свободного гликозидного гидроксила, является невосстанавливающим сахаром, потому относительно химически инертна, за исключением ее чрезвычайной чувствительности к кислотному гидролизу. Поэтому сахароза является транспортным сахаром, в виде которого углерод и энергия транспортируются по растению. Именно в виде сахарозы углеводы перемещаются из мест синтеза (листья) к месту, где они откладываются в запас (плоды, корнеплоды, семена, стебли). По проводящим пучкам растений сахароза движется со скоростью 20-30 см/ч. Сахароза очень хорошо растворяется в воде и обладает сладким вкусом. С повышением температуры ее растворимость увеличивается. В абсолютном спирте сахароза нерастворима, а в водном спирте она растворяется лучше. При нагревании до 190-200 °С и выше происходит дегидратация сахарозы с образованием различных окрашенных полимерных продуктов — карамелей. Эти продукты под названием «колер» используются в коньячном производстве для придания окраски коньякам. Мальтоза С12Н22О11 состоит из двух остатков -D-глюкопиранозы, соединенных гликозиднойсвязью. Мальтоза в свободном состоянии в растениях содержится в небольшом количестве, но появляется при прорастании, так как она образуется при гидролитическом расщеплении крахмала. В нормальном зерне и муке она отсутствует. Наличие ее в муке говорит о том, что эта мука получена из проросшего зерна. Большое количество мальтозы содержится в солоде, который применяется в пивоварении, поэтому мальтозу называют также солодовым сахаром. Под действием фермента глюкозидазы (мальтазы) мальтоза подвергается гидролизу до D-глюкозы. Мальтоза сбраживается дрожжами. Лактоза С12Н22О11 построена из D-галактопиранозы и D-глюкопиранозы, соединенных между собой гликозидной связью. В растениях она встречается редко. В большом количестве (4-5 %) лактоза содержится в молоке, поэтому ее называют молочным сахаром. Это восстанавливающий сахар со слабым сладким вкусом. Сбраживается лактозными дрожжами до молочной кислоты. Целлобиоза С12Н22О11 состоит из двух остатков D-глюкопиранозы, соединенных между собой гликозиднойсвязью. Она служит структурным компонентом полисахарида целлюлозы и образуется из нее при гидролизе под действием фермента целлюлазы. Этот фермент продуцируется рядом микроорганизмов, а также он активен в прорастающих семенах. Запасные полисахариды Крахмал (С6Н10О5)n является важнейшим представителем полисахаридов в растениях. Этот запасной полисахарид используется растениями как энергетический материал. Крахмал в животном организме не синтезируется, аналогичным запасным углеводом у животных является гликоген.Крахмал в больших количествах содержится в эндосперме злаков — 65-85 % его массы, в картофеле — до 20 %. Крахмал не является химически индивидуальным веществом. В его состав кроме полисахаридов входят минеральные вещества, в основном представленные фосфорной кислотой, липиды и высокомолекулярные жирные кислоты — пальмитиновая, стеариновая и некоторые другие соединения, адсорбированные углеводной полисахаридной структурой крахмала.
(В клетках эндосперма крахмал находится в виде крахмальных зерен. В запасающих тканях различных органов — клубнях, луковицах более крупные крахмальные зерна откладываются в запас в амилопластах как вторичный (запасной) крахмал. Крахмальные зерна имеют слоистую структуру.) Структурные полисахариды Целлюлоза (С6Н10О5) – полисахарид второго порядка, является основным компонентом клеточных стенок. Целлюлоза состоит из остатков D-глюкозы. Среди других полисахаридов, из которых состоит клеточная стенка растений, он относится к микрофибриллярным полисахаридам, так как в клеточных стенках молекулы целлюлозы соединены в структурные единицы, получившие название микрофибрилл. Последняя состоит из пучка молекул целлюлозы, расположенных по ее длине параллельно друг другу. Распространение целлюлозы: Содержание целлюлозы в растениях колеблется в широких пределах: в волокнах хлопчатника 90 %, древесине 50, листьях табака 10, семенах злаковых культур 3…5, подсолнечника 2, ягодах винограда 1 %.(В среднем на одну молекулу целлюлозы приходится около 8000 остатков глюкозы.) Свойства целлюлозы:Целлюлоза не растворяется в воде, но в ней набухает. Свободные гидроксильные группы способны замещаться на радикалы — метильный—СН3 или ацетальный с образованием простой или сложноэфирной связи. Это свойство играет большую роль при изучении строения целлюлозы, а также находит применение в промышленности при производстве искусственного волокна, лаков, искусственной кожи и взрывчатых веществ. Гемицеллюлозы — полисахариды второго порядка, образующие вместе с пектиновыми веществами и лигнином матрикс клеточных стенок растений, заполняющий пространство между каркасом стенок, сложенных из целлюлозных микрофибрилл. Гемицеллюлозы подразделяют на три группы:1. Ксиланы;2. Маннаны;3. Галактаны. 10. Реакции взаимопревращения моносахаридов: реакции изомеризации, транс-кетолазные, трансальдолазные реакции, альдольная конденсация. Первичным источником углерода для углеводов растений является углекислый газ атмосферы, который поглощается в процессе фотосинтеза. Другим возможным источником углерода для синтеза глюкозы служат жиры (триглицериды), которые запасаются в эндосперме некоторых семян. В ходе прорастания семян эти жиры расщепляются и превращаются в фосфатные эфиры D-глюкозы в процессе, называемом глюконеогенезом. Моносахариды, образующиеся при фотосинтезе или путем глюконеогенеза, могут превращаться в другие моносахариды, т.е. претерпевать большое число взаимопревращений. Эти взаимопревращения играют важную роль в процессе расщепления сахаров, а также для образования моносахаридных предшественников олиго- и поли- сахаридов. При взаимопревращениях моносахаридов реагирующими веществами обычно являются их производные. Особенно большое значение имеют два типа производных моносахаридов, а именно их фосфатные эфиры и нуклеозиддифосфатные эфиры. Взаимопревращения свободных моносахаридов возможны, но они характерны главным образом для низших форм растительной жизни. Взаимопревращения, которым подвергаются производные моносахаридов (а в некоторых случаях и свободные моносахариды) можно разделить на три больших класса: а) внутренние перестройки -мутации (перемещение фосфатной группы в молекуле моносахаридфосфата, катализируемое мутазами); -эпимеризация (изменение конфигурации при одном из асимметричных углеродных атомов моносахарида, катализируемое эпимеразами); -взаимопревращения альдоза-кетоза, катализируемые изомеразами; б) перенос С2- и С3-остатков перенос С2- и С3-остатков от одного моносахарида к другому катализируют два важных фермента, широко распространенных в растениях, – транскетолаза и трансальдолаза. в) окислительно-восстановительные реакции -образование альдоновых кислот; -образование альдуроновых кислот; -образование полигидроксиспиртов (полиолов). Для моносахаридов характерны несколько видов изомерии. 1. Межклассовая изомерия. Альдозы и кетозы являются межклассовыми изомерами 2. Оптическая изомерия. Наличие нескольких асимметрических атомов углерода обусловливает существование большого числа оптических изомеров у моносахаридов. 3. Таутомерия (мутаротация). Для всех моносахаридов характерно явление мутаротации, т.е. существование в циклической и нециклической формах.
2)Стереоизомерия или D и L изоформы: Изомеры- это соединения, имеющие одну и ту же структурную формулу, но различающиеся по пространственной конфигурации. Образование таких изомеров оказывается возможным при вхождении в состав молекулы асимметрических (хиральных) атомов углерода (к которым присоединены четыре различных атома или группы). Число возможных изомеров данного соединения зависит от числа асимметрических атомов углерода (n) и равно (2)^n. (Глюкоза с четырьмя асимметрическими атомами углерода имеет, следовательно, 16 изомеров.)
*Практически все моносахариды, встречающиеся в природе, принадлежат к D -ряду. В случае моносахаридов принадлежность к D или L форме определяется расположением гидроксильной (ОН) группировки, относительно хирального атома углерода. Если ОН-группа слева, то это L-форма, если справа, то D-форма. Но полностью этому правилу соответствует только глицероальдегид, имеющий только один хиральный атом. Поэтому было принято решение признать атомом, определяющим стереоизомерию, последний хиральный атом молекулы (предпоследний атом углерода в молекуле).
3)Таутомерия (мутаротация). Для всех моносахаридов характерно явление мутаротации, т.е. существование в циклической и нециклической формах. Рассмотрим это явление на примере молекулы рибозы. Поскольку в пространстве углерод-углеродная цепь рибозы изогнута, то карбонильная группа располагается близко к –ОН группе четвертого или пятого атома углерода. Происходит взаимодействие этих двух групп одной молекулы и цикл замыкается с образованием внутреннего полуацеталя.
Вновь образовавшийся гидроксил (выделен на рис. синим цветом) носит название полуацетального, или гликозидного и может по разному располагаться в пространстве относительно цикла. Если полуацетальный гидроксил располагается по одну сторону с гидроксилом, определяющим принадлежность к D- или L-ряду, то такой изомер называется α-изомером, если по разные стороны – β-изомером. Циклическая и открытая формы легко переходят друг в друга и находятся в динамическом равновесии. При комнатной температуре преобладает циклическая, при нагревании – открытая форма. Аналогично происходит и с углеродным скелетом глюкозы: карбонильная группа располагается близко к –ОН группе пятого или шестого атома углерода, в результате чего происходит взаимодействие этих групп, приводящее к образованию полуацетальной группы (выделена синим цветом). На рисунке ниже приведены открытая и закрытая форма существования глюкозы:
Согласно теории А. Байера: Внутримолекулярное взаимодействие спиртовой и карбонильной групп наиболее благоприятно, если оно приводит к образованию пяти- или шестичленных циклов. Шестичленные кольца сахаров называют пиранозами, а пятичленные – фуранозами. Формулы, отображающие строение циклических форм моносахаридов, были предложены У. Хеуорсом в 20-х годах прошлого века.
ИЗОМЕРАЗЫ-участвуют в ИЗОМЕРИЧЕСКИХ превращениях. При этом один структурный изомер может превращаться в другой, за счёт внутри молекулярной перегруппировки атомов.
Глюконеогенез. Глюконеогенез — процесс образования молекул глюкозы из молекул других органических соединений. Биологическая роль глюконеогенеза: 1. Поддержание уровня глюкозы в крови. При длительном голодании (голодание более суток) глюконеогенез является единственным процессом, поставляющим глюкозу в кровь.
На синтез 1 мол глюкозы из 2х ПВК надо 12 мол АТР.
Гликозилтрансферазные реакции. Исходными соединениями для синтеза сложных углеводов являются фосфорилированные сахара – НДФ-cахара (нуклеозиддифосфат сахара). В клетках растений, животных, микроорганизмов биосинтез полисахаридов осуществляется путем последовательных реакций трансгликолизирования. Суть реакции: НДФ-глюкоза+ фруктозо-6-фосфат à НДФ + сахарозо-6-фосфат (Сахароза + H3PO4) В реакциях участвует большое число молекул-доноров и молекула акцептора (затравка – небольшой фрагент данного полисахарида). Доноры - НДФ-сахара. Цепь молекулы затравки удлиняется путем последовательного переноса к одному из концов молекулы-затравки гликозильных остатков молекул-доноров. Число переносов может быть от сотен до тысячи и более, все они катализируются одним и тем же ферментом. Этот фермент специфичен к переносимому остатку и определяет природу гликозидной связи. Гликозилтрансферазы (трансгликозидазы), ферменты 2 класса– ускоряют реакции переноса гликозильных остатков из молекул фосфорных эфиров или других соединений к молекулам моносахаридов, полисахаридов или других веществ, обеспечивая главным образом реакции синтеза и распада олиго- и моносахаридов. Пример фермента – гликогенсинтетаза, соединяется с гликогеном и образует комплексы, содержащие до 10 молекул фермента, локализованных по месту нередуцирующих концов наращиваемых олигосахаридных цепей. Особенности биосинтеза полисахаридов: 1) Многоступенчатый процесс (при использование гликозилтрансферазных реакций (фрагменты цепочек и/или гликозильные остатки); 2) Использование специфических НДФ-сахаров для синтеза каждого полисахарида 3) Необходима «затравка» в виде небольшого низкомолекулярного фрагмента полисахарида, который должен синтезироваться. 4) гликозилтрансферазные реакции могут проходить путем переноса не отдельных гликозидных остатков, а фрагментами цепочек. Примеры: образуются сахароза, лактоза, трегалоза, крахмал и т.д
Структура и свойства. Полярные гидрофильные головки и неполярные гидрофобные хвосты. Двойственная природа этих липидов обусловливает их ключевую роль в организации биологических мембран. Атомы углерода в молекулах высших карбоновых кислот могут быть соединены друг с другом как простыми, так и двойными связями. Из предельных (насыщенных) жирных кислот наиболее часто в состав жиров входят пальмитиновая, стеариновая, арахиновая; из непредельных (ненасыщенных) — олеиновая и линолевая. Степень ненасыщенности и длина цепей высших карбоновых кислот (т.е. число атомов углерода) определяют физические свойства того или иного жира. Жиры с короткими и непредельными кислотными цепями имеют низкую температуру плавления. При комнатной температуре это жидкости(масла). И наоборот, жиры с длинными и насыщенными цепями жирных кислот при комнатной температуре твердые. Вот почему при гидрировании (насыщении кислотных цепей атомами водорода по двойным связям) жидкое арахисовое масло, например, становится мазеобразным, а подсолнечное масло превращается в твердый маргарин. В фосфолипидах одна из крайних цепей высших карбоновых кислот триацилглицерола замещена на группу, содержащую фосфат. Гликолипиды образуются в результате соединения липидов с углеводами.
(гликосфинголипид) (фосфолипид)
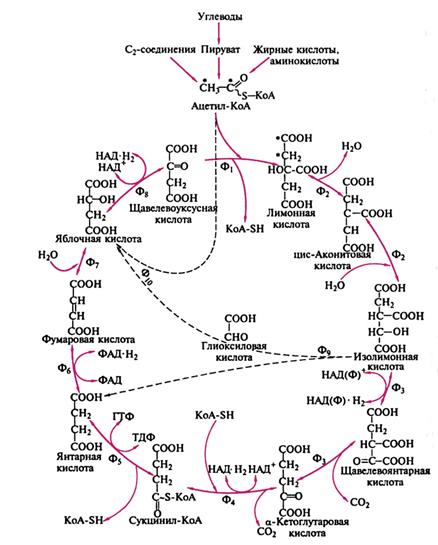
Глиоксилатный шунт. Глиоксилатный цикл - циклический ферментативный процесс, в котором происходит превращение ацетил-KoA в различные вещества, необходимые для синтеза всех важных клеточных компонентов, через стадию образования янтарной и глиоксиловой кислот. Является модификацией цикла Кребса и локализован не в митохондриях, а в мембраносвязанных органеллах - глиоксисомах. В этих органеллах образуется изолимонная кислота, как и в цикле Кребса. Затем она под действием изоцитратлиазы распадается на глиоксиловую и янтарную кислоты. Глиоксиловая кислота реагирует со второй молекулой ацетилкоэнзима А с образованием яблочной кислоты, которая затем окисляется до щавелевоуксусной кислоты. Янтарная кислота выходит из глиоксисомы и превращается в щавелевоуксусную кислоту. В ходе глиоксилатного цикла утилизируются две молекулы ацетилкоэнзима А, образовавшегося при распаде запасных жиров, и образуется одна молекула НАДН.У растений ферменты глиоксилатного цикла находятся в глиоксисомах, представляющих собой специализированные пероксисомы (названы по протекающему в них циклу). Ферменты, одновременно участвующие и в цикле трикарбоновых кислот, и в глиоксилатном цикле, имеют по два изофермента, один из которых локализуется в митохондриях, а другой — в глиоксисомах. Глиоксисомы не присутствуют постоянно во всех растительных тканях. Они образуются в богатых липидами семенах при их прорастании, ещё до того, как развивающееся растение сможет само образовывать глюкозу в ходе фотосинтеза. Кроме ферментов глиоксилатного цикла, в глиоксисомах находятся все ферменты, необходимые для деградации жирных кислот, запасённых к семенах. Ацетил-СоА, образующийся при β-окислении жирных кислот, превращается в сукцинат в ходе глиоксилатного цикла, и сукцинат транспортируется в митохондрии, где он вовлекается в цикл трикарбоновых кислот и превращается в малат. Цитозольный изофермент малатдегидрогеназы окисляет малат до оксалоацетата, который в свою очередь может превратиться в фосфоенолпируват. Последний вовлекается в глюконеогенез и даёт в конечном итоге глюкозу. Таким образом, прорастающее семя может переводить углерод, запасённый в липидах, в глюкозу.
Ф1 - цитратсинтаза (конденсирующий фермент); Ф2 - аконитаза; Ф3 - изоцитратдегидрогеназа; Ф4 - альфа-кетоглутаратдегидрогеназа; Ф5 - сукцилтиокиназа; Ф6 - сукцинатдегидрогеназа; Ф7 - фумараза; Ф8 - малатдегидрогеназа; Ф9 - изоцитратлиаза; Ф10 - малатсинтетаза. Включение углеродных атомов ацетильного остатка в молекулу лимонной кислоты помечено звездочками. Пунктирными линиями изображены реакции глиоксилатного шунта.
Эфирные масла Эфирные масла - летучие жидкие смеси органических веществ, вырабатываемые растениями и обусловливающие их запах. Основными компонентами, определяющими свойства эфирных масел, являются - монотерпеноиды, сесквитерпеноиды, ароматические терпеноиды, реже дитерпеноиды, а также соединения фенилпропановой структуры. Из эфирных масел выделено более 1000 компонентов, представленных различными типами углеводородов, спиртами, кетонами, кислотами, сложными эфирами, лактонами и другими органическими соединениями. Таким образом, эфирные масла представляют собой сложные многокомпонентные смеси биологически активных веществ, объединенных в общую группу по физическим признакам - летучести и маслообразной консистенции. Эфирные масла в растениях находятся большей частью в свободном состоянии, реже - в форме гликозидов и освобождаются только в результате ферментативного расщепления последних. Они служат для защиты растений от болезней и вредителей (обладают антисептическим действием), способствуют опылению, осуществляют терморегуляцию, являются активными участниками обменных процессов. Эфирные масла в живых тканях растений в одних случаях диффузно рассеяны по всем клеткам ткани в растворенном или эмульгированном состоянии в протоплазме или клеточном соке, в других - скапливаются в особых образованиях. В настоящее время известно около 3 000 эфирномасличных растений, из них активно используются в медицинской и хозяйственной практике около 130. Смолы — собирательное название аморфных вязкопластичных веществ, твёрдых или полутвердых при обычной температуре и постепенно теряющих форму при нагревании. Их делят на 2 группы: растительные и синтетические. Основные компоненты смол как правило дитерпены. Растительные смолы – продукты вторичного обмена растений, сложные по хим. составу аморфные в-ва. Выделяются на поверхность растений самопроизвольно или в результате ранения, или заражения. Продуцируются паренхимными клетками, выстилающими смоляные ходы ствола, корней и листьев, и накапливаются в этих ходах. Иногда обнаруживаются внутри клеток и в клеточных оболочках. Функции связаны с защитой растений. Большую часть используемых в промышленности смол получают из деревьев семейств сосновых, бобовых, диптерокарповых. Мевалонатный путь Взаимодействуя две молекулы ацетил КоА образуют ацетоацетил КоА. Он в свою очередь взаимодействуя с молекулой ацетил КоА образует 3-гидрокси-3-метилглутарил-КоА. Далее происходит NADPH-зависимая реакция превращения 3-гидрокси-3-метилглутарил-КоА в мевалоновую кислоту (МВК). МВК при участии АТР, в качестве донора, фосфорелируется обраруя фосфомевалонат который также фосфорилируясь образует пирофосфомевалонат. Далее от этой молекулы отщепляется углекислый газ и вода за счет энергии АТР, образуется ИППФ Ацетатно-малонатный путь. Широко распространён у грибов, лишайников и микроорганизмов. У высших растений является минорным и реализуется в сочетании с шикиматным путём в биосинтезе флавоноидов и антрахинонов. (синтез А-кольца!) Сборка флавоноида: кумароил-СоА взаимодействует с малонил-СоА и образует сначала халкон, а потом флаванон. Основная масса фенольных соединений происходит из гидроксикоричных кислот, кот. образуются из фенилаланина и тирозина, а также источниками фенолов являются хинная и шикимовая кислоты. Из них образуются фенольные кислоты и таннины. Гидроксикоричные к-ты образуют кумарины, меланины, участвуют в образовании лигнина и В-кольца флавоноидов. Флавоноиды – источники конденсированных таннинов.
2 8. Общая характеристика, применение, классификация и функции алкалоидов. Алкалоиды - гетерогенная группа азотсодержащих гетероциклических соединений основного характера, обладающих ярко выраженной физиологической активностью. Как правило, алкалоиды содержатся в растениях в виде солей яблочной, винной, лимонной и других кислот. В свободном виде они нерастворимы в воде, но растворяются в органических растворителях. По «модифицированной» химической классификации принято разделять алкалоиды на три подгруппы: \ – истинные алкалоиды (азот в составе гетероцикла); – протоалкалоиды (азот не в гетероцикле); – псевдоалкалоиды (синтез не из аминокислот). Параллельно с химической классификацией существует и биохимическая классификация. По ней алкалоиды подразделяются на подгруппы согласно исходной для их синтеза аминокислоте: – синтезирующиеся из L-орнитина (простые пирролидиновые алкалоиды, тропановые алкалоиды, пирролизидиновые алкалоиды); – из L-лизина (пиперидиновые алкалоиды, хинолизидиновые алкалоиды); – L-триптофана (сложные индольные алкалоиды, β-карболиновые алкалоиды); – L-фенилаланина (сложные изохинолиновые алкалоиды); – антраниловой кислоты (протоалкалоиды, хинолиновые алкалоиды, хиназолиновые алкалоиды); – L-тирозина (сложные изохинолиновые алкалоиды); – гистидина (пуриновые алкалоиды).
Пуриновые алкалоиды (небольшая группа): Кофеин - оказывает возбуждающее действие на центральную нервную систему, усиливает сердечную деятельность, расширяет сосуды сердца и мускулатуру бронхов. Индольные алкалоиды (самая многочисленная группа из истиных): в молекулах этих алкалоидов индольное ядро часто сохраняет свою ароматическую структуру, но иногда оно может быть гидрировано, ацилировано по атому азота или оксидировано по пятичленному циклу. Часто в молекулу входят в качестве составляющих пиридиновые и пиперидиновые. Индольные алкалоиды синтезируются преимущественно растениями тропиков и субтропиков. Как правило, они очень токсичны. Стрихнин — сильный яд, но в малых дозах применяется в качестве тонизирующего и возбуждающего центральную нервную систему средства. Аймалин обладает антиаритмическим действием. Помимо них, в медицине используются и такие индольные алкалоиды, как физостигмин, эргоалкалоиды (алкалоиды спорыньи), алкалоиды кураре, раувольфии и др. Протоалкалоиды ( третичные растительные амины, немногочислены): Эфедрин выделен из некоторых видов эфедры. По химической структуре и физиологическому действию он сходен с адреналином. Расширяет бронхи, возбуждает дыхательный центр. Широко используется для лечения аллергических заболеваний. Капсаицин содержится в плодах и семенах стручкового перца и определяет их жгучий вкус. Используется в медицине в виде настойки стручкового перца и в виде перцового пластыря (в качестве местного возбуждающего средства). Псевдоалкалоиды (имеют «базовую структуру» молекулы, происходящую не из аминокислот, как у истинных алкалоидов, а из изопреноидов). Самую большую группу изопреноидных псевдоалкалоидов составляют С27-стероидные алкалоиды (гликоалкалоиды – находятся в растениях в виде гликозидов): соласодин, томатидин, соланидин; используются для синтеза гормональных препаратов типа кортизона. Функции алкалоидов: – выполняют роль резерва азота, накапливаясь при усиленном азотном питании; – могут служить транспортной формой азота; – синтез алкалоидов в корнях — один из механизмов снижения уровня токсичных аминокислот и аминов и обезвреживания аммиака; – связывая органические кислоты, осуществляют регуляцию рН клеточного сока; – участвуют в поддержании ионного баланса в растении (благодаря способности к хелатообразованию); – могут принимать участие в регуляции активности некоторых ферментов, а следовательно, оказывать воздействие на скорость метаболических процессов; – повышают устойчивость растений к патогенным грибам; – оказывают воздействие на процессы дифференцировки и органогенеза. Особенности биосинтеза алкалоидов. Исходные метаболиты. Биогенетическими предшественниками большинства алкалоидов (истинных и протоалкалоидов) являются аминокислоты: орнитин, лизин, фенилаланин, тирозин, триптофан, гистидин, аспарагиновая кислота и антраниловая кислота (синтез по шикиматному пути). Все эти аминокислоты, кроме антраниловой кислоты, являются протеиногенными. Никотиновая кислота может быть синтезирована из триптофана или аспарагиновой кислоты. *Псевдоалкалоиды носят в основном изопреноидный характер, и их биосинтез идет по пути образования терпеноидов. Азот вводится в неаминокислотный остаток. Основными реакциями при биосинтезе являются декарбоксилирование и окислительное дезаминирование или переаминирование аминокислот и диаминов, первичное метилирование (направляет циклизацию, стабилизирует молекулу алкалоида и делает ее менее токсичной; ферменты - метилтрансферазы), трансметилирование, а также циклизация алифатических соединений-предшественников до гетеро- и карбоциклических структур + конденсация. Реакции циклизации, имеющие при образовании алкалоидов универсальное значение, очень разнообразны и могут совершаться через азометин с образованием основания Шиффа, по типу конденсации Манниха, путем альдольной конденсации, через форму лактамной связи и т. д. Образование оснований Шиффа Основания Шиффа могут быть получены в результате реакции аминов с кетонами или альдегидами. Данная реакция является распространённым способом формирования C=N связи.
При биосинтезе алкалоидов реакция образования основания может проходить также внутримолекулярно. Примером может являться реакция образования 1-пиперидеина, происходящая при синтезе пиперидинового цикла:
Реакция Манниха В реакции Манниха, помимо амина и карбонильного соединения, участвует также карбанион, играющий роль нуклеофила в процессе присоединения к иону, образованному взаимодействием амина и карбонильного соединения.
Реакция Манниха также может осуществляться как межмолекулярно, так
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-17; просмотров: 331; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.019 с.) |







 2. Возвращение лактата в метаболический фонд углеводов. Лактат, образующийся в процессе анаэробного окисления глюкозы в эритроцитах и скелетных мышцах, транспортируется кровью в печень и превращается в гепатоцитах в глюкозу.
2. Возвращение лактата в метаболический фонд углеводов. Лактат, образующийся в процессе анаэробного окисления глюкозы в эритроцитах и скелетных мышцах, транспортируется кровью в печень и превращается в гепатоцитах в глюкозу.