Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Восстановление оксидов железа водородом
Вторым восстановителем НВ в доменной печи, является водород. Он образуется в горне при разложении влаги дутья и природного газа, если последний вдувают в доменную печь, а также летучих кокса. Количество водорода в газе составляет 1 – 2% если печь работает на увлажненном дутье. При вдувании природного газа содержание водорода в газе повышается до 6 – 12% и роль его в восстановительных процессах значительно возрастает. Восстановление оксидов железа водородом протекают по уравнениям: при температуре ниже 570° С
3Fe2О3 + H2 → 2Fe3О4 + H2О + 5210 ккал, (57) Fe3О4 + k'Н2 = 3 Fe + (k' - 4)Н2 + 4Н2O - 35240 ккал; (58)
при температуре выше 570° С
3Fe2О3 + H2 →2Fe3О4 + H2О +5210 ккал (59) Fe3О4 + m'H2 =3FeO + (m' - l)H2 + H2O - 14860 ккал, (60) FeO + n'H2 = Fe + (n' - l)H2 + H2O - 6620 ккал. (61)
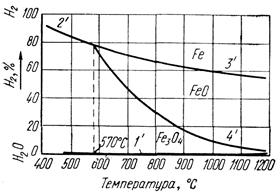
Реакция восстановления Fe2О3 до Fe3О4 идет необратимо, т. е. до полного использования Н2 или Fe2О3. Реакции восстановления Fe3О4 и FeO обратимы. Направление протекания реакции зависит от отношения Н2/Н2Огаз в газе и от температуры. Равновесный состав газовой смеси для реакций (57) – (61) зависит только от температуры, так как они идут без изменения объема газообразных веществ. На рисунке 26 показано равновесие газовых смесей Н2 и Н2Огаз с оксидами железа и железом в зависимости от температуры. Равновесные кривые делят диаграмму на три поля: Fe, FeO и Fe3О4.
Рисунок 26 - Кривые равновесия газовых смесей Н2 и Н2Огаз с оксидами железа и железом
Отличие диаграммы на рисунке 26 от диаграммы на рисунке 25 состоит в том, что равновесные кривые 2' и 3' с повышением температуры изображены нисходящими линиями, т. к. восстановление водородом Fe3О4 до Fe по реакции (58) и FeO до Fe по реакции (61) идет с поглощением тепла в отличие от аналогичных реакций восстановления оксидом углерода, где реакция восстановления FeO до Fe идет с выделением тепла. Для сопоставления восстановительной способности СО и Н2 совместим диаграммы равновесных газовых смесей Н2 - Н2Огаз и СО – СО2 с оксидами железа и железом. При температуре 810° С равновесные кривые 3 и 4 диаграммы на рисунке 25 пересекаются с соответствующими равновесными кривыми 3' и 4' на рисунке 26 (см. рисунок 27). В точках пересечения равновесных кривых отношение Н2/Н2Огаз равно отношению СО/СО2, т. е. восстановительная способность Н2 и СО, или их химическое сродство к кислороду, одинакова. При температуре ниже 810°С отношение Н2/Н2Огаз в равновесной смеси выше отношения СО/СО2, следовательно, для восстановления оксидов железа и железа водородом, его концентрация в газовой смеси должна быть выше, чем концентрация окиси углерода при восстановлении оксидом углерода. Это значит, что при температурах ниже 810° С химическое сродство водорода к кислороду выражено слабее, чем у оксида углерода, и он обладает меньшей восстановительной способностью.
Рисунок 27 - Кривые равновесия газовых смесей Н2 – Н2Огаз и СО – СО2 с оксидами железа и железом
При температуре выше 810 °С, наоборот, отношение Н2/Н2Огаз в равновесной смеси ниже отношения СО/СО2, т. е. восстановительная способность водорода выше, чем восстановительная способность окиси углерода. В связи с тем что ниже 810° С сродство к кислороду у окиси углерода больше, чем у водорода, СО может взаимодействовать с водяным паром, образующимся при восстановлении, например:
FeO + H2→Fe + H2Oгаз + Н 2 О газ + СО → Н 2 + СО 2 FeО +CO→ Fe + CО2. (62)
Аналогичные реакции можно написать для Fe2O3 и Fe3О4. Выше 810° С сродство к кислороду у окиси углерода меньше, чем у водорода, однако взаимодействие водорода с СО не получает развития по той причине, что при 900– 1000 °С и водяной пар, и диоксид углерода активно взаимодействуют с углеродом, превращаясь в водород и оксид углерода. Таким образом, водород в доменной печи как при умеренных, так и при высоких температурах является промежуточным реагентом или переносчиком кислорода от оксидов железа к оксиду углерода или углероду.
|
|||||
|
Последнее изменение этой страницы: 2017-02-17; просмотров: 2368; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.212.145 (0.005 с.) |