
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Фундаментальное адсорбционное уравнение Гиббса
Уравнение Гиббса связывает величину адсорбции со способностью растворенного вещества изменять поверхностное натяжение. Выводится из объединенного уравнения I и II законов термодинамики для внутренней энергии поверхностного слоя. I закон термодинамики dQ = dU + pdV, II закон термодинамики
Объединим оба закона dU + pdV = ТdS. Поскольку при адсорбции ПАВ на границе раздела жидкость-газ объем системы остается неизменным, pdV = 0. Тогда dU = ТdS. (2) В результате адсорбции происходит перераспределение компонентов между объемом фазы и поверхностным слоем, что приводит к изменению их химических потенциалов. Поэтому уравнение (2) необходимо дополнить двумя составляющими, характеризующими химическую и поверхностную энергии
где s – поверхностное натяжение раствора; s – суммарная поверхность раздела фаз; mi – химический потенциал i -го компонента в поверхностном слое; dni – бесконечно малое изменение концентрации i -го компонента в поверхностном слое. Уравнение (3) – дифференциальное уравнение первой степени относительно экстенсивных величин, стоящих под знаком дифференциала (S, s, ni), Согласно теореме Эйлера, такое уравнение можно интегрировать при постоянных значениях коэффициентов (интенсивных величин), т.е.
Рассматривая теперь любые возможные изменения системы, т.е. дифференцируя (4), получим
Вычтем из (5) уравнение (3)
Для изотермического процесса Т = const, SdT = 0. Разделим обе части (6) на s:
Отношение ni/s = Гi – избыток компонента i в поверхностном слое по сравнению с его концентрацией в объеме фазы – избыточная (гиббсовская) адсорбция, тогда
Уравнение (7) – фундаментальное адсорбционное уравнение Гиббса. Для двухкомпонентной системы, состоящей из растворителя 1 и растворенного вещества 2 уравнение (7) запишется – d s = Г 1 dm 1 - Г 2 dm 2. Если Г 1 << Г 2 – d s = Гdm.. (8) Поскольку уравнение (8) записано для одного компонента, индекс 2 можно опустить. Химический потенциал компонента m можно выразить через стандартный химический потенциал m* и активность компонента а: m = m* + RT ln a, dm = RTd ln a = RT
Для небольших концентраций
При высоких концентрациях
следовательно, уравнение Гиббса не описывает всю изотерму адсорбции, т.е. не работает при больших концентрациях.
Практическое значение уравнения Гиббса состоит в том, что с его помощью можно рассчитать адсорбцию по результатам измерения поверхностного натяжения. Непосредственно адсорбцию, т.е. количество вещества, содержащееся в поверхностном слое, можно определить методом меченых атомов или методом молекулярных срезов (когда с поверхности раствора с помощью прибора, напоминающего микротом, срезается очень тонкий слой жидкости и в нем определяется количество компонента). Методы эти очень трудоемки. На практике адсорбцию определяют, устанавливая зависимость поверхностного натяжения раствора s от концентрации ПАВ с.
|
|||||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 282; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.226.105 (0.004 с.) |
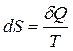 , откуда dQ = ТdS.
, откуда dQ = ТdS.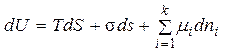 , (3)
, (3) . (4)
. (4) . (5)
. (5)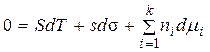 . (6)
. (6)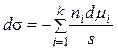 .
.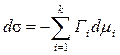 . (7)
. (7) ,
,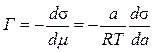 .
.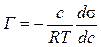 . (9)
. (9) ,
, Для расчета адсорбции по уравнению Гиббса необходимо при данной равновесной концентрации с найти значение производной (рис. 10):
Для расчета адсорбции по уравнению Гиббса необходимо при данной равновесной концентрации с найти значение производной (рис. 10): .
.


