
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ионная адсорбция из растворов
Ионная адсорбция — адсорбция из растворов сильных электролитов. В этом случае растворенное вещество адсорбируется в виде ионов. Ионная адсорбция является более сложным процессом по сравнению с молекулярной адсорбцией, так как в растворе присутствуют уже частицы как минимум 3 видов: катионы, анионы растворенного вещества и молекулы растворителя. Ионная адсорбция имеет ряд особенностей. 1 Адсорбируются заряженные частицы (ионы), а не молекулы; 2.Адсорбция происходит только на полярных адсорбентах, часто ее так и называют – полярная адсорбция; 3.Адсорбция сопровождается образованием двойного электрического слоя (ДЭС); 4.Адсорбция является избирательной, т. е. на данном адсорбенте катионы и анионы адсорбируются неодинаково. 5.В основе ионной адсорбции лежат химические силы, и она чаще всего кинетически необратима; 6.Для ионной адсорбции характерно явление обменной адсорбции. На ионную адсорбцию влияет рядфактров. 1 Химическая природа адсорбента Чем более полярным является адсорбент, тем лучше он адсорбирует ионы из водных растворов. На активных центрах, несущих положительный заряд, адсорбируются анионы, на отрицательных – катионы. 2. Химическая природа ионов а) На адсорбцию ионов большое влияние оказывает величина радиуса иона. Чем больше кристаллический радиус иона при одинаковом заряде, тем лучше он адсорбируется, так как с увеличением кристаллического радиуса иона возрастает его поляризуемость, а следовательно, способность притягиваться к полярной поверхности — адсорбироваться на ней. Одновременно увеличение кристаллического радиуса приводит к уменьшению гидратации иона, а это облегчает адсорбцию, В соответствии с этим ионы можно расположить в ряды по возрастающей способности к адсорбции, называемые лиотропными рядами: Li+ < Na+ < К+ < Rb+ < Cs+ Mg2+ < Ca2+ < Sr2+ < Ba2+ Сl– < Br– < NQ3– < I– < NCS–.
б)Чем больше заряд иона, тем сильнее ион притягивается противоположно заряженной поверхностью твердого тела, тем сильнее адсорбция: К+ << Са2+ << А13+ << Th4+.
Особый интерес для коллоидной химии представляет адсорбция ионов поверхностью кристалла, в состав которого входят такие же или родственные ионы. В этом случае адсорбцию можно рассматривать как кристаизацию, т.е. достройку кристаллической решетки способными адсорбироваться на ней ионами. Это позволило Панету и Фаянсу сформулировать следующее правило:
На кристаллической поверхности адсорбируются ионы, которые способны достраивать кристаллическую решетку и дают труднорастворимое соединение с ионами, входящими в кристалл. Так, если мы имеем кристалл хлорида серебра nAgCl, а в растворе ионы К+ и Сl–, то адсорбироваться на кристалле будут ионы Сl–. Ионообменная адсорбция Ионообменная адсорбция — это процесс, при котором твердый адсорбент обменивает свои ионы на ионы того же знака из жидкого раствора. Твердый адсорбент, практически нерастворимый в воде поглощает из раствора ионы одного заряда (катионы или анионы) и вместо них отдает в раствор эквивалентное число других ионов того же заряда. Такой обменный ионный процесс аналогичен обменным химическим реакциям, но только протекает на поверхности твердой фазы. Ионообменная адсорбция имеет следующие особенности: 1) специфична, т. е. к обмену способны только определенные ионы; 2) не всегда обратима; 3) протекает более медленно, чем молекулярная адсорбция; 4) может приводить к изменению рН среды. Вещества, проявляющие способность к ионному обмену, называются ионитами. В зависимости от того, какой вид ионов участвует в обмене, иониты подразделяются на катиониты и аниониты. Катиониты способны обменивать катионы, в т. ч. ион Н+, аниониты – анионы, в т. ч. ион ОН–. Существуют также амфолиты, которые в зависимости от условий способны проявлять как катионообменные, так и анионообменные свойства. Иониты имеют структуру в виде каркаса, «сшитого», обычно, ковалентными связями. Каркас имеет положительный или отрицательный заряд, скомпенсированный противоположным зарядом подвижных ионов (противоионов), которые могут легко заменяться на другие ионы с зарядом того же знака. Каркас выступает в роли полииона и обусловливает нерастворимость ионита в растворителях. Различают природные и синтетические иониты. Природные: алюмосиликатные материалы – гидрослюда, цеолиты и т.д. Синтетические: ионообменные смолы, сульфитированные угли, ионообменные целлюлозы.
Ионный обмен широко применяется в различных отраслях промышленности. Иониты применяют для очистки сточных вод, умягчения и обессоливания воды, при производстве сахара, молока (для изменения его солевого состава), вина (для предотвращения помутнения и понижения кислотности).
Адгезия и смачивание Адгезия (прилипание, сцепление, слипание) – поверхностное явление, заключающееся во взаимодействии частиц поверхностных слоев двух конденсированных фаз. Возможны три случая адгезии: адгезия между двумя жидкостями (ж-ж), между жидкостью и твердым телом (т-ж), между твердыми телами (т-т). С адгезией сталкиваемся повсеместно: при покрытии различных поверхностей лаком и краской, склеивании материалов и т.д. Адгезия бывает положительной (полезной) и отрицательной. Хорошая адгезия лакокрасочных покрытий определяет эксплуатационные и потребительские качества этих покрытий. Эффективность инсектицидных препаратов, применяемых для борьбы с сельскохозяйственными вредителями, во многом определяется адгезией капель или частиц этих препаратов к листьям растений. Здесь адгезия играет положительную роль. Адгезия грунта к лемеху плуга при вспашке требует дополнительных тяговых усилий, а, следовательно, и дополнительных затрат. Это отрицательная адгезия. В пищевой промышленности отрицательная адгезия связана с прилипанием пищевых масс (тесто, сгущенное молоко, сметана и т.п.) к стенкам оборудования, что обусловливает производственные потери. Еще одно отрицательное проявление адгезии – аутогезия (комкование). Например, аутогезия частиц сухого молока, кофе. Количественно адгезию характеризуют величиной работы адгезии Aадг, т.е. работой, затраченной на отрыв молекул одной фазы от молекул другой фазы.
Субстрат и адгезив находятся в воздухе 1 (рис. 23). Пусть s21 и s31 –поверхностное натяжение субстрата и адгезива на границе с воздухом соответственно. Gпов = s S, где S – площадь поверхности. Рассмотрим единицу площади поверхности субстрата и адгезива. Тогда суммарная поверхностная энергия системы в исходном состоянии
Совместим поверхности субстрата и адгезива (нанесем фазу 3 на фазу 2) (рис. 24). Суммарная поверхностная энергия при этом станет равной
где s23 – поверхностное натяжение на границе раздела субстрата и адгезива. Изменение поверхностной энергии
С точки зрения термодинамики для равновесного обратимого процесса
Тогда
Это уравнение впервые вывел Дюпре. Из уравнения Дюпре следует, что работа адгезии тем больше, чем больше поверхностные натяжения субстрата и адгезива и чем меньше конечное межфазное натяжение. При интенсивном взаимодействии частиц субстрата и адгезива молекулы поверхностных слоев проникают в противоположные фазы. В предельном случае исчезает граница раздела. Если поверхность субстрата имеет шероховатость, то это увеличивает силы адгезионного взаимодействия. Смачивание – частный случай адгезии – взаимодействие жидкости с твердой или более плотной жидкой фазой при наличии одновременного контакта трех несмешивающихся фаз, одна из которых газ (воздух).
Рассмотрим явление смачивания на примере капли жидкости, нанесенной на поверхность твердого тела. При этом возможны следующие случаи. 1 случай. Капля жидкости самопроизвольно растекается на поверхности, пока не покроет всю поверхность или пока слой жидкости не станет мономолекулярным. Это полное смачивание. Пример: капля воды на обезжиренном стекле. 2 случай. Капля жидкости на твердой поверхности самопроизвольно принимает почти сферическую форму. В этом случае говорят, что твердая поверхность не смачивается жидкостью, наблюдается полное несмачивание. Пример: капля ртути на неметаллической поверхности. Между этими крайними случаями наблюдаются различные промежуточные случаи, когда поверхность частично смачивается жидкостью. Количественной мерой смачивания служит краевой угол смачивания Q – угол между твердой поверхностью и касательной, проведенной к поверхности капли в точке соприкосновения трех фаз. Его измеряют со стороны жидкой фазы (рис. 25).
Воск, парафин, тефлон, твердые жиры – плохо смачиваются водой. Они неполярны, вода полярна. Линия пересечения всех трех поверхностей раздела называется линией смачивания. Замкнутая линия смачивания образует периметр смачивания. Угол смачивания зависит от поверхностного натяжения фаз.
  
газ с поверхностным натяжением sт-г и поверхность твердое тело – жидкость с поверхностным натяжением sт-ж (рис. 26). Равновесие капли определяется одновременным воздействием этих трех поверхностных натяжений, которые на рисунке показаны в виде векторов (направлены по касательной к соответствующей поверхности). Два из них (sт-г и sт-ж) действуют на поверхности твердого тела в противоположных направлениях. Сила sж-г направлена к поверхности под углом Q. При равновесии справедливо соотношение sт-г = sт-ж + sж-гcos Q,
Из уравнения Юнга следует, что смачивание зависит от поверхностного натяжения соприкасающихся фаз:
1) sт-г > sт-ж, cos Q > 0, Q < 90° – если поверхностная энергия фазы, на которую наносится жидкость больше поверхностной энергии на границе раздела твердое тело – жидкость, поверхность смачивается жидкостью, т.е. высокоэнергетические поверхности лучше смачиваются жидкостью; 2) sт-г < sт-ж, cos Q < 0, Q > 90° – в данном случае поверхность плохо смачивается жидкостью; 3) чем меньше поверхностное натяжение жидкости на границе с воздухом sж-г, тем жидкость лучше смачивает поверхность. Все жидкости по способности смачивать поверхность можно разделить на 3 группы: 1) вода – полярная жидкость, при t = 20 °С s = 7,2×10-2 Дж/м2 – высокоэнергетические поверхности (с большим sт-г) вода смачивает хорошо, низкоэнергетические – плохо; 2) органические растворители, s = (1,8-3,0)×10-2 Дж/м2 – обладают хорошей смачивающей способностью; 3) ртуть Hg, s = 46×10-2 Дж/м2 – не смачивает поверхность за исключением случаев, когда идет химическое взаимодействие. Адгезию жидкости и смачивание можно изменять за счет модификации свойств твердых поверхностей путем их гидрофобизации или гидрофилизации и за счет регулирования поверхностного натяжения жидкости. Вопрос для размышления: Как увеличить и как уменьшить смачиваемость поверхности (например, обуви)? Раздел III. ЭЛЕКТРИЧЕСКИЕ СВОЙСТВА ДИСПЕРСНЫХ
|
||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 908; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.183.89 (0.026 с.) |
 адсорбционная способность возрастает
адсорбционная способность возрастает усиление адсорбции
усиление адсорбции Субстрат (подложка) 2 – поверхность, на которую наносится вещество, наносимое вещество – адгезив 3.
Субстрат (подложка) 2 – поверхность, на которую наносится вещество, наносимое вещество – адгезив 3.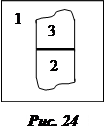
 .
.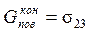 ,
, .
. .
. .
. Если Q < 90° – жидкость смачивает поверхность, Q > 90° – поверхность смачивается плохо или совсем не смачивается.
Если Q < 90° – жидкость смачивает поверхность, Q > 90° – поверхность смачивается плохо или совсем не смачивается. – уравнение Юнга.
– уравнение Юнга.


