
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Електротехнічні і конструкційні матеріалиСтр 1 из 15Следующая ⇒
Електротехнічні і конструкційні матеріали Конспект лекцій БУДОВА ТА ВЛАСТИВОСТІ МЕТАЛІВ ТА СПЛАВІВ План: Основні властивості металів, обумовлені їх будовою. Атомно-кристалічна будова металів. Загальні поняття про дислокації. КРИСТАЛІЗАЦІЯ План: Процеси плавлення та кристалізації. Термодинамічні основи фазових перетворень. Механізм процесу кристалізації. Криві охолодження. Форми кристалічних утворень. Будова сталевого злитка. Пластична деформація та рекристалізація металів і сплавів. План: Напруга і деформація. Руйнування металу. Мал.10
Той самий матеріал може знаходитися або у в’язкому, або у крихкому стані. Критерієм стану матеріалу є характер руйнування. Розрізняють в’язке і крихке руйнування. В’язке руйнування настає після значної пластичної деформації (δ і Ψ до десятків відсотків) під впливом дотичних напружень.
Поверхня зламу шорсткувата, на ній видні сліди кристалічної будови - відколи по границях зерен (інтеркристалічне руйнування) і по кристалам (транскристалічне руйнування). На крихке руйнування витрачається енергії менше, ніж на в’язке. На крихке руйнування впливають зниження температури, збільшення швидкості деформування і концентратори, що створюють складний напружений стан у деталях. У пластичних металів вплив концентраторів нейтралізується місцевою пластичною деформацією. Крихкому руйнуванню сприяють також внутрішні структурні фактори - обмеження рухливості дислокацій, ослаблення міцності зчеплення зерен за рахунок концентрації домішок на границях чи утворення крихких прошарків. Підвищення міцності супроводжується зниженням пластичності і в'язкості і збільшенням схильності до крихкого руйнування. Чим більші розміри деталі, тим вище схильність до крихкого руйнування (масштабний фактор). Це пояснюється збільшенням числа внутрішніх дефектів матеріалу. Існує багато способів оцінки переходу матеріалу з в’язкого стану в крихкий. Найбільш простим і чутливим способом є визначення ударної в'язкості:
αн = A/F[Дж/м2] де: А - робота руйнування; F - площа поперечного перерізу зразка. - пластичний стан αн >5-7 кгс - крихкий стан αн <1-2 кгс В основі пластичного деформування металів лежить переміщення дислокації практично при будь-яких температурах і швидкостях деформування. Сутність пластичного деформування - зсув, у результаті якого одна частина кристала зміщується стосовно іншої. Існують два різновиди зрушення: ковзання і двійникування.
Деформація ковзанням відбувається по площинам і напрямкам, на яких щільність атомів максимальна. Площина ковзання разом з напрямком ковзання, що належить цій площини, утворить систему ковзання. Ковзання починається під дією дотичної напруги, коли її величина перевищить певну критичну напругу зсуву αкр. Виглядає деформація ковзання так, як показано на малюнку 12. Деформація двійникуванням являє собою перебудову частини кристалу в нове положення, дзеркально-симетричне стосовно недеформованої частини кристалу. Площина, стосовно якої здійснюється дзеркальна симетрія, називається площиною двійникування. При двійникуванні атомні площини зрушуються паралельно площині двійникування на різні відстані. У порівнянні з ковзанням двійникування займає другорядне положення. Деформація за рахунок двійникування завжди менше деформації ковзання. У металах з ОЦК і ГЦК ґратками двійникування спостерігається лише при низьких температурах і високих швидкостях деформування. У металах з ГК ґраткою, де небагато систем ковзання, деформування при нормальних умовах супроводжується двійникуванням (роль двійникування зростає). Ковзання здійснюється в результаті переміщення в кристалі дислокації. Дислокації переміщуються в кристалах двома способами - ковзанням і переповзанням. При ковзанні дислокація легко рухається в тій площині, в якій знаходиться дислокаційна лінія. Дислокація як би передається за естафеті від однієї атомної площини до іншої. Переповзання - це дифузійний зсув дислокаційної лінії чи її частини внаслідок приєднання вакансій чи міжвузлових атомів, при цьому дислокація з однієї площини ковзання переходить в іншу. Переповзання має вплив, коли в ґратках збільшена щільність вакансій (при нагріванні і великих ступенях деформації). Зміцнення металів під дією пластичної деформації називається наклепом. В основі наклепу лежить ріст опору руху дислокацій в міру збільшення ступеня деформації. При русі дислокацій збільшується їхня кількість, а також кількість інших дефектів (вакансій, міжвузлових атомів).
Внаслідок пружної взаємодії між дислокаціями опір їхньому рухові сильно зростає, зростає опір зсуву, тобто збільшується міцність. У результаті пластичного холодного деформування метал зміцнюється, зменшується опір корозії, щільність, підвищується електроопір, змінюються магнітні властивості. Наклепаний метал має підвищений запас вільної енергії. Запасена енергія витрачається на утворення викривлень гратки (наприклад, щільність дислокації зросте до 109 Залежність механічних властивостей від ступеня деформації зображеної на малюнку 14. Пластична деформація призводить метал у структурно нестійкий стан. Мимовільно повинні відбуватися явища, що повертають метал у більш стійкий структурний стан. До мимовільних процесів, що призводять пластично деформований метал до більш стійкого стану, відносяться: зняття викривлення кристалічних ґраток, зменшення щільності дефектів будови, ріст зерен. Зняття викривлень гратки в процесі нагрівання деформованого металу називається поверненням. У результаті цього процесу, що відбувається при нагріванні, твердість і міцність дещо понижуються (на 20-30%), а пластичність зростає. Поверненням називають усі зміни тонкої структури та властивостей, які не супроводжуються зміною мікроструктури деформованого металу, тобто розмір та форма кристалів при поверненні не змінюється. Розрізняють дві стадії повернення. Перша стадія – спочинок, протікає при більш низьких температурах (нижче 0,2 Тпл) коли відбувається зменшення точкових дефектів (вакансій) та перерозподіл дислокацій без утворення нових субграниць. Друга стадія – полігонізація (протікає не завжди, лише після невеликих деформацій) і полягає в утворенні нових мало кутових границь субзерен (полігонів) в межах кожного кристалу. Протікає при більших температурах (~ 0,25; 0,3 Тпл). При подальшому збільшенні температури рухомість атомів зростає і при досягненні Т=(0,4
По завершенні первинної рекристалізації відбувається зростання зерен, що утворились. Ця стадія рекристалізації називається збиральною рекристалізацією і не пов’язана із попередньою пластичною деформацією металу. Цей процес самочинно розвивається при достатньо високих температурах в зв’язку з тим, що збільшення зерен призводить до зменшення вільної енергії метала через зменшення поверхневої енергії. Зростання зерен відбувається шляхом переходу атомів від одного зерна до сусіднього через границю розділу. Одні зерна ростуть, поглинаючи сусідні. Із збільшенням температури ріст зерна прискорюється. Чим більша температура нагрівання, тим більшими стануть рекристалізовані зерна. Рекристалізація повністю знімає наклеп, створений при пластичній деформації, метал набуває рівноважну структуру з мінімальною кількістю дефектів кристалічної будови. Відновлюються всі фізичні властивості. ДІАГРАМА СТАНУ План: Правило відрізків. 3. Діаграми склад-властивості (Курнакова - Матисена). 1. Усі перетворення, що протікають в сплавах у залежності від температури і концентрації, можна зобразити наочно, що здійснюється на діаграмах стану. Діаграма стану - це графічне зображення фазового стану сплавів даної системи в залежності від температури та концентрації.
Діаграми стану дають у наочній формі картину зміни будови і властивостей сплаву при зміні його концентрацій і температури, дозволяють визначити температури плавлення, твердіння й алотропічних перетворень у сплавах, вивчити походження структур, що спостерігаються під мікроскопом, і зв’язати структуру сплаву з його механічними, технологічними і фізико-хімічними властивостями.
Мал. 15 Загальний вміст обох компонентів у сплаві дорівнює 100%. і кожна точка на осі абсцис відповідає певному вмісту кожного компонента. По мірі віддалення від точки А збільшується кількість компонента В і в точці В=100%. Кожна точка на діаграмі стану показує стан сплаву даної концентрації при даній температурі. Звичайно діаграми стану будують експериментально. Для визначення температур фазових переходів застосовують термічний аналіз. При цьому одержують експериментальні криві охолодження і по перегинах, які зв'язані з тепловими ефектами перетворень, визначають критичні температури (точки). Для дослідження перетворень, які проходять у сплаві у твердому стані застосовують рентгено - і мікроструктурний, магнітний і інші методи. Діаграми, на яких зображені фази в сплаві (тверді розчини, хімічні з’єднання чи механічні суміши), називають фазовими. Але, при вивченні будови сплавів під мікроскопом спостерігаються як фази, так і структурні складові сплаву, котрі мають певний розмір, форму та розташування. Діаграмами стану, в яких показані структурні складові, отримали назву структурні. Мікробудова сплаву обумовлює їх фізико-механічні, технологічні та експлуатаційні властивості. Розглянемо діаграму стану двохкомпонентних сплавів для випадків, коли обидва компонента нескінченно розчинні у жидком стані, а у твердому стані не розчинні, створюють механічну суміш. Такі діаграми умовно називають діаграми стану першого типу. Компонентами А і В, що складають розглянутий сплав, можуть служити як чисті елементи, так і хімічні сполуки. Криві охолодження компонентів і сплавів різних складів зображені на малюнку ліворуч і праворуч від діаграми.
Мал. 16 На відміну від чистих компонентів, усі сплави за невеликим винятком кристалізуються в інтервалі температур. Причому, спочатку кристалізується тільки один з компонентів, тому що спільна кристалізація компонентів у випадку утворення механічної суміші можлива тільки при визначеній їх концентрації в розплаві. У нашому випадку такою концентрацією є 13% олова і 87% свинцю. При такій концентрації спільна кристалізація протікає при постійній температурі аналогічно кристалізації чистого компоненту. У сплавах, що відрізняються за складом від сплаву зі 13% олова спочатку кристалізується тільки один з компонентів: Pb - у випадку якщо концентрація Sn у сплаві менша 13%; i Sn – якщо концентрація Sn в сплаві більша 13%, при кристалізації надлишкового компоненту його рідкої фази все більше наближається до концентрації при якій можлива одночасна кристалізація обох компонентів тобто до 13% Sn і 87% Pb. Процес кристалізації будь-якого сплаву даної системи завершується одночасним утворенням кристалів речовин А(Pb) і В(Sn). При спільній кристалізації утворюється дисперсна суміш найдрібніших дендритів речовини В і кристалів речовини А, в товщі яких вони залягають. Такі суміші називають евтектиками. Це сплави утворені в результаті одночасної кристалізації різних компонентів при постійній температурі. Евтектики мають постійний хімічний склад і найнижчу температуру кристалізації для даної системи сплавів. Крива кристалізації евтектичного сплаву буде мати такий же вигляд, як і крива кристалізації чистого компонента. У сплавах заевтектичних (>13%Sn), спочатку кристалізується компонент В. При зменшенні концентрації компонента В у рідкій фазі до 13% в кристалізацію вступає також і компонент А, що призводить до утворення евтектики. Критичні точки початку і кінця кристалізації переносять з кривих охолодження на діаграму, де по вісі ординат - температура, по вісі абсцис – склад сплаву. Точки початку і кінця кристалізації з’єднують плавними лініями і одержують діаграму стану. Верхня ламана лінія АСВ відповідає початку кристалізації (кінець плавлення) і називається лінія ліквідус, лінія ДСЕ відповідає
кінцю кристалізації (початок плавлення) і називається лінією солідуса. Вище ліквідуса - сплави в рідкому стані. Між ліквідусом і солідусом йде процес кристалізації, і сплави складаються з твердої та рідкої фаз. Нижче лінії солідуса сплави складаються з різних твердих фаз. Якщо компоненти сплавів значно відрізняється за густиною, то кристали які виділяються, будуть нерівномірно розподілені в рідкому сплаві. Більш важкі кристали осаджуються на дні форми. До моменту повної кристалізації евтектика виявляється переважно зверху, кристали більш важкого надлишкового компоненту знизу. В результаті хімічний склад в різних об’ємах злитку чи виливки буде не однорідним. Це явище носить назву ліквації за густиною (питомою вагою). Усунути її можна розмішуючи або струшуючи сплав який затвердіває. Сплави близькі за складом до евтектичного широко застосовуються в техніці через низьку температуру плавлення і кращі ливарних властивостей. Кількість і склад фаз у процесі кристалізації можна визначити по правилу відрізків (мал.19). Для визначення хімічного складу фаз через точку, що характеризує сплав, проводять горизонтальну пряму до перетину з найближчими лініями діаграми, при цьому проекція точок перетину на вісь абсцис покаже хімічний склад фаз. Кількісне співвідношення між масою рідкої фази і масою твердої фази визначається співвідношенням відрізків КL і NL. Користаючись концентраційними відрізками на осі абсцис можна знайти необхідну величину Qр /Qтв =КL/NL
 Діаграма стану другого типу для випадку необмеженої розчинності компонентів у твердому стані. У цьому випадку кожен кристал будується сумісно Діаграма стану другого типу для випадку необмеженої розчинності компонентів у твердому стані. У цьому випадку кожен кристал будується сумісно
атомами обох речовин і тому в Мал. 17 результаті кристалізації виходить сплав, що складається з однотипних кристалів твердого розчину. На кривих охолодження температури кристалізації сплавів лежать між температурами кристалізації вихідних компонентів. У процесі кристалізації твердого розчину змінюється склад як рідкої, так і твердої фаз. Наприклад, у сплаві 1 центри кристалізації, які виникли при кристалізації, будуть відповідати точці 0 при зниженні температури, наступні шари зерна будуть мати вже концентрацію, що відповідає точці 0 і т.д.. Мал. 18 Тільки наприкінці кристалізації (точка В') складу кристалів твердого розчину буде відповідати концентрація сплаву 1. При швидкому охолодженні неоднорідність по об’єму зерна, що виникла в процесі кристалізації, може зберегтися і зветься дендритною ліквацією. Зміна хімічного складу поблизу границь зерен внаслідок дендритної ліквації може привести до міжкристалічної корозії в хромонікелевих сталей. Дендритна ліквація може бути усунута шляхом тривалої витримки сплавів при високих температурах. Нижче лінії солідус AbB (AqB- ліквідус) усі сплави системи складаються з кристалів твердого розчину різної концентрації. Необмежена розчинність у твердому стані зустрічається порівняно рідко. Значно частіше утворяться сплави з обмеженою розчинністю у твердому стані. Діаграма стану 3
типу для випадку обмеженої розчинності у твердому стані зображена на малюнку 18. При кристалізації компонент В розміщується в гратках компонента А в атомарному вигляді з утворенням твердого розчину a з максимальною концентрацією, що відповідає точці Е при температурі tl. У тому випадку, якщо компонент А в гратках компонента В розміститися не може, область твердого розчину з боку компонента В відсутня. За межею насичення (точка С), коли з'являється друга фаза (компонент В) і утвориться евтектика, лінія солідус стає горизонтальною (ЕД). Таким чином, діаграма стану з обмеженою розчинністю сполучить у собі два попередні типи діаграм.
Діаграма стану 4 типу для випадку утворення хімічної сполуки. Виникає хімічна сполука, якщо вона стійка і не розкладається аж до температури плавлення, поводиться в процесі кристалізації так як і чистий компонент. Вид діаграми стану буде залежати від того. як утворена хімічна сполука взаємодіє з вихідними компонентами в процесі кристалізації.
Мал. 20 Для аналізу такої діаграми її зручно розділити на дві: діаграма компоненту А і хімічної сполуки AmBn і діаграму компонента В і хімічної сполуки АmВn. Евтектики в точках С и Д складаються з кристалів хімічної сполуки й елемента А (ліва частина діаграми) чи В (права частина). Можливий випадок, коли компоненти обмежено розчинні у твердому стані й утворять механічні суміші в результаті реакції. На відміну від діаграми евтектичного типу, в цій системі кристали, що випали з рідини, одного твердого розчину, реагуючи з рідиною, що залишилася, утворять кристали іншого твердого розчину. Же+bе®aд+Же ділянка СД Же+bе®aд+bе ділянка ДЕ Остаточно затверділий сплав буде складатися з a (під АД) a + b (під ДЕ) b (під ЕВ)
Для визначення концентрації компонентів користуються однією із двох геометричних властивостей рівносторонніх трикутників:
Мал.24 2) сумарна довжина трьох відрізків, відітнутих на сторонах рівностороннього трикутника прямими, паралельними його сторонам, проведеними через будь-яку точку всередині його, є величиною постійною, рівною довжині сторони трикутника (мал. 24). Залежність між хімічним складом, структурою і властивостями сплавів встановлена Н.С. Курнаковим, що розробив методи фізикохімічного аналізу металів. Ця залежність виражається графічно у вигляді діаграм склад - властивості (мал. 25). При утворенні механічної суміші властивості сплавів (твердість, електроопір, коерцитивна сила) змінюються лінійно (а). Отже, властивості сплавів мають середнє значення з кількісних значень властивостей компонентів. У сплавах, що утворюють твердий розчин з необмеженою розчинністю, властивості змінюються по криволінійній залежності, вже при невеликих домішках другого компоненту твердість, міцність, електричний опір і коерцитивна сила сплавів підвищуються і стають вище властивостей компонентів, а електропровідність і магнітна проникність понижуються. У сплавах, що утворюють тверді розчини з обмеженою розчинністю, властивості в областях, що відповідають твердим розчинам, змінюються по криволінійній залежності, а в областях, що відповідають механічної суміші — по лінійній залежності.
деформованість, оброблюваність різанням та інші. За даними дослідника Л. А. Бочвара, велика відстань між лініями ліквідуса та солідуса на діаграмі стану вказує на схильність сплаву до ліквації за густиною, утворенню розсіяних усадочних раковин і стовпчастої структури, до появи тріщин у виливках. Кращими ливарними властивостями володіють двохфазні сплави, особливо евтектичні, що є найбільш легкоплавкими. Краще деформуються в холодному і гарячому стані однофазні сплави - тверді розчини, що мають менший опір пластичному деформуванню. Якщо в сплаві немає дуже твердих фаз, що зношують різальний інструмент, то двохфазні сплави обробляються різанням легше, ніж однофазні. Але однофазні сплави мають кращий опір корозії, ніж двохфазні. Особливо велике значення мають діаграми стану для вирішення питання про можливість термічної обробки сплавів.
ЗАЛІЗОВУГЛЕЦЕВІ СПЛАВИ Вторинна кристалізація. У сплавах Fe-Fe3C у твердому стані протікають алотропічні перетворення Feγ і Feα і розпад твердих розчинів γ і α, обумовлений зміною розчинності вуглецю в залізі γ при пониженні температури. Feγ при 9110С (точка G перетворюється в Feα-модификацію, яка розчиняє С в незначній кількості 0,02% при 727оС). У зв'язку з алотропічним перетворенням, утворений при первинній кристалізації аустеніт нижче лінії РSК існувати не може і при повільному охолодженні розпадається на евтектоїдну суміш (перліт). Виділення фериту відбувається по лінії GS, а вторинного цементиту по лінії SE. Лінія GS є геометричним місцем точок Ас3 при нагріванні й А23 - при охолодженні, а лінія SE - геометричним місцем точок, що відповідають виділенню з аустеніту вторинного цементиту. Він позначається як Аст. Закінчення алотропічного перетворення Feγ в Feα і розпад твердого розчину γ в усіх сплавах (як сталях, так і в чавунах) спостерігається при одній температурі 727оС; точку, що відповідає цій температурі, позначають А1 (Ас1 - при нагріванні і А21 - при охолодженні). Нижче кривої РQ (область IX) відбувається розпад α-твердого розчину з виділенням з нього третинного цементиту.
I - рідкий розчин; II - рідкий розчин + аустеніт; III - рідкий розчин + цементитI; IV - аустеніт; V - аустеніт + ферит; VI - аустеніт + цементитII; VII - ледебурит + аустеніт +цем-тII; VIII – ферит; IIX - ферит + цементитIII; X - ферит + перліт; XI - перліт + цементитII; XII - лед-рит/перліт + цем-т/ перліт +цем.II XIII - ледебурит + цементитI; XIV - лед-рит/перліт + цементит/цем.I
В залежності від вмісту вуглецю і мікроструктури, при кімнатній температурі сплави по діаграмі підрозділяють на дві групи: сталі та чавуни. Сплави зі вмістом вуглецю до 2,14% (немає ледебуриту) називають сталями, а зі вмістом вуглецю понад 2,14% (у структурі - ледебурит) - чавунами. В залежності від концентрації вуглецю та структури, сталі й чавуни поділяють на: -доевтектоідні сталі (до 0,8% С) - структура ферит +перліт; -евтектоідну сталь (0,8% С) - структура перліт; -заевтектоідні сталі (більше 0,8% і до 2,14% С) - структура перліт + цементит вторинний; -доевтектичні чавуни (2,14 - евтектичний чавун (4,3% С) - структура ледебурит; - заевтектичні чавуни (більше 4,3 і до 6,67% С) - структура ледебурит/перліт + цементит/ + цементит первинний;. Розглянута діаграма стану Fe-Fe3C не є рівноважною (є метастабільною), тому що отримана в умовах швидкого охолодження. Якщо залізовуглецеві сплави піддавати дуже повільному охолодженню чи вводити в них кремній та інші елементи, що сприяють графітизації, то замість цементиту може бути отримано вуглець у вільному стані у вигляді графіту, що є продуктом розпаду цементиту по реакції Fe3C=3Fe+C чи виділяється безпосередньо з рідкого розчину. Діаграма стану сплавів залізо-графіт зображується пунктирними лініями. Лінії діаграм Fe-Fe3C і залізо-графіт не співпадають тому, що при всіх температурах межа розчинності графіту в залізі менша, ніж цементиту. Евтектична (1152о С) та евтектоідна температура в системі графіт вище, ніж у системі Fe-Fe3C. Діаграма стану залізо-графіт - рівноважна (стабільна). За нею вивчають сірі чавуни, структурною ознакою яких є наявність графіту, що виділяється на структурній основі. На практиці системи Fe-Fe3C і залізо-графіт зустрічаються разом, наприклад, сірий чавун, структура якого містить і графіт, і цементит, і перліт. Діаграма стану залізовуглецевих сплавів – найважливіша діаграма в металознавстві і має велике практичне значення. Вона може бути використана при визначенні температур плавлення та кристалізації сталі і чавунів у ливарній справі, температурних інтервалів гарячої обробки сталі тиском, а також температур нагрівання сталі при різних видах хімічної і хіміко-термічної обробки. А - 210 °С Магнітне перетворення Fe3C А3 - GS А1- 727 °С Перлітне перетворення A4 - 1400°С А2- 763 °С Магнітне перетворення Fe Aст - SE
ТЕРМІЧНА ОБРОБКА СТАЛІ План: Мал.30 Збільшення швидкості охолодження від V1 до Vkp викликає зниження температури перлітного перетворення. При безупинному охолодженні воно розвивається в інтервалі температур (мал. 30/а точки 1-2). Лише при дуже повільному охолодженні воно відбудеться при постійній температурі Ar1. Нерівновісні температури початку перлітного перетворення, на відміну від рівноважної температури Ar1 ,прийнято позначати Ar '. Видно (мал. 30/б), що при збільшенні Vохл зростає дисперсність перлітних структур, що утворюються: перліт заповнюється сорбітом і потім трооститом. При швидкостях охолодження, більших Vkp, аустеніт переохолоджується до температури Мн , починаючи з якої відбувається мартенситне перетворення, тобто протікає бездифузійний процес розпаду А з утворенням однієї нерівноважної структури - мартенситу. При цьому хімічний склад мартенситу не відрізняється від складу вихідного аустеніту. Міn Vохл при якій у структурі сталі утвориться мартенсит називають критичною швидкістю гартування.. При мартенситному перетворенні відбувається перехід Fеγ у Fеα. Мартенсит є упорядкованим пересиченим розчином включення вуглецю в α - залізо і має тетрагональну гратку (с/а=І+0, 046 % С в аустеніті). Атоми вуглецю займають октаедричні пори уздовж осі (00I) у ґратках a-заліза і дуже її спотворюють. Мартенсит гартування має характерну голчасту будову. Голки розташовані паралельно одна одній і перетинаються під кутом 60° чи 120°, що є результатом орієнтування їх по визначених площинах у гратці відносно аустеніта (А). Мартенситне перетворення в сталях відбувається в інтервалі температур (Мк температура кінця перетворення). Кожній температурі в цьому інтервалі відповідає певна частка аустеніту, що розпався. Щоб перетворення відбулося з найбільшою повнотою, потрібно провести охолодження аж до температури Мк. Температури Мн і Мк залежать від багатьох факторів (однорідність аустеніта (А), розмір зерна), але визначальним є хімічний склад аустеніта (А). Зі збільшенням вмісту вуглецю в аустеніті (А) температурний інтервал перетворення зміщується убік більш низьких температур. При вмісті С=0,5%, температура Мк стає рівною кімнатній. Якщо сталь зі вмістом С великим 0,5% охолоджена до кімнатної температури, то збереглася деяка частина аустеніту (А), який не розпався. Не перетворений аустеніт (А), що міститься в структурі Мал. 31
легуючих елементів знижують температури Мн і Мк. Збереження вуглецю у твердому розчині при мартенситному перетворенні викликає викривлення ґратки Fеa, яке збільшується з підвищенням вмісту вуглецю в аустеніті (А). Мартенсит має дуже високу твердість, рівну чи перевищуючу НRC 60 при вмісті C > 0,4%. Мартенситне перетворення в сталях супроводжується помітним збільшенням об'єму. Vкр - найважливіша технологічна характеристика сталі. Вона визначає вибір охолоджуючих середовищ при отриманні мартенситу (М), найтвердішої структури сталі. Легуючі елементи, які збільшують стійкість переохолодженого аустеніту, зменшують критичну швидкість охолодження.
3. Нагрівання гартованих сталей до температур нижче точки А називають відпуском. У результаті гартування частіше усього одержують структуру тетрагонального мартенситу з деякою кількістю залишкового аустеніту (А). При відпуску відбувається кілька процесів: основний - розпад мартенситу, який складається із виділення вуглецю у вигляді карбідів, крім того, розпадається залишковий аустеніт (А), відбувається карбідне перетворення і коагуляція карбідів, зменшуються недосконалості кристалічної будови a - твердого розчину, зменшуються залишкові напруження. Для вивчення перетворень, що протікають у сталі при відпуску застосовують в основному рентгенографічний, металографічний і дилатометричний методи дослідження. Ці методи дозволили визначити, що при відпуску гартованої сталі, протікають чотири перетворення. Перше перетворення відбувається при нагріванні гартованої сталі до Т=80 пластинки карбіду, когерентно зв'язані з твердим розчином. Це e-карбід з гексагональними ґратками і формулою близькою до Fe2C. У результаті першого перетворення виходить відпуще
|
||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 177; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.143.239 (0.104 с.) |
 Поверхня зламу має чашковий вигляд без яких-небудь явних ознак кристалічної будови. В’язкі злами називають волокнистими. Крихке руйнування настає без видимих пластичних деформацій (δ і Ψ близькі до нуля).
Поверхня зламу має чашковий вигляд без яких-небудь явних ознак кристалічної будови. В’язкі злами називають волокнистими. Крихке руйнування настає без видимих пластичних деформацій (δ і Ψ близькі до нуля). м/см2
м/см2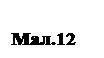

 1012 см-2) і на пружні викривлення ґраток. Властивості наклепаного металу міняються тим сильніше, чим більше ступінь деформації. При деформації збільшуються характеристики міцності (твердість,
1012 см-2) і на пружні викривлення ґраток. Властивості наклепаного металу міняються тим сильніше, чим більше ступінь деформації. При деформації збільшуються характеристики міцності (твердість,  b,
b,  0,2,
0,2, 
 Метали інтенсивно наклепуються в початковій стадії деформації, після 40%-ої деформації механічні властивості міняються незначною мірою. Зі збільшенням ступеня деформації границя текучості
Метали інтенсивно наклепуються в початковій стадії деформації, після 40%-ої деформації механічні властивості міняються незначною мірою. Зі збільшенням ступеня деформації границя текучості 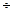 0,8)Тпл для металів технічної частоти утворюються нові рівноважні зерна. Утворення нових рівновісних зерен замість орієнтованої волокнистої структури деформованого металу називається первинною рекристалізацією. Температура початку рекристалізації залежить від ступеня деформації, тривалості нагрівання, величини зерна до деформації для технічно чистих металів становить 0,4 Тпл, для сплавів твердих розчинів зростає до (0,5-0,6)Тпл. Для повного зняття наклепу метал нагрівається до більш високих температур, щоб забезпечити високу швидкість рекристалізації і повноту її протікання. Така термічна обробка отримала назву рекристалізаційний відпал.
0,8)Тпл для металів технічної частоти утворюються нові рівноважні зерна. Утворення нових рівновісних зерен замість орієнтованої волокнистої структури деформованого металу називається первинною рекристалізацією. Температура початку рекристалізації залежить від ступеня деформації, тривалості нагрівання, величини зерна до деформації для технічно чистих металів становить 0,4 Тпл, для сплавів твердих розчинів зростає до (0,5-0,6)Тпл. Для повного зняття наклепу метал нагрівається до більш високих температур, щоб забезпечити високу швидкість рекристалізації і повноту її протікання. Така термічна обробка отримала назву рекристалізаційний відпал. У залежності від характеру взаємодії компонентів сплавів у твердому стані розрізняють 4 основних типи діаграм стану подвійних сплавів. Діаграми стану подвійних сплавів будують у двох вимірах: по осі ординат відкладають температуру, по осі абсцис - концентрацію у вагових %(мал..15).
У залежності від характеру взаємодії компонентів сплавів у твердому стані розрізняють 4 основних типи діаграм стану подвійних сплавів. Діаграми стану подвійних сплавів будують у двох вимірах: по осі ординат відкладають температуру, по осі абсцис - концентрацію у вагових %(мал..15).

 Оскільки межа насичення змінюється зі зміною температури, концентрація a-твердого розчину при кімнатній температурі буде менша, ніж у точці Е. Усі сплави з концентрацією компонента В меншою, ніж у точці Е', при кристалізації утворять насичені a-тверді розчини і при охолодженні нижче лінії солідус не мають структурних перетворень. Сплави, що знаходяться по концентрації між точками Е и Е' при охолодженні мають структурні перетворення, що полягають в утворенні у зернах чи по границях a-твердого розчину вторинних кристалів елемента В. Ці кристали з'являються при охолодженні сплаву до лінії ЕЕ' (нижче її), коли a- кристали стають перенасиченими компонентом В для даної температури. При концентраціях елемента В, більших ніж межа насичення (точка Е), утворяться сплави з надлишковим вмістом кристалів чистого компонента В (заевтектичні). Сплав, що відповідає по концентрації точці С, має евтектичну будову.
Оскільки межа насичення змінюється зі зміною температури, концентрація a-твердого розчину при кімнатній температурі буде менша, ніж у точці Е. Усі сплави з концентрацією компонента В меншою, ніж у точці Е', при кристалізації утворять насичені a-тверді розчини і при охолодженні нижче лінії солідус не мають структурних перетворень. Сплави, що знаходяться по концентрації між точками Е и Е' при охолодженні мають структурні перетворення, що полягають в утворенні у зернах чи по границях a-твердого розчину вторинних кристалів елемента В. Ці кристали з'являються при охолодженні сплаву до лінії ЕЕ' (нижче її), коли a- кристали стають перенасиченими компонентом В для даної температури. При концентраціях елемента В, більших ніж межа насичення (точка Е), утворяться сплави з надлишковим вмістом кристалів чистого компонента В (заевтектичні). Сплав, що відповідає по концентрації точці С, має евтектичну будову. На мал.20 представлена діаграма для випадку роздільної кристалізації хімічних сполук і вихідних компонентів.
На мал.20 представлена діаграма для випадку роздільної кристалізації хімічних сполук і вихідних компонентів. Зміна кристалічної структури при алотропічному перетворенні відбувається в твердому стані і називається вторинною кристалізацією. У випадку, коли алотропічне перетворення відбувається у чистому металі, що входить у структуру затверділого сплаву, вона відбувається для будь-якого складу сплаву при постійній температурі на горизонтальній лінії. Якщо алотропічне перетворення відбувається в одному з компонентів твердого розчину, то у твердому розчині може змінюватися концентрація за рахунок постійного виділення з нього a-фази.
Зміна кристалічної структури при алотропічному перетворенні відбувається в твердому стані і називається вторинною кристалізацією. У випадку, коли алотропічне перетворення відбувається у чистому металі, що входить у структуру затверділого сплаву, вона відбувається для будь-якого складу сплаву при постійній температурі на горизонтальній лінії. Якщо алотропічне перетворення відбувається в одному з компонентів твердого розчину, то у твердому розчині може змінюватися концентрація за рахунок постійного виділення з нього a-фази. В техніці широко використовують сплави, утворені трьома і більшим числом компонентів. Для характеристики фазових перетворень у потрійних сплавах застосовують потрійні діаграми стану. Вони являють собою просторові фігури, на плоскій основі, на яких зображується склад сплавів, а по вертикальній осі -температура. Склад потрійних сплавів зображують на площині рівностороннього трикутника, названого концентраційним трикутником. На сторонах трикутника лежать точки, що виражають склади подвійних сплавів у вершинах - точки, що відповідають чистим компонентам. Будь-яка точка всередині трикутника відповідає складу потрійного сплаву. Вершини трикутника відповідають 100%-му вмісту компонентів А, В, С (мал. 23).
В техніці широко використовують сплави, утворені трьома і більшим числом компонентів. Для характеристики фазових перетворень у потрійних сплавах застосовують потрійні діаграми стану. Вони являють собою просторові фігури, на плоскій основі, на яких зображується склад сплавів, а по вертикальній осі -температура. Склад потрійних сплавів зображують на площині рівностороннього трикутника, названого концентраційним трикутником. На сторонах трикутника лежать точки, що виражають склади подвійних сплавів у вершинах - точки, що відповідають чистим компонентам. Будь-яка точка всередині трикутника відповідає складу потрійного сплаву. Вершини трикутника відповідають 100%-му вмісту компонентів А, В, С (мал. 23). 1) сумарна довжина всіх перпендикулярів, опушених з будь-якої точки, що знаходиться всередині рівностороннього трикутника, на кожну з його сторін - постійна і дорівнює його висоті.
1) сумарна довжина всіх перпендикулярів, опушених з будь-якої точки, що знаходиться всередині рівностороннього трикутника, на кожну з його сторін - постійна і дорівнює його висоті. При утворенні стійких хімічних сполук, твердість, електричний опір і коерцитивна сила різко підвищуються.
При утворенні стійких хімічних сполук, твердість, електричний опір і коерцитивна сила різко підвищуються. Знаючи діаграми стану, можна визначити технологічні властивості сплавів: ливарні,
Знаючи діаграми стану, можна визначити технологічні властивості сплавів: ливарні, 4,3% С) - структура ледебурит/перліт + цементит/ + перліт + цементит вторинний;
4,3% С) - структура ледебурит/перліт + цементит/ + перліт + цементит вторинний;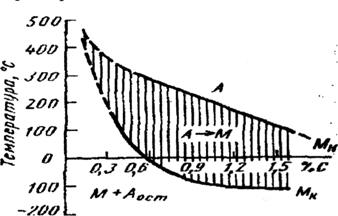 гартованої сталі, називають залишковим. 1-3% залишкового аустеніту (А) зберігається й у сталях, температура Мк яких вище кімнатної, що пов'язують з появою значних стискаючих напруг, які виникають унаслідок збільшення об’єму при переході ґратки з ГЦК в ОЦК. Переважна більшість
гартованої сталі, називають залишковим. 1-3% залишкового аустеніту (А) зберігається й у сталях, температура Мк яких вище кімнатної, що пов'язують з появою значних стискаючих напруг, які виникають унаслідок збільшення об’єму при переході ґратки з ГЦК в ОЦК. Переважна більшість


