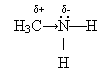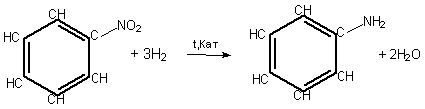Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Отримання і хімічні властивості естерів⇐ ПредыдущаяСтр 16 из 16
Отримання 1. Етерифікація за Фішером (взаємодія спиртів і карбонових кислот у присутності сильних неорганічних кислот, наприклад, сульфатної кислоти) C2H5OH + CH3COOH = CH3COOC2H5 Дана реакція є зворотною і умови її протікання залежать від природи вихідних речовин.
Хімічні властивості 1. Кислотний гідроліз CH3COOC2H5= C2H5OH + CH3COOH 2. Лужний гідроліз CH3COOC2H5 + NaOH = C2H5OH + CH3COONa На відміну від кислотного лужний гідроліз естерів протікає незворотно
Отримання і хімічні властивості жирів Отримання Жири отримують з продуктів рослинного або тваринного походження.
Хімічні властивості 1. Гідроліз (омилення) жирів у лужному середовищі
*Жир обробили лугом, отриманий при цьому спирт відділили і прокип’ятили із сумішшю оцтової і сульфатної кислоти. Напишіть рівняння і назви реакцій. Обчисліть, скільки грамів кінцевого продукту може бути отримано з 680гр. жиру, якщо вихід на обох стадіях реакцій дорівнює 98%. *Напишіть рівняння реакцій, за допомогою яких можливо здійснити запропоновані перетворення: *
*формальдегід → метанова кислота → пентилметаноат → пентанол → пентаналь *карбід кальцію → ацетилен → етаналь → етанова кислота → етаноат магнію → етаноат натрію. *Складіть і назвіть два різнотипових ізомери до сполуки: метил-2,2-диметилпропаноат.
*Яку масу жиру, що містить 81% тристеарату гліцерину (решта не гліцериди) треба взяти для синтезу 45,4 г нітрогліцерину за умови, що всі перетворення протікають кількісно? *Обчисліть кількість вільних жирних кислот в одному грамі жиру, якщо на нейтралізацію його наважки масою 0,25 г витрачено 0,56 г 1%-ного розчину гідроксиду калію. Як присутність вільних жирних кислот впливає на якість жиру? *Яка маса естеру утвориться в результаті взаємодії 50 г мурашиної кислоти з 50 г етилового спирту? *Яку масу етилового естеру оцтової кислоти можна добути з 120 г оцтової кислоти і 92 г спирту, якщо масова частка практичного виходу естеру становить 90% від теоретично можливого? *Для гідролізу 35 г тригліцериду витрачено 66,2 мл 20%-ного за масою розчину гідроксиду натрію (ρ=1,22 г/мл). Визначте будову тригліцериду. *Яку масу триолеїноалеату та об\'єм водню потрібно для утворення відповідного твердого жиру масою 801 кг?
*Трипальмітиноат піддали гідролізу в присутності надлишку натрій гідроксиду. Які продукти реакції утворилися і яка їх маса, якщо гідролізував жир масою 201,5 кг? Вуглеводи *з курсу біології,пригадайте,як класифікують вуглеводи. *скільки енергії в організмі утворюється при розпаді 1г вуглеводів?
Глюкоза
Добувають глюкозу у промисловості із більш складного вуглеводню-крохмалю.
Хімічні властивості глюкози обумовлені наявністю гідроксильних і альдегідної груп. Тому глюкоза вступає в реакції,характерні для спиртів і альдегідів:
1)відновлення до шестиатомного спирту -сорбіту: О СН2-ОН-(СНОН)4-С +Н2→СН2ОН-(СНОН)4-СН2ОН Н Глюкоза сорбіт
Сорбіт вперше був виділений з плодів горобини.Він приблизно вдвічі менш солодкий,ніж звичайний цукор.Сорбіт не підвищує вмісту глюкози в крові,тому його використовують замість цукру в харчуванні людей,хворих на цукрувий діабет.
2)вступає в реакцію «срібного дзеркала» Окислюючись до глюконової кислоти
Глюкоза глюконова кислота
3)окисненя купрум (ІІ)гідроксидом
4)реакція етерифікації з утворенням естерів
С6Н7О(ОН)5+5СН3СООН→ С6Н7О(ООС-СН3)5+5Н2О Одна молекула глюкози взаємодіє з п’ятьма молекулами оцтової кислоти, що підтверджує у молекулі глюкози п’яти спиртових гідроксогруп.
5)взаємодія з гідроксидами металів з утворенням сахаратів
глюкозасахарат кальцію
А при взаємодії глюкози з гідроксидом міді (2) утворюється сахарат міді - сполука синього кольору. Цю реакцію використовують для виявлення цукру в сечі. 6)бродіння глюкози Велике значення мають процеси бродіння глюкози,які відбуваються під дією органічних каталізаторів-ферментів(виробляються мікроорганізмами).Відомо кілька видів бродіння.Спиртове бродіння відбувається під дією ферментів дріжджів: С6Н12О6→2С2Н5ОН+СО2
Молочнокисле бродіння глюкози відбувається під дією молочнокислих бактерій: С6Н12О6→СН3-СНОН-СООН молочна кислота молочна кислота утворюється при скисанні молока, квашені капусти, огірків, силосуванні кормів. 6) окиснення глюкози Глюкоза-надзвичайно цінна речовина. При окисненні її у тканинах вивільняється енергія, необхідна для нормальної життєдіяльності організму: С6Н12О6+6О2→6СО2+6Н2О *Вичисліть об'єм водню (н.у.), необхідний для відновлення глюкози масою 90 г. в шестиатомний спирт (сорбіт). * Розрахувати масу глюкози, яку можна добути з картоплі масою 810 г. з масовою часткою крохмалю в неї 20 %. Крім того двом учням пропонуються завдання на доказ генетичного зв'язку між органічними сполуками. Сахароза Добування сахарози В Україні сахарозу (цукор)добувають з цукрового буряка. Для виділення сахарози цей природний продукт миють, подрібнюють обробляють гарячою водою. Але разом із сахарозою у розчин переходять різні кислоти, барвники,від яких треба позбутися. Тому розчин обробляють вапняним молоком. Малорозчинні кальцієві солі більшості органічних кислот випадають в осад. Сахароза з гідроксидом кальцію утв розчинний у воді сахарат кальцію.Щоб розкласти його і нейтралізувати надлишок гідроксиду кальцію,крізь добутий розчин пропускають оксид вуглецю(4).Після осадження кальцію у вигляді карбонату розчин фільтрують, упарюють,одержують кристалики піскового цукру жовтого кольору,який надають йому барвники. Щоб очистити його пропускають через активоване вугілля, після чого його упарюють і кристалізують Важлива хімічна властивість сахарози здатність до гідролізу. При цьому утворюється молекула глюкози і молекула фруктози: 1)гідроліз сахарози С12Н22О11+Н2О=С6Н12О6+С6Н12О6
Це підтверджує,що молекули сахарози складаються з сполучених один з одним залишків молекул глюкози і фруктози. Сахарозу в порівнянні з глюкозою можна розглядати, як подвійний цукор,через що вона належить до дисахаридів. Подібне перетворення відбувається в організмі бджіл: збираючи нектар з квітів,вони засвоюють сахарозу,яка потім гідролізується до глюкози і фруктози. Тому мед-суміш рівних кількостей глюкози і фруктози(з домішкою різних природних речовин).Він солодший за звичайний цукор,тому що містить багато фруктози(фруктоза солодша за сахарозу втричі, солодкість глюкози складає 2 3 солодкості тростинного цукру). Утворення дисахаридів можна уявити собі як процес,зворотній їх гідролізу: 2)утворення дисахаридів С6Н11О5-Н-НО-С6Н11О5--С6Н11О5-О-С6Н11О5+Н2О (С6Н12О6) (С6Н12О6) (С12Н22О11) Сахароза не дає реакцій срібного дзеркала і не має відновних властивостей. У цьому її відмінність з глюкозою. Але вона так само,як і глюкоза 3) взаємодіє з гідроксидами металів, з утворенням сахаратів С12Н22О11+Са(ОН)2=С12Н22О11 СаО+Н2О Кальцій сахарат 4)горіння(повне окиснення) С12Н22О11+12 О2=12 СО2+11 Н2О
Крохмаль і целюлоза Добування крохмалю й целюлози. Це природні полімери, які синтезуються в рослинах з глюкози за реакцією: Їх виділяють із рослинної сировини.
*Складіть рівняння реакцій за допомогою яких можна здійснити такі перетворення: 1)глюкоза → етанол → брометан → бутан → оксид вуглецю(4) 2)вуглекислий газ→ крохмаль→ глюкоза →етанол 3)целюлоза глюкоза →етиловий спирт →вуглекислий газ 4)етин → етаналь →вуглекислий газ →глюкоза →сахароза → купрум сахарат 5)метаналь →глюкоза→ етанол → вуглекислий газ → глюкоза → глюконова кислота 6)мальтоза → глюкоза → молочна кислота → вуглекислий газ 7)сахароза → глюкоза → етанол → етаналь → оцтова кислота 8)глюкоза → крохмаль → А → етанол → етаналь → оцтова кислота → пропілетаноат *Розв’яжіть задачі 1.Який об’єм водню необхідний для відновлення 3 моль глюкози до спирту? Про наявність якої групи засвідчують її окисні властивості? 2.З крохмалю масою 8,1 г добута глюкоза, вихід якої становить 75%. До глюкози додали надлишок оксиду срібла. Обчисліть масу срібла,яке при цьому утвориться. 3.Який об’єм вуглекислого газу виділиться внаслідок спиртового бродіння глюкози кількістю речовини 0,7 моль? 4.У результаті спиртового бродіння глюкози утворився етанол масою 322 г. Яка маса глюкози піддалася бродінню?Який об’єм вуглекислого газу при цьому виділився?
5.У цукровій тростині масова частка сахарози становить 20%. Яку масу фруктози можна добути з тростини масою 25 т. 6.З метаналю масою 540 кг синтезували глюкозу масою 480 кг. Яку масу крохмалю потрібно,щоб добути таку ж масу глюкози. 7.Спалили вугілля масою 300 кг з масовою часткою вуглецю 80%.Яка маса крохмалю може синтезуватися з утвореного карбон (4) оксиду,якщо масова частка виходу його 90%? Аміни Склад і будова молекул. Аміни можна розглядати як похідні амоніаку NH3, в молекулі якого один або кілька атомів Гідрогену заміщені на вуглеводневий радикал
Характеристики амінів
Нижче розглядатимуться первинні аміни, в яких міститься функціональна аміногрупа – NH2. Фізичні властивості. Серед амінів є гази, рідини, тверді речовини. Нижчі аміни мають запах амоніаку, розчинні у воді. Хімічні властивості. Аміни згоряють, утворюючи вуглекислий газ, воду та азот. Аміни, як і амоніак, виявляють основні властивості. Проте вони сильніші основи, ніж амоніак, оскільки під впливом вуглеводневих радикалів на атомі Нітрогену зростає електронна густина і він міцніше утримує протони:
Як і амоніак, аміни діють на індикатори, виявляючи лужні властивості. Реагують з кислотами з утворенням солей.
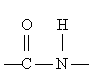
Анілін. У разі, коли аміногрупа сполучена з бензеновим ядром, утворюється ароматичний амін – анілін:
За хімічними властивостями анілін дещо відмінний від насичених амінів. Він не змінює забарвлення індикаторів, реагує лише з сильними кислотами: C6H5-NH2 + HCl → [C6H5NH3]+Cl- Феніламонійхлорид
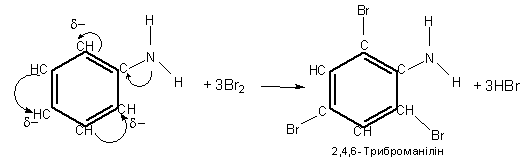
Отже, анілін – слабшаосновапорівнянозамоніаком. Це зумовлено впливом бензенового ядра на аміногрупу. Остання, у свою чергу, впливає на бензенове ядро. Зокрема, на бензен не діє бромна вода, а анілін реагує з бромом, утворюючи трибромопохідну сполуку:
Анілін має велике промислове значення, він є сировиною для виробництва барвників, лікарських засобів, пластмас, вибухових речовин тощо. Основний спосіб добування аніліну – відновлення нітробензену воднем за температури 250—350оС та наявності каталізатора:
Відновлення нітробензену до аніліну відоме в історії хімії як реакція М.М.Зініна (1842 р.). Амінокислоти Склад і будова молекул.
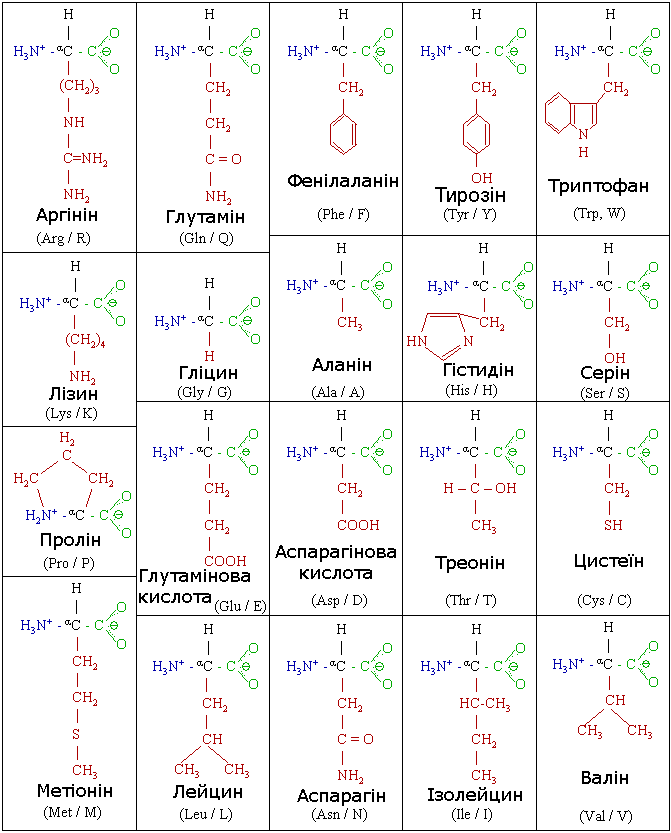
Молекули амінокислот містятьдві функціональнігрупи: карбоксильну тааміногрупу. Існуютьамінокислоти, щомістятьдвікарбоксильніабодвіаміногрупи, гідроксильнігрупи, сульфуровміснігрупи. Приклади амінокислот
Фізичні властивості. Амінокислоти – кристалічні речовини, мають високі температури плавлення, розчиняються у воді. Цим властивостям відповідає структура біполярного йона:
Хімічні властивості. Реакції амінокислот
Амінокислоти – амфотерні сполуки, оскільки взаємодіють з кислотами й основами. Найважливіша особливість амінокислот – здатність молекул взаємодіяти між собою з утворенням поліпептидів:
Зв'язок між залишками амінокислот називають пептидним, а групу
Поліпептидний ланцюг є основою будови молекул білків. Застосування. -у тваринництві(підгодівля тварин) -в медицині(як зміцнювальний та лікувальний засіб) -виробництвосинтетичних волокон Білки Будова білків. Кожен білок має набір амінокислот, сполучених у певній, властивій тільки йому послідовності. Кількість сполучених у різній послідовності амінокислотних залишків сягає 1018. Будова білків дуже складна і зумовлюється не лише послідовністю амінокислотних залишків. Довгі ланцюги білкових молекул скручуються у спіралі, спіралі – у клубки, що певним чином розміщуються у просторі. Розрізняють первинну, вторинну, третинну й четвертинну (для деяких білків) структуру.
Структура білка: а,б,в - відповідно первинна, вторинна, третинна структури міоглобіну (цифри - число амінокислотних залишків у молекулі); г - четвертинна структура гемоглобіну Властивості білків. Білки дуже різняться між собою за властивостями, оскільки містять залишки амінокислот з різними функціональними групами, здатними вступати в характерні для них реакції. 1. Денатурація. У результаті нагрівання білка відбувається його денатурація (втрата природних якостей). При цьому руйнується складна структура білка, що призводить до втрати ним біологічної активності. Це необоротний процес, він відбувається, наприклад, під час кулінарної обробки м'яса, риби, яєць. 2. Гідроліз. Під дією кислот, лугів, ферментів відбувається розщеплення полімерної білкової молекули на амінокислоти. Молекули води приєднуються за місцем пептидних зв'язків, останні руйнуються, замість пептидних груп утворюються аміно- й карбоксильні групи.
3. Розкладання. Під дією мікроорганізмів білки розкладаються з утворенням амоніаку, сірководню, фенолу, інших речовин з неприємним запахом. Його поява засвідчує, що відбувається процес розкладання (гниття) білка. 4. Кольорові реакції. Для аналітичного виявлення використовують кольорові реакції білків. Поява жовтого забарвлення в результаті реакції з концентрованою нітратною кислотою засвідчує наявність бензенових ядер у структурі білка. Червоно-фіолетове забарвлення білка в результаті дії купрум(ІІ) гідроксиду засвідчує наявність пептидних зв'язків. Біологічне значення амінокислот і білків. Білки є основним будівельним матеріалом тваринних організмів, а саме їх клітин. Білки їжі безпосередньо не засвоюються організмом, спершу вони гідролізують до амінокислот, останні всмоктуються у кров, нею переносяться до печінки, де організм синтезує білки, властиві саме йому. Для нормального функціонування організм мусить постійно поповнювати запас амінокислот переважно за рахунок білків їжі. *Складіть структурні формули та дайте назву двом гомологам та двом ізомерам 2,2 диамінобутанової кислоти. * Напишіть рівняння реакцій за схемою: метан → карбон(ІІ)оксид → метанол → хлорометан → етан → етилен → етиленгліколь. *Як із етану добути пропіловий естер амінооцтової кислоти? *Яку масу аніліна можна отримати із 468 г бензена, якщо втрати на кожному етапі складають 10 %? Загальні правила роботи і техніка безпеки в хімічній лабораторії 1.Під час роботи слід точно дотримуватись порядку і послідовності операцій, вказаних в даних вказівках. Ознайомлен___________________________ (підпис) Додаток №1.
|
||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 1475; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.119.17 (0.103 с.) |



 . Молекули глюкози можуть мати або лінійну, абоциклічнуформу. У кристалах молекули глюкоза знаходиться в одній із двох циклічних форм:
. Молекули глюкози можуть мати або лінійну, абоциклічнуформу. У кристалах молекули глюкоза знаходиться в одній із двох циклічних форм:  або
або  . У водному розчині між цими формами існує динамічна рівновага:
. У водному розчині між цими формами існує динамічна рівновага: 

 . Мономером крохмалю є
. Мономером крохмалю є  На відміну від амілози амілопектин не розчиняється у воді та має розгалужену будову. Целюлозаскладається з більшої кількості залишків глюкози, ніж крохмаль, і має велику молярну масу. Молекули целюлози мають лінійну будову, внаслідок чого вона легко утворює волокна. Фрагмент целюлози:
На відміну від амілози амілопектин не розчиняється у воді та має розгалужену будову. Целюлозаскладається з більшої кількості залишків глюкози, ніж крохмаль, і має велику молярну масу. Молекули целюлози мають лінійну будову, внаслідок чого вона легко утворює волокна. Фрагмент целюлози: 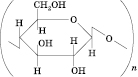
 . У мітохондріях живих організмів відбувається окиснення глюкози киснем повітря:
. У мітохондріях живих організмів відбувається окиснення глюкози киснем повітря:  . При цьому виділяється енергія, яка використовується для процесів життєдіяльності. Глюкоза міститься в рослинних і тваринних організмах, особливо багато її у винограді, меді, а також стиглих фруктах і ягодах, у корінні, листі та квітах рослин, у крові людини і тварин (близько 0,1 %). Глюкоза — цінна поживна речовина. Їжа людини складається приблизно на 70 % з вуглеводів.
. При цьому виділяється енергія, яка використовується для процесів життєдіяльності. Глюкоза міститься в рослинних і тваринних організмах, особливо багато її у винограді, меді, а також стиглих фруктах і ягодах, у корінні, листі та квітах рослин, у крові людини і тварин (близько 0,1 %). Глюкоза — цінна поживна речовина. Їжа людини складається приблизно на 70 % з вуглеводів.