

Мы поможем в написании ваших работ!
ЗНАЕТЕ ЛИ ВЫ?
|
Альдегіди і карбонові кислоти
| Альдегіди
| Карбонові кислоти
| Альдегідаминазиваються органічні сполуки, у молекулах яких міститься альдегідна функціональна група: – 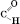 Назви альдегідів за міжнародною номенклатурою утворюються від назв відповідних вуглеводнів із додаванням суфікса - аль. Тривіальні назви утворюються від назв кислот, які можуть бути одержані з цих альдегідів.
Загальна формула альдегідів: Назви альдегідів за міжнародною номенклатурою утворюються від назв відповідних вуглеводнів із додаванням суфікса - аль. Тривіальні назви утворюються від назв кислот, які можуть бути одержані з цих альдегідів.
Загальна формула альдегідів:

| Карбонові кислоти — це органічні сполуки, до складу молекул яких входитькарбоксильна функціональна група: –  Насичені одноосновні карбонові кислоти містять одну карбоксильну групу й ординарні карбон-карбонові зв’язки. У результаті взаємного впливу атомів у карбоксильній групі: — зв’язок С=О міцніший, ніж в альдегідній групі; — зв’язок O–H менш міцний, ніж у спиртах; — атом Гідрогену більш рухливий і реакційноздатний. Насичені одноосновні карбонові кислоти містять одну карбоксильну групу й ординарні карбон-карбонові зв’язки. У результаті взаємного впливу атомів у карбоксильній групі: — зв’язок С=О міцніший, ніж в альдегідній групі; — зв’язок O–H менш міцний, ніж у спиртах; — атом Гідрогену більш рухливий і реакційноздатний.
| Фізичні властивості альдегідів.
Формальдегід — безбарвний газ із різким задушливим запахом. Добре розчиняється у воді. Температура кипіння  . Водний 40%-й розчин формальдегіду називається формаліном. Ацетальдегід — безбарвна легколетка рідина з різким запахом, добре розчинна у воді. Температура кипіння . Водний 40%-й розчин формальдегіду називається формаліном. Ацетальдегід — безбарвна легколетка рідина з різким запахом, добре розчинна у воді. Температура кипіння  .
Біологічна дія альдегідів.
Альдегіди — отруйні речовини. .
Біологічна дія альдегідів.
Альдегіди — отруйні речовини.
| Фізичні властивості карбонових кислот.
Мурашина кислота — безбарвна рідина з різким запахом, температура плавлення  , кипіння , кипіння  . Розчиняється у воді в будь-яких кількостях. Оцтова кислота — за кімнатної температури безбарвна рідина з різким характерним запахом. За температури нижчої за . Розчиняється у воді в будь-яких кількостях. Оцтова кислота — за кімнатної температури безбарвна рідина з різким характерним запахом. За температури нижчої за  (температура плавлення) кристалізується і стає схожою на лід, тому її називають«крижаною» оцтовою кислотою. Температура кипіння (температура плавлення) кристалізується і стає схожою на лід, тому її називають«крижаною» оцтовою кислотою. Температура кипіння  . Розчиняється у воді в будь-яких кількостях: 3—9%-й розчин називається оцтом, 70—80%-й розчин —оцтовою есенцією.
Біологічна дія.
Кислоти викликають хімічні опіки на шкірі. Мурашина кислота міститься у виділеннях залоз мурах, а також у деяких рослинах (наприклад у листі кропиви). . Розчиняється у воді в будь-яких кількостях: 3—9%-й розчин називається оцтом, 70—80%-й розчин —оцтовою есенцією.
Біологічна дія.
Кислоти викликають хімічні опіки на шкірі. Мурашина кислота міститься у виділеннях залоз мурах, а також у деяких рослинах (наприклад у листі кропиви).
| | Застосування альдегідів.
Формальдегідзастосовують для виробництва фенолформальдегідних смол, барвників, синтетичного каучуку, лікарських і вибухових речовин, а також для дезінфекції приміщень і зберігання біологічних препаратів. Ацетальдегідзастосовують для виробництва оцтової кислоти, а також у деяких органічних синтезах.
| Застосування карбонових кислот.
Мурашина кислотазастосовується як протрава для фарбування шерсті, консервант фруктових соків і силосу, використовується для дезінфекції місткостей у харчовій промисловості, у хімічних синтезах. Оцтова кислотазастосовується для добування пластмас, барвників, ліків, штучних волокон, кіноплівки в хімічних синтезах. Вона використовується як приправа до їжі, для консервації овочів. Солі оцтової кислоти використовують для фарбування тканин, а також для боротьби зі шкідниками сільського господарства.
|
Отримання і хімічні властивості альдегідів
Отримання
1. окислення первинних спиртів
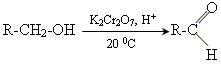 2. каталітична дегідрогенізація первинних спиртів
2. каталітична дегідрогенізація первинних спиртів
 Отримання оцтового альдегіду
1. каталітичне окислення етилену
Отримання оцтового альдегіду
1. каталітичне окислення етилену
 2. отримання за реакцією Кучерова
2. отримання за реакцією Кучерова
 Хімічні властивості
1. приєднання водню
Хімічні властивості
1. приєднання водню
 2. реакції окислення
• окислення біхроматом калію
2. реакції окислення
• окислення біхроматом калію
 • реакція срібного дзеркала
• реакція срібного дзеркала
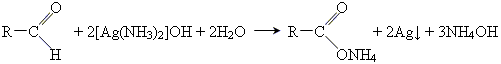 • реакція окислення гідроксидом Купруму(ІІ)
• реакція окислення гідроксидом Купруму(ІІ)
 3. реакція поліконденсації з фенолом (отримання фенолформальдегідних смол)
3. реакція поліконденсації з фенолом (отримання фенолформальдегідних смол)
 Отримання і хімічні властивості одноосновних карбонових кислот
Отримання
1. окислення спиртів або альдегідів
Отримання і хімічні властивості одноосновних карбонових кислот
Отримання
1. окислення спиртів або альдегідів
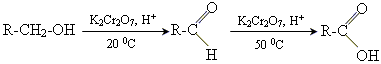 Отримання мурашиної кислоти
1. каталітичне окислення метану
2CH4 + 3O2 → 2H-COOH + 2H2O
2.Взаємодія оксиду Карбогену(ІІ) з гідроксидом Натрію при нагріванні
CO + NaOH → H-COONa;
H-COONa + H2SO4 → H-COOH + NaHSO4
Отримання оцтової кислоти
1. каталітичне окислення бутану
2CH3–CH2–CH2–CH3 + 5O2 → 4CH3COOH + 2H2O
2.Взаємодія оксиду Карбогену(ІІ) з метанолом
CH3OH + CO → CH3COOH
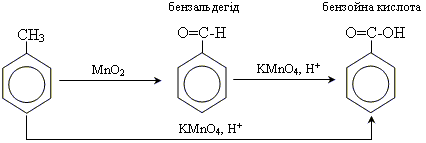
Отримання ароматичних кислот
1. окислення гомологів бензолу
Отримання мурашиної кислоти
1. каталітичне окислення метану
2CH4 + 3O2 → 2H-COOH + 2H2O
2.Взаємодія оксиду Карбогену(ІІ) з гідроксидом Натрію при нагріванні
CO + NaOH → H-COONa;
H-COONa + H2SO4 → H-COOH + NaHSO4
Отримання оцтової кислоти
1. каталітичне окислення бутану
2CH3–CH2–CH2–CH3 + 5O2 → 4CH3COOH + 2H2O
2.Взаємодія оксиду Карбогену(ІІ) з метанолом
CH3OH + CO → CH3COOH
Отримання ароматичних кислот
1. окислення гомологів бензолу
 Хімічні властивості
1.карбонові кислоти проявляють всі властивості характерні для неорганічних кислот і єслабкими електролітами:
2СH3COOH + 2Na →
2СH3COOH + Na2O →
СH3COOH + NaOH →
2СH3COOH + Na2CO3 →
СH3COOH + NaHCO3 →
СH3COONa + H2SO4 →
2.утворення складних ефірів (реакція етерифікації) у присутності каталізатора - сульфатної кислоти:
Хімічні властивості
1.карбонові кислоти проявляють всі властивості характерні для неорганічних кислот і єслабкими електролітами:
2СH3COOH + 2Na →
2СH3COOH + Na2O →
СH3COOH + NaOH →
2СH3COOH + Na2CO3 →
СH3COOH + NaHCO3 →
СH3COONa + H2SO4 →
2.утворення складних ефірів (реакція етерифікації) у присутності каталізатора - сульфатної кислоти:
 Зворотна реакція називається омиленням або гідролізом складного ефіру.
*З карбіду кальцію масою 50 г, що містить 0% домішок (за масою) добуто ацетилен, а з нього - ацетальдегід. Яка маса срібла може виділитись внаслідок взаємодії цього альдегіду з надлишком аміачного розчину оксиду аргентуму?
натрій пропанат ↓ * пропанол → пропаналь → пропанова кислота ↓ пропилпропаноат → пропанова кислота
* Масові частки С, Н і О в альдегіді становлять відповідно 62,1; 10,3 і 27,6%. Який об\'єм водню необхідний для відновлення 29 г цього альдегіду?
* Дано речовини: натрій гідрокарбонат, барій гідроксид, етанол, магній оксид, ртуть, сульфур (VI) оксид, кальцій. З якими з них реагуватиме пропанова кислота? Написати рівняння можливих реакцій.
*Насичена одноосновна карбонова кислота масою 7,4 г повністю нейтралізується розчином калій гідроксиду об\'ємом 20,5 мл з масовою часткою лугу 22,4% і густиною 1,22 г/см3. Знайдіть формулу цієї кислоти.
* Дано речовини: метанол, калій карбонат, калій, гідроксид, кальцій оксид, мідь, барій, карбон (IV) оксид.З якими з них реагуватиме метанова кислота? Написати рівняння можливих реакцій.
* На нейтралізацію 13,22 г одноосновної насиченої карбонової кислоти було витрачено 22,5 мл 25%-ного за масою розчину гідроксиду натрію (ρ=1,27 г/мл). Яка це кислота?
*Окиснюючи купрум (ІІ) оксидом одноатомний насичений спирт масою 15 г, одержали альдегід і мідь масою 16 г. Яку назву має утворений альдегід?
*Яку масу розчину оцтової кислоти необхідно взяти, щоб добути кальцій ацетат масою 15,8 г?
*Визначте масу метаналю, що міститься у 3л його водного розчину з масовою часткою альдегіду 73% і густиною 1,06г г/моль.
*Яка маса крейди з масовою часткою CaCO3 82% необхідна для нейтралізації 25,6г оцтової кислоти?
*Бутанол масою 14,8г прореагував з надлишком бутанової кислоти. утворився естер масою 26,2г. Яка масова частка виходу продукту за відношенням до теоретичного?
*Окисленням метану масою 1,6 т одержали метаналь масою 2,1т. Обчисліть масову частку практичного виходу метаналю.
*Густина парів одноосновної карбонової кислоти за воднем 37. Яка маса натрій гідроксиду з масовою часткою лугу 15% витратиться на нейтралізацію 11г цієї кислоти?
Зворотна реакція називається омиленням або гідролізом складного ефіру.
*З карбіду кальцію масою 50 г, що містить 0% домішок (за масою) добуто ацетилен, а з нього - ацетальдегід. Яка маса срібла може виділитись внаслідок взаємодії цього альдегіду з надлишком аміачного розчину оксиду аргентуму?
натрій пропанат ↓ * пропанол → пропаналь → пропанова кислота ↓ пропилпропаноат → пропанова кислота
* Масові частки С, Н і О в альдегіді становлять відповідно 62,1; 10,3 і 27,6%. Який об\'єм водню необхідний для відновлення 29 г цього альдегіду?
* Дано речовини: натрій гідрокарбонат, барій гідроксид, етанол, магній оксид, ртуть, сульфур (VI) оксид, кальцій. З якими з них реагуватиме пропанова кислота? Написати рівняння можливих реакцій.
*Насичена одноосновна карбонова кислота масою 7,4 г повністю нейтралізується розчином калій гідроксиду об\'ємом 20,5 мл з масовою часткою лугу 22,4% і густиною 1,22 г/см3. Знайдіть формулу цієї кислоти.
* Дано речовини: метанол, калій карбонат, калій, гідроксид, кальцій оксид, мідь, барій, карбон (IV) оксид.З якими з них реагуватиме метанова кислота? Написати рівняння можливих реакцій.
* На нейтралізацію 13,22 г одноосновної насиченої карбонової кислоти було витрачено 22,5 мл 25%-ного за масою розчину гідроксиду натрію (ρ=1,27 г/мл). Яка це кислота?
*Окиснюючи купрум (ІІ) оксидом одноатомний насичений спирт масою 15 г, одержали альдегід і мідь масою 16 г. Яку назву має утворений альдегід?
*Яку масу розчину оцтової кислоти необхідно взяти, щоб добути кальцій ацетат масою 15,8 г?
*Визначте масу метаналю, що міститься у 3л його водного розчину з масовою часткою альдегіду 73% і густиною 1,06г г/моль.
*Яка маса крейди з масовою часткою CaCO3 82% необхідна для нейтралізації 25,6г оцтової кислоти?
*Бутанол масою 14,8г прореагував з надлишком бутанової кислоти. утворився естер масою 26,2г. Яка масова частка виходу продукту за відношенням до теоретичного?
*Окисленням метану масою 1,6 т одержали метаналь масою 2,1т. Обчисліть масову частку практичного виходу метаналю.
*Густина парів одноосновної карбонової кислоти за воднем 37. Яка маса натрій гідроксиду з масовою часткою лугу 15% витратиться на нейтралізацію 11г цієї кислоти?
| | |
Естери і жири
| Естери
| Жири
| Естериможна розглядати як похідні кислот, у яких Гідроген гідроксильної групи заміщений на вуглеводневий радикал спирту. Назви естерів утворюються від назв відповідних кислот і спиртів з додаванням слова естер. Наприклад, естер 
| Жири — це естери, утворені вищими одноосновними карбоновими кислотами й триатомним спиртом гліцерином. Загальна назва таких сполук —тригліцериди. Природні жири — суміш різних тригліцеридів. Загальна формула тригліцеридів:  де де  , ,  , ,  — вуглеводневі радикали кислот. Назви жирів визначаються назвами кислот, які входять до їхнього складу. Наприклад, жир — вуглеводневі радикали кислот. Назви жирів визначаються назвами кислот, які входять до їхнього складу. Наприклад, жир  називаєтьсятригліцерид стеаринової кислоти,аботристеарин. називаєтьсятригліцерид стеаринової кислоти,аботристеарин.
| | Фізичні властивості естерів.Естери нижчих карбонових кислот і спиртів— леткі рідини, малорозчинні або нерозчинні у воді, добре розчинні у спирті та інших органічних розчинниках. Багато естерів мають приємний запах. Естери вищих кислот і спиртів— воскоподібні речовини, без запаху, нерозчинні у воді, добре розчинні в органічних розчинниках.
| Фізичні властивості жирів. За кімнатної температури жири бувають рідкими й твердими. Агрегатний стан жирів визначається жирними кислотами, які входять до їхнього складу.Тверді жириутворені насиченими кислотами,рідкі жири(олії)— ненасиченими. Температура плавлення жиру тим вища, чим більше в ньому насичених кислот і чим довший кислотний радикал. Тваринні жири частіше тверді, рослинні частіше рідкі. Жири розчинні в органічних розчинниках і нерозчинні у воді. Біологічне значення жирів. Жири входять до складу клітин рослинних і тваринних організмів, є джерелом енергії в клітині, будівельним матеріалом, беруть участь в обміні речовин, відкладаються в тканинах організму як запасна поживна речовина.
| | Застосування естерів. Складні естери застосовуються як розчинники та розріджувачі для лаків і фарб, як ароматизатори в харчовій промисловості
| Застосування жирів. Жири застосовуються в харчовій промисловості, в косметології, для добування гліцерину і вищих карбонових кислот.
|
|


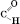 Назви альдегідів за міжнародною номенклатурою утворюються від назв відповідних вуглеводнів із додаванням суфікса - аль. Тривіальні назви утворюються від назв кислот, які можуть бути одержані з цих альдегідів.
Загальна формула альдегідів:
Назви альдегідів за міжнародною номенклатурою утворюються від назв відповідних вуглеводнів із додаванням суфікса - аль. Тривіальні назви утворюються від назв кислот, які можуть бути одержані з цих альдегідів.
Загальна формула альдегідів:

 Насичені одноосновні карбонові кислоти містять одну карбоксильну групу й ординарні карбон-карбонові зв’язки. У результаті взаємного впливу атомів у карбоксильній групі: — зв’язок С=О міцніший, ніж в альдегідній групі; — зв’язок O–H менш міцний, ніж у спиртах; — атом Гідрогену більш рухливий і реакційноздатний.
Насичені одноосновні карбонові кислоти містять одну карбоксильну групу й ординарні карбон-карбонові зв’язки. У результаті взаємного впливу атомів у карбоксильній групі: — зв’язок С=О міцніший, ніж в альдегідній групі; — зв’язок O–H менш міцний, ніж у спиртах; — атом Гідрогену більш рухливий і реакційноздатний.
 . Водний 40%-й розчин формальдегіду називається формаліном. Ацетальдегід — безбарвна легколетка рідина з різким запахом, добре розчинна у воді. Температура кипіння
. Водний 40%-й розчин формальдегіду називається формаліном. Ацетальдегід — безбарвна легколетка рідина з різким запахом, добре розчинна у воді. Температура кипіння  .
Біологічна дія альдегідів.
Альдегіди — отруйні речовини.
.
Біологічна дія альдегідів.
Альдегіди — отруйні речовини.
 , кипіння
, кипіння  . Розчиняється у воді в будь-яких кількостях. Оцтова кислота — за кімнатної температури безбарвна рідина з різким характерним запахом. За температури нижчої за
. Розчиняється у воді в будь-яких кількостях. Оцтова кислота — за кімнатної температури безбарвна рідина з різким характерним запахом. За температури нижчої за  (температура плавлення) кристалізується і стає схожою на лід, тому її називають«крижаною» оцтовою кислотою. Температура кипіння
(температура плавлення) кристалізується і стає схожою на лід, тому її називають«крижаною» оцтовою кислотою. Температура кипіння  . Розчиняється у воді в будь-яких кількостях: 3—9%-й розчин називається оцтом, 70—80%-й розчин —оцтовою есенцією.
Біологічна дія.
Кислоти викликають хімічні опіки на шкірі. Мурашина кислота міститься у виділеннях залоз мурах, а також у деяких рослинах (наприклад у листі кропиви).
. Розчиняється у воді в будь-яких кількостях: 3—9%-й розчин називається оцтом, 70—80%-й розчин —оцтовою есенцією.
Біологічна дія.
Кислоти викликають хімічні опіки на шкірі. Мурашина кислота міститься у виділеннях залоз мурах, а також у деяких рослинах (наприклад у листі кропиви).
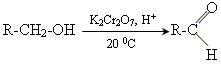 2. каталітична дегідрогенізація первинних спиртів
2. каталітична дегідрогенізація первинних спиртів
 Отримання оцтового альдегіду
1. каталітичне окислення етилену
Отримання оцтового альдегіду
1. каталітичне окислення етилену
 2. отримання за реакцією Кучерова
2. отримання за реакцією Кучерова
 Хімічні властивості
1. приєднання водню
Хімічні властивості
1. приєднання водню
 2. реакції окислення
• окислення біхроматом калію
2. реакції окислення
• окислення біхроматом калію
 • реакція срібного дзеркала
• реакція срібного дзеркала
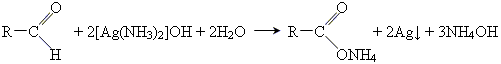 • реакція окислення гідроксидом Купруму(ІІ)
• реакція окислення гідроксидом Купруму(ІІ)
 3. реакція поліконденсації з фенолом (отримання фенолформальдегідних смол)
3. реакція поліконденсації з фенолом (отримання фенолформальдегідних смол)
 Отримання і хімічні властивості одноосновних карбонових кислот
Отримання
1. окислення спиртів або альдегідів
Отримання і хімічні властивості одноосновних карбонових кислот
Отримання
1. окислення спиртів або альдегідів
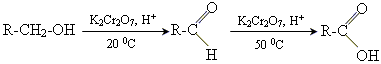 Отримання мурашиної кислоти
1. каталітичне окислення метану
2CH4 + 3O2 → 2H-COOH + 2H2O
2.Взаємодія оксиду Карбогену(ІІ) з гідроксидом Натрію при нагріванні
CO + NaOH → H-COONa;
H-COONa + H2SO4 → H-COOH + NaHSO4
Отримання оцтової кислоти
1. каталітичне окислення бутану
2CH3–CH2–CH2–CH3 + 5O2 → 4CH3COOH + 2H2O
2.Взаємодія оксиду Карбогену(ІІ) з метанолом
CH3OH + CO → CH3COOH
Отримання ароматичних кислот
1. окислення гомологів бензолу
Отримання мурашиної кислоти
1. каталітичне окислення метану
2CH4 + 3O2 → 2H-COOH + 2H2O
2.Взаємодія оксиду Карбогену(ІІ) з гідроксидом Натрію при нагріванні
CO + NaOH → H-COONa;
H-COONa + H2SO4 → H-COOH + NaHSO4
Отримання оцтової кислоти
1. каталітичне окислення бутану
2CH3–CH2–CH2–CH3 + 5O2 → 4CH3COOH + 2H2O
2.Взаємодія оксиду Карбогену(ІІ) з метанолом
CH3OH + CO → CH3COOH
Отримання ароматичних кислот
1. окислення гомологів бензолу
 Хімічні властивості
1.карбонові кислоти проявляють всі властивості характерні для неорганічних кислот і єслабкими електролітами:
2СH3COOH + 2Na →
2СH3COOH + Na2O →
СH3COOH + NaOH →
2СH3COOH + Na2CO3 →
СH3COOH + NaHCO3 →
СH3COONa + H2SO4 →
2.утворення складних ефірів (реакція етерифікації) у присутності каталізатора - сульфатної кислоти:
Хімічні властивості
1.карбонові кислоти проявляють всі властивості характерні для неорганічних кислот і єслабкими електролітами:
2СH3COOH + 2Na →
2СH3COOH + Na2O →
СH3COOH + NaOH →
2СH3COOH + Na2CO3 →
СH3COOH + NaHCO3 →
СH3COONa + H2SO4 →
2.утворення складних ефірів (реакція етерифікації) у присутності каталізатора - сульфатної кислоти:
 Зворотна реакція називається омиленням або гідролізом складного ефіру.
*З карбіду кальцію масою 50 г, що містить 0% домішок (за масою) добуто ацетилен, а з нього - ацетальдегід. Яка маса срібла може виділитись внаслідок взаємодії цього альдегіду з надлишком аміачного розчину оксиду аргентуму?
натрій пропанат ↓ * пропанол → пропаналь → пропанова кислота ↓ пропилпропаноат → пропанова кислота
* Масові частки С, Н і О в альдегіді становлять відповідно 62,1; 10,3 і 27,6%. Який об\'єм водню необхідний для відновлення 29 г цього альдегіду?
* Дано речовини: натрій гідрокарбонат, барій гідроксид, етанол, магній оксид, ртуть, сульфур (VI) оксид, кальцій. З якими з них реагуватиме пропанова кислота? Написати рівняння можливих реакцій.
*Насичена одноосновна карбонова кислота масою 7,4 г повністю нейтралізується розчином калій гідроксиду об\'ємом 20,5 мл з масовою часткою лугу 22,4% і густиною 1,22 г/см3. Знайдіть формулу цієї кислоти.
* Дано речовини: метанол, калій карбонат, калій, гідроксид, кальцій оксид, мідь, барій, карбон (IV) оксид.З якими з них реагуватиме метанова кислота? Написати рівняння можливих реакцій.
* На нейтралізацію 13,22 г одноосновної насиченої карбонової кислоти було витрачено 22,5 мл 25%-ного за масою розчину гідроксиду натрію (ρ=1,27 г/мл). Яка це кислота?
*Окиснюючи купрум (ІІ) оксидом одноатомний насичений спирт масою 15 г, одержали альдегід і мідь масою 16 г. Яку назву має утворений альдегід?
*Яку масу розчину оцтової кислоти необхідно взяти, щоб добути кальцій ацетат масою 15,8 г?
*Визначте масу метаналю, що міститься у 3л його водного розчину з масовою часткою альдегіду 73% і густиною 1,06г г/моль.
*Яка маса крейди з масовою часткою CaCO3 82% необхідна для нейтралізації 25,6г оцтової кислоти?
*Бутанол масою 14,8г прореагував з надлишком бутанової кислоти. утворився естер масою 26,2г. Яка масова частка виходу продукту за відношенням до теоретичного?
*Окисленням метану масою 1,6 т одержали метаналь масою 2,1т. Обчисліть масову частку практичного виходу метаналю.
*Густина парів одноосновної карбонової кислоти за воднем 37. Яка маса натрій гідроксиду з масовою часткою лугу 15% витратиться на нейтралізацію 11г цієї кислоти?
Зворотна реакція називається омиленням або гідролізом складного ефіру.
*З карбіду кальцію масою 50 г, що містить 0% домішок (за масою) добуто ацетилен, а з нього - ацетальдегід. Яка маса срібла може виділитись внаслідок взаємодії цього альдегіду з надлишком аміачного розчину оксиду аргентуму?
натрій пропанат ↓ * пропанол → пропаналь → пропанова кислота ↓ пропилпропаноат → пропанова кислота
* Масові частки С, Н і О в альдегіді становлять відповідно 62,1; 10,3 і 27,6%. Який об\'єм водню необхідний для відновлення 29 г цього альдегіду?
* Дано речовини: натрій гідрокарбонат, барій гідроксид, етанол, магній оксид, ртуть, сульфур (VI) оксид, кальцій. З якими з них реагуватиме пропанова кислота? Написати рівняння можливих реакцій.
*Насичена одноосновна карбонова кислота масою 7,4 г повністю нейтралізується розчином калій гідроксиду об\'ємом 20,5 мл з масовою часткою лугу 22,4% і густиною 1,22 г/см3. Знайдіть формулу цієї кислоти.
* Дано речовини: метанол, калій карбонат, калій, гідроксид, кальцій оксид, мідь, барій, карбон (IV) оксид.З якими з них реагуватиме метанова кислота? Написати рівняння можливих реакцій.
* На нейтралізацію 13,22 г одноосновної насиченої карбонової кислоти було витрачено 22,5 мл 25%-ного за масою розчину гідроксиду натрію (ρ=1,27 г/мл). Яка це кислота?
*Окиснюючи купрум (ІІ) оксидом одноатомний насичений спирт масою 15 г, одержали альдегід і мідь масою 16 г. Яку назву має утворений альдегід?
*Яку масу розчину оцтової кислоти необхідно взяти, щоб добути кальцій ацетат масою 15,8 г?
*Визначте масу метаналю, що міститься у 3л його водного розчину з масовою часткою альдегіду 73% і густиною 1,06г г/моль.
*Яка маса крейди з масовою часткою CaCO3 82% необхідна для нейтралізації 25,6г оцтової кислоти?
*Бутанол масою 14,8г прореагував з надлишком бутанової кислоти. утворився естер масою 26,2г. Яка масова частка виходу продукту за відношенням до теоретичного?
*Окисленням метану масою 1,6 т одержали метаналь масою 2,1т. Обчисліть масову частку практичного виходу метаналю.
*Густина парів одноосновної карбонової кислоти за воднем 37. Яка маса натрій гідроксиду з масовою часткою лугу 15% витратиться на нейтралізацію 11г цієї кислоти?

 де
де  ,
,  ,
,  — вуглеводневі радикали кислот. Назви жирів визначаються назвами кислот, які входять до їхнього складу. Наприклад, жир
— вуглеводневі радикали кислот. Назви жирів визначаються назвами кислот, які входять до їхнього складу. Наприклад, жир  називаєтьсятригліцерид стеаринової кислоти,аботристеарин.
називаєтьсятригліцерид стеаринової кислоти,аботристеарин.



