

Мы поможем в написании ваших работ!
ЗНАЕТЕ ЛИ ВЫ?
|
Оксигеновмісні органічні сполуки
| Насичені одноатомні спирти
| Багатоатомні спирти
| Феноли
| Спирти — це органічні сполуки, до складу яких входить одна або декілька гідроксильних груп (гідроксигруп), сполучених з вуглеводневим радикалом. Гідроксигрупа  називаєтьсяфункціональною групою, оскільки вона зумовлює основні хімічні властивості спиртів. У насичених одноатомних спиртів усі карбонові зв’язки ординарні і лише один атом Гідрогену заміщений гідроксигрупою. Назви спиртів утворюються від назв відповідних вуглеводнів з додаванням суфікса – ол (наприклад етанол). Існують також тривіальні назви (наприклад етиловий спирт). називаєтьсяфункціональною групою, оскільки вона зумовлює основні хімічні властивості спиртів. У насичених одноатомних спиртів усі карбонові зв’язки ординарні і лише один атом Гідрогену заміщений гідроксигрупою. Назви спиртів утворюються від назв відповідних вуглеводнів з додаванням суфікса – ол (наприклад етанол). Існують також тривіальні назви (наприклад етиловий спирт).
| Багатоатомниминазиваються спирти, у молекулах яких два або більше атомів Гідрогену заміщені на гідроксигрупи. Якщо в молекулі спирту містяться три гідроксигрупи, він належить дотриатомнихспиртів. У назві такого багатоатомного спирту присутній суфікс – тріол. Загальна формула триатомних спиртів  . Наприклад, формула пропантріолу-1,2,3 (гліцерину): . Наприклад, формула пропантріолу-1,2,3 (гліцерину): 
|
| Феноли — це органічні сполуки, у молекулах яких гідроксильні групи зв’язані зензиновим ядром. Феноли з однією гідроксигрупою називаютьсяодноатомними. Найпростіший фенол має загальну формулу  . Його структурна формула: . Його структурна формула:  або або  Радикал Радикал  називається
феніл. називається
феніл.
| Фізичні властивості спиртів. Спирти з числом атомів Карбону до 15 — рідини, інші — тверді речовини. Метанол і етанол — безбарвні рідини, з характерним запахом, добре розчинні у воді. Температура плавлення метанолу —  , етанолу — , етанолу —  . Температура кипіння метанолу — . Температура кипіння метанолу —  , етанолу — , етанолу — 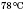 . Біологічна дія спиртів. Метанол — дуже сильна отрута, якщо потрапляє в організм у малих дозах (5—10 мл), викликає сліпоту, у великих (30 мл) — смерть. Етанол — наркотична речовина, у невеликих дозах викликає сп’яніння, у великих — смерть. При постійному вживанні етанолу розвивається захворювання — алкоголізм.. . Біологічна дія спиртів. Метанол — дуже сильна отрута, якщо потрапляє в організм у малих дозах (5—10 мл), викликає сліпоту, у великих (30 мл) — смерть. Етанол — наркотична речовина, у невеликих дозах викликає сп’яніння, у великих — смерть. При постійному вживанні етанолу розвивається захворювання — алкоголізм..
| Фізичні властивості гліцерину. Безбарвна, в’язка, гігроскопічна рідина, солодка на смак. Змішується з водою в будь-яких співвідношеннях. Температура плавлення —  , кипіння — , кипіння — 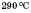 . .
| Фізичні властивості фенолу. Безбарвна кристалічна речовина з різким характерним запахом, частково розчинна у воді (краще розчиняється в гарячій воді). Температура плавлення  , кипіння , кипіння  . Під час зберігання поступово набуває рожевого забарвлення (окиснюється киснем повітря). Розчин фенолу у воді називається щекарболовою кислотою. Біологічна дія фенолу. Отруйний, має сильні антисептичні властивості. У разі попадання на шкіру викликає хімічні опіки. . Під час зберігання поступово набуває рожевого забарвлення (окиснюється киснем повітря). Розчин фенолу у воді називається щекарболовою кислотою. Біологічна дія фенолу. Отруйний, має сильні антисептичні властивості. У разі попадання на шкіру викликає хімічні опіки.
| Застосування спиртів.
Етанолзастосовують для добування синтетичного каучуку, пластмас, різних органічних речовин: діетилового естеру, барвників, оцтової кислоти. Його використовують як розчинник для виготовлення парфумів, одеколонів, ліків, лаків і т. Д. Етанол у суміші з бензином можна використовувати як пальне для двигунів внутрішнього згоряння. Метанолзастосовують як розчинник або сировину для одержання формальдегіду, деяких барвників, фотореактивів, фармацевтичних препаратів
Промислові методи отримання
1. Отримання метанолу
• піроліз деревини
• отримання із синтез-газу
СО + 2Н2 → СН3ОН
2. Отримання етанолу
• гідратація етилену
СН2=СН2 + Н2О →
• бродіння глюкози
С6Н12О6→
Лабораторні методи
1. гідратація алкенів  2. гідроліз галогенпохідних вуглеводнів
2СH3–СH2–Br + Ag2O +H2O
→ 2СH3–CH2–OH + 2AgBr↓
Хімічні властивості
1. кислотні властивості спиртів
Спирти проявляють дуже слабкі кислотні властивості - реагують з лужними або лужноземельними металами з утворенням алкоголятів
2СH3CH2OH + 2Na →
алкоголяти легко гідролізуються
СH3CH2ONa + H2O →
2. реакції з галогеноводнями (HCl, HBr)
R–OH + HCl → R–Cl + H2O
3. реакції дегідратації
• внутрішньомолекулярнадегідратація
CH3-CH2-OH → CH2=CH2 + H2O
• міжмолекулярнадегідратація
2CH3-CH2-OH →
CH3-CH2-О-CH2-CH3
Обидвіреакціїпротікаютьпринаг
ріванніуприсутностісульфатноїкислотиіконкуруютьміжсобою. Притемпературівищеза 140 0Спереважаєреакціяутворенняалкену.
4. реакції окислення
• первинні спирти окислюються найбільш легко - спочатку до альдегідів, а потім до карбонових кислот:
2. гідроліз галогенпохідних вуглеводнів
2СH3–СH2–Br + Ag2O +H2O
→ 2СH3–CH2–OH + 2AgBr↓
Хімічні властивості
1. кислотні властивості спиртів
Спирти проявляють дуже слабкі кислотні властивості - реагують з лужними або лужноземельними металами з утворенням алкоголятів
2СH3CH2OH + 2Na →
алкоголяти легко гідролізуються
СH3CH2ONa + H2O →
2. реакції з галогеноводнями (HCl, HBr)
R–OH + HCl → R–Cl + H2O
3. реакції дегідратації
• внутрішньомолекулярнадегідратація
CH3-CH2-OH → CH2=CH2 + H2O
• міжмолекулярнадегідратація
2CH3-CH2-OH →
CH3-CH2-О-CH2-CH3
Обидвіреакціїпротікаютьпринаг
ріванніуприсутностісульфатноїкислотиіконкуруютьміжсобою. Притемпературівищеза 140 0Спереважаєреакціяутворенняалкену.
4. реакції окислення
• первинні спирти окислюються найбільш легко - спочатку до альдегідів, а потім до карбонових кислот:
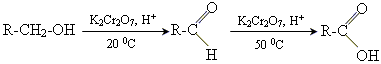 • вторинні спирти окислюються до кетонів
• вторинні спирти окислюються до кетонів
 • третинні спирти стійкі до дії звичайних окислювачів
• горіння спиртів
С2H5ОH + 7/2O2 → 2СO2 + 3H2O
• третинні спирти стійкі до дії звичайних окислювачів
• горіння спиртів
С2H5ОH + 7/2O2 → 2СO2 + 3H2O
| Застосування.
Гліцерин застосовується для добування нітрогліцерину (вибухова речовина), антифризів, у шкіряному виробництві для пом’якшення шкір, у медицині.
1. Отримання етиленгліколю
• отримання з етилену
CH2=CH2 + Cl2
→ Cl-CH2-CH2-Cl
Cl-CH2-CH2-Cl + H2O
→ OH-CH2-CH2-OH
• отримання за реакцією Вагнера
 2. Отримання гліцерину
звичайно гліцерин отримують при лужному гідролізі жирів
2. Отримання гліцерину
звичайно гліцерин отримують при лужному гідролізі жирів
 Хімічні властивості
Етиленгліколь всту
пає у всі реакції, що є характерними для одноатомних спиртів, але є і особливості пов'язані з наявністю двох гідроксогруп.
1. реакція з лужними металами дає два ряди гліколятів
OH-CH2-CH2OH + Na
→ OH-CH2-CH2-ONa + 1/2H2;
OH-CH2-CH2-OH + 2Na → Na-CH2-CH2-ONa + H2
2. при взаємодії з галогеноводневими кислотами (HCl або HBr) легко заміщується лише одна гідроксогрупа
OH-CH2-CH2-OH + HCl
→ Cl-CH2-CH2-OH + H2O
3. на відміну від одноатомних спиртів, характерною особливістю етиленгліколю є реакція взаємодії з гідроксидом Купруму, в результаті якої утворюється розчинний комплекс яскраво-синього забарвлення
Хімічні властивості
Етиленгліколь всту
пає у всі реакції, що є характерними для одноатомних спиртів, але є і особливості пов'язані з наявністю двох гідроксогруп.
1. реакція з лужними металами дає два ряди гліколятів
OH-CH2-CH2OH + Na
→ OH-CH2-CH2-ONa + 1/2H2;
OH-CH2-CH2-OH + 2Na → Na-CH2-CH2-ONa + H2
2. при взаємодії з галогеноводневими кислотами (HCl або HBr) легко заміщується лише одна гідроксогрупа
OH-CH2-CH2-OH + HCl
→ Cl-CH2-CH2-OH + H2O
3. на відміну від одноатомних спиртів, характерною особливістю етиленгліколю є реакція взаємодії з гідроксидом Купруму, в результаті якої утворюється розчинний комплекс яскраво-синього забарвлення
 Гліцерин за своїми властивостями більш подібний до етиленгліколю, ніж до одноатомних спиртів. Так, гліцерин дає три ряди гліцератів і три ряди похідних при взаємодії з галогеноводнями. Як і етиленгліколь, гліцерин при взаємодії з гідроксидом Купруму утворює з комплекс яскраво-синього забарвлення.
1.реакція гліцерину з гідроксидом Купруму(ІІ)
Гліцерин за своїми властивостями більш подібний до етиленгліколю, ніж до одноатомних спиртів. Так, гліцерин дає три ряди гліцератів і три ряди похідних при взаємодії з галогеноводнями. Як і етиленгліколь, гліцерин при взаємодії з гідроксидом Купруму утворює з комплекс яскраво-синього забарвлення.
1.реакція гліцерину з гідроксидом Купруму(ІІ)

| Застосування фенолу.
Фенол застосовується як антисептик, дезінфікуючий засіб, використовується у виробництві пластмас (фенопластів), лікарських речовин, барвників, синтетичних волокон, вибухових речовин.
Промислові методи отримання
1. з кам'яновугільної смоли
2. отримання з бензолу і пропену
 Хімічні властивості
1. кислотні властивості фенолів
Кислотні властивості фенолу виражені значно сильніше, ніж у спиртів. Так феноли реагують не тільки з лужними металами, але і з водними розчинами лугів. Фенол є дуже слабкою кислотою і тому феноляти легко гідролізуються і руйнуються навіть такими слабкими кислотами, як карбонатна кислота
Хімічні властивості
1. кислотні властивості фенолів
Кислотні властивості фенолу виражені значно сильніше, ніж у спиртів. Так феноли реагують не тільки з лужними металами, але і з водними розчинами лугів. Фенол є дуже слабкою кислотою і тому феноляти легко гідролізуються і руйнуються навіть такими слабкими кислотами, як карбонатна кислота
 2. реакції заміщення
реакції заміщення протікають значно легше, ніж у випадку бензолу, оскільки гідроксогрупа суттєво активує бензольне ядро.
• реакція нітрування
2. реакції заміщення
реакції заміщення протікають значно легше, ніж у випадку бензолу, оскільки гідроксогрупа суттєво активує бензольне ядро.
• реакція нітрування
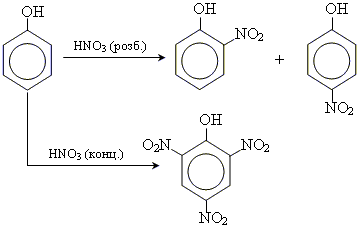 • реакції галогенування (Cl, Br)
• реакції галогенування (Cl, Br)
 • реакція сульфування
• реакція сульфування
 3. утворення простих ефірів
3. утворення простих ефірів
 4. утворення складних ефірів
4. утворення складних ефірів
 5. заміщення гідроксогрупи на галоген (протікає значно гірше, ніж у випадку спиртів)
5. заміщення гідроксогрупи на галоген (протікає значно гірше, ніж у випадку спиртів)
 6. відщеплення гідроксогрупи
6. відщеплення гідроксогрупи
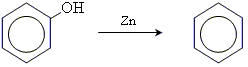
 7. реакція поліконденсації з формальдегідом (отримання фенолформальдегідних 7. реакція поліконденсації з формальдегідом (отримання фенолформальдегідних
| *напишіть структурні формули гексанолу,бутанолу,гептанолу,пентандіолу-1,3,гептантріолу-2,3,5
*здійсніть перетворення:метан→хлорметан→етан→етин→бензен→А→фенол
CaC2 → C2H2 → C2H4 → C2H5Cl → C2H5OH → C2H5 – O – C2H5
*маючи етин,добудьте натрій фенолят двома способами
*при взаємодії металічного натрію з двохатомним спиртом масою 112,5г виділився водень кількістю речовини 1,25 моль.Знайдіть формулу спирту.
*В результаті реакції дегідратації етанолу масою 230 г одержали етилен масою 112г. визначити масову частку виходу етилену.
*Який об’єм вуглекислого газу (н.у.) виділиться при спалюванні 1400 г етанолу, що містить 10% негорючих домішок?
*Який об’єм етилену потрібно взяти для виробництва 600 кг етанолу, якщо масова частка виходу продукту 85%?
*Скільки кілограмів фенолу можна отримати з 39 кг бензину, якщо втрати становлять 10%?
|


 називаєтьсяфункціональною групою, оскільки вона зумовлює основні хімічні властивості спиртів. У насичених одноатомних спиртів усі карбонові зв’язки ординарні і лише один атом Гідрогену заміщений гідроксигрупою. Назви спиртів утворюються від назв відповідних вуглеводнів з додаванням суфікса – ол (наприклад етанол). Існують також тривіальні назви (наприклад етиловий спирт).
називаєтьсяфункціональною групою, оскільки вона зумовлює основні хімічні властивості спиртів. У насичених одноатомних спиртів усі карбонові зв’язки ординарні і лише один атом Гідрогену заміщений гідроксигрупою. Назви спиртів утворюються від назв відповідних вуглеводнів з додаванням суфікса – ол (наприклад етанол). Існують також тривіальні назви (наприклад етиловий спирт).
 . Наприклад, формула пропантріолу-1,2,3 (гліцерину):
. Наприклад, формула пропантріолу-1,2,3 (гліцерину): 
 . Його структурна формула:
. Його структурна формула:  або
або  Радикал
Радикал  називається
феніл.
називається
феніл.
 , етанолу —
, етанолу —  . Температура кипіння метанолу —
. Температура кипіння метанолу —  , етанолу —
, етанолу — 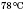 . Біологічна дія спиртів. Метанол — дуже сильна отрута, якщо потрапляє в організм у малих дозах (5—10 мл), викликає сліпоту, у великих (30 мл) — смерть. Етанол — наркотична речовина, у невеликих дозах викликає сп’яніння, у великих — смерть. При постійному вживанні етанолу розвивається захворювання — алкоголізм..
. Біологічна дія спиртів. Метанол — дуже сильна отрута, якщо потрапляє в організм у малих дозах (5—10 мл), викликає сліпоту, у великих (30 мл) — смерть. Етанол — наркотична речовина, у невеликих дозах викликає сп’яніння, у великих — смерть. При постійному вживанні етанолу розвивається захворювання — алкоголізм..
 , кипіння —
, кипіння — 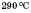 .
.
 , кипіння
, кипіння  . Під час зберігання поступово набуває рожевого забарвлення (окиснюється киснем повітря). Розчин фенолу у воді називається щекарболовою кислотою. Біологічна дія фенолу. Отруйний, має сильні антисептичні властивості. У разі попадання на шкіру викликає хімічні опіки.
. Під час зберігання поступово набуває рожевого забарвлення (окиснюється киснем повітря). Розчин фенолу у воді називається щекарболовою кислотою. Біологічна дія фенолу. Отруйний, має сильні антисептичні властивості. У разі попадання на шкіру викликає хімічні опіки.
 2. гідроліз галогенпохідних вуглеводнів
2СH3–СH2–Br + Ag2O +H2O
→ 2СH3–CH2–OH + 2AgBr↓
Хімічні властивості
1. кислотні властивості спиртів
Спирти проявляють дуже слабкі кислотні властивості - реагують з лужними або лужноземельними металами з утворенням алкоголятів
2СH3CH2OH + 2Na →
алкоголяти легко гідролізуються
СH3CH2ONa + H2O →
2. реакції з галогеноводнями (HCl, HBr)
R–OH + HCl → R–Cl + H2O
3. реакції дегідратації
• внутрішньомолекулярнадегідратація
CH3-CH2-OH → CH2=CH2 + H2O
• міжмолекулярнадегідратація
2CH3-CH2-OH →
CH3-CH2-О-CH2-CH3
Обидвіреакціїпротікаютьпринаг
ріванніуприсутностісульфатноїкислотиіконкуруютьміжсобою. Притемпературівищеза 140 0Спереважаєреакціяутворенняалкену.
4. реакції окислення
• первинні спирти окислюються найбільш легко - спочатку до альдегідів, а потім до карбонових кислот:
2. гідроліз галогенпохідних вуглеводнів
2СH3–СH2–Br + Ag2O +H2O
→ 2СH3–CH2–OH + 2AgBr↓
Хімічні властивості
1. кислотні властивості спиртів
Спирти проявляють дуже слабкі кислотні властивості - реагують з лужними або лужноземельними металами з утворенням алкоголятів
2СH3CH2OH + 2Na →
алкоголяти легко гідролізуються
СH3CH2ONa + H2O →
2. реакції з галогеноводнями (HCl, HBr)
R–OH + HCl → R–Cl + H2O
3. реакції дегідратації
• внутрішньомолекулярнадегідратація
CH3-CH2-OH → CH2=CH2 + H2O
• міжмолекулярнадегідратація
2CH3-CH2-OH →
CH3-CH2-О-CH2-CH3
Обидвіреакціїпротікаютьпринаг
ріванніуприсутностісульфатноїкислотиіконкуруютьміжсобою. Притемпературівищеза 140 0Спереважаєреакціяутворенняалкену.
4. реакції окислення
• первинні спирти окислюються найбільш легко - спочатку до альдегідів, а потім до карбонових кислот:
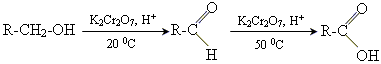 • вторинні спирти окислюються до кетонів
• вторинні спирти окислюються до кетонів
 • третинні спирти стійкі до дії звичайних окислювачів
• горіння спиртів
С2H5ОH + 7/2O2 → 2СO2 + 3H2O
• третинні спирти стійкі до дії звичайних окислювачів
• горіння спиртів
С2H5ОH + 7/2O2 → 2СO2 + 3H2O
 2. Отримання гліцерину
звичайно гліцерин отримують при лужному гідролізі жирів
2. Отримання гліцерину
звичайно гліцерин отримують при лужному гідролізі жирів
 Хімічні властивості
Етиленгліколь всту
пає у всі реакції, що є характерними для одноатомних спиртів, але є і особливості пов'язані з наявністю двох гідроксогруп.
1. реакція з лужними металами дає два ряди гліколятів
OH-CH2-CH2OH + Na
→ OH-CH2-CH2-ONa + 1/2H2;
OH-CH2-CH2-OH + 2Na → Na-CH2-CH2-ONa + H2
2. при взаємодії з галогеноводневими кислотами (HCl або HBr) легко заміщується лише одна гідроксогрупа
OH-CH2-CH2-OH + HCl
→ Cl-CH2-CH2-OH + H2O
3. на відміну від одноатомних спиртів, характерною особливістю етиленгліколю є реакція взаємодії з гідроксидом Купруму, в результаті якої утворюється розчинний комплекс яскраво-синього забарвлення
Хімічні властивості
Етиленгліколь всту
пає у всі реакції, що є характерними для одноатомних спиртів, але є і особливості пов'язані з наявністю двох гідроксогруп.
1. реакція з лужними металами дає два ряди гліколятів
OH-CH2-CH2OH + Na
→ OH-CH2-CH2-ONa + 1/2H2;
OH-CH2-CH2-OH + 2Na → Na-CH2-CH2-ONa + H2
2. при взаємодії з галогеноводневими кислотами (HCl або HBr) легко заміщується лише одна гідроксогрупа
OH-CH2-CH2-OH + HCl
→ Cl-CH2-CH2-OH + H2O
3. на відміну від одноатомних спиртів, характерною особливістю етиленгліколю є реакція взаємодії з гідроксидом Купруму, в результаті якої утворюється розчинний комплекс яскраво-синього забарвлення
 Гліцерин за своїми властивостями більш подібний до етиленгліколю, ніж до одноатомних спиртів. Так, гліцерин дає три ряди гліцератів і три ряди похідних при взаємодії з галогеноводнями. Як і етиленгліколь, гліцерин при взаємодії з гідроксидом Купруму утворює з комплекс яскраво-синього забарвлення.
1.реакція гліцерину з гідроксидом Купруму(ІІ)
Гліцерин за своїми властивостями більш подібний до етиленгліколю, ніж до одноатомних спиртів. Так, гліцерин дає три ряди гліцератів і три ряди похідних при взаємодії з галогеноводнями. Як і етиленгліколь, гліцерин при взаємодії з гідроксидом Купруму утворює з комплекс яскраво-синього забарвлення.
1.реакція гліцерину з гідроксидом Купруму(ІІ)

 Хімічні властивості
1. кислотні властивості фенолів
Кислотні властивості фенолу виражені значно сильніше, ніж у спиртів. Так феноли реагують не тільки з лужними металами, але і з водними розчинами лугів. Фенол є дуже слабкою кислотою і тому феноляти легко гідролізуються і руйнуються навіть такими слабкими кислотами, як карбонатна кислота
Хімічні властивості
1. кислотні властивості фенолів
Кислотні властивості фенолу виражені значно сильніше, ніж у спиртів. Так феноли реагують не тільки з лужними металами, але і з водними розчинами лугів. Фенол є дуже слабкою кислотою і тому феноляти легко гідролізуються і руйнуються навіть такими слабкими кислотами, як карбонатна кислота
 2. реакції заміщення
реакції заміщення протікають значно легше, ніж у випадку бензолу, оскільки гідроксогрупа суттєво активує бензольне ядро.
• реакція нітрування
2. реакції заміщення
реакції заміщення протікають значно легше, ніж у випадку бензолу, оскільки гідроксогрупа суттєво активує бензольне ядро.
• реакція нітрування
 • реакції галогенування (Cl, Br)
• реакції галогенування (Cl, Br)
 • реакція сульфування
• реакція сульфування
 3. утворення простих ефірів
3. утворення простих ефірів
 4. утворення складних ефірів
4. утворення складних ефірів
 5. заміщення гідроксогрупи на галоген (протікає значно гірше, ніж у випадку спиртів)
5. заміщення гідроксогрупи на галоген (протікає значно гірше, ніж у випадку спиртів)
 6. відщеплення гідроксогрупи
6. відщеплення гідроксогрупи
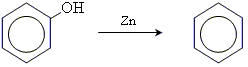
 7. реакція поліконденсації з формальдегідом (отримання фенолформальдегідних
7. реакція поліконденсації з формальдегідом (отримання фенолформальдегідних



