
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Давление в неподвижной жидкости. Уравнение Бернулли.
1) Давление – сила, действующая на единицу площади поверхности в перпендикулярной плоскости направления.
В жидкости давление в любой точке одинаково во всех направлениях.
2) Стационарное течение жидкости – течение, в котором в любой точке жидкости постоянная скорость.
В реальной жидкости при перемещении слоёв имеется трение. Но рассмотрим идеальную жидкость без трения.
Т.к.
или В этой части трубки, где давление возрастает, там скорость меньше. Ж. Пуазель рассмотрел течение жидкости внутри трубочек
l – характерный размер трубки
Идеальный газ. Основное уравнение молекулярно-кинетической энергии газов. Идеальный газ – это такой газ, молекулы которого имеют пренебрежительно малый собственный объём, и не взаимодействуют между собой. Термическое уравнение Клапейрона:
Воспользуемся законом Авагадро: При одинаковых давлениях и температурах моли всех газов занимают один объём. Это значит, что при P=1.01×
ð
PV=
Первое начало термодинамики Существует несколько начал термодинамики. Джоулем и др. учёными было сформулировано равенство об изменении внутренней энергии системы. ΔU=Q-A – первое начало термодинамики. Изменение внутренней энергии системы осуществляется за счёт передачи системе теплоты и совершения системой работы. Q-кол-во теплоты, А-работа.
В дифференциальной форме: dU=dQ-dA dU – бесконечно малое изменение внутренней энергии, происходящее при добавлении бесконечно малого кол-ва теплоты dQ системы, совершающей бесконечно малую работу dA. Q, A – не функции параметров системы, а U– функция параметров системы. dQ, dU различаются.
|
|||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 180; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.187.103 (0.006 с.) |
 (1) [P]=
(1) [P]= 



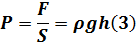
 Трубка тока – поверхность замкнутого контура, по которому проведена линия тока, в которых вектор скорости жидкости в любой точке линии тока направлен по касательной к ней.
Трубка тока – поверхность замкнутого контура, по которому проведена линия тока, в которых вектор скорости жидкости в любой точке линии тока направлен по касательной к ней.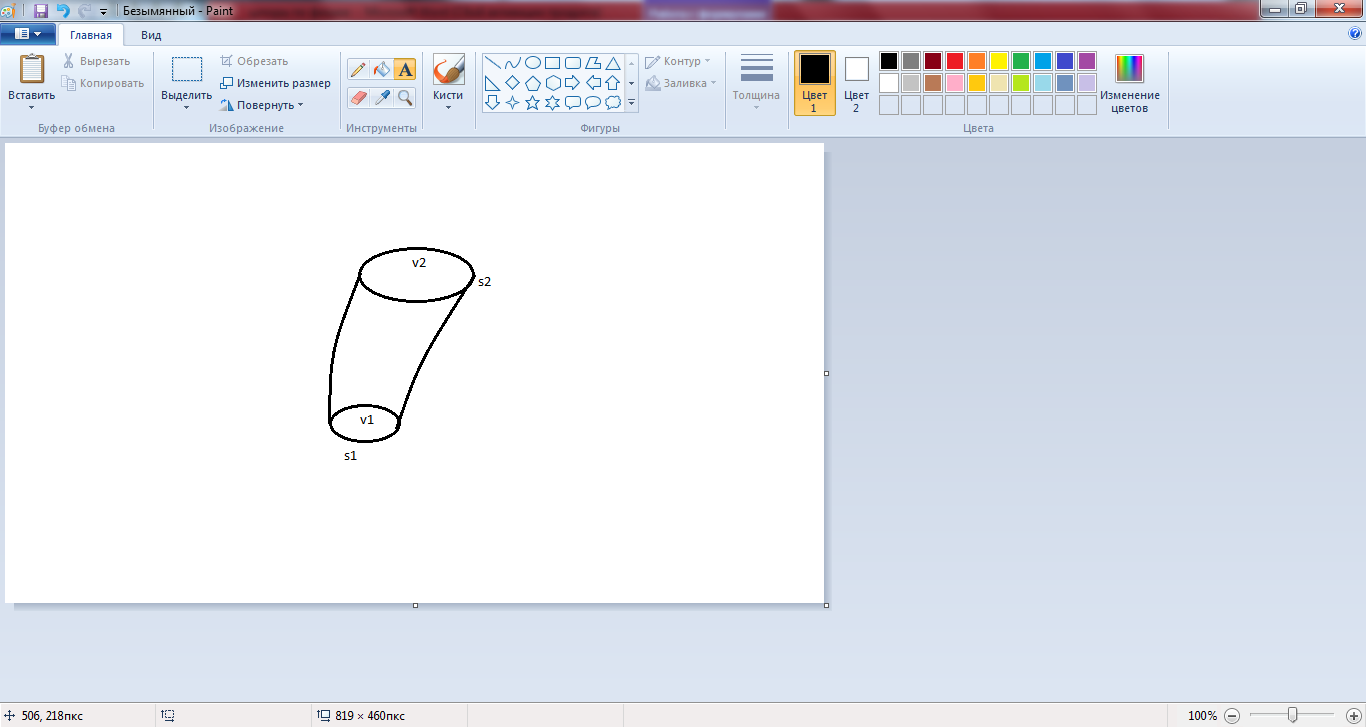 Если взять трубку тока жёсткую, как трубу, то по ней в любой точке течений протекает одинаковое количество жидкости.
Если взять трубку тока жёсткую, как трубу, то по ней в любой точке течений протекает одинаковое количество жидкости.
 – математическое выражение теории о неразрывности струн. Применима и для реальной жидкости, а также для газов.
– математическое выражение теории о неразрывности струн. Применима и для реальной жидкости, а также для газов. За время
За время  смест. жидкость
смест. жидкость  и
и  . Работа совершаемая силой
. Работа совершаемая силой 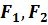 = превращению кинетической и потенциальной энергии.
= превращению кинетической и потенциальной энергии.





 +
+  - уравнение Бернулли.
- уравнение Бернулли. взяты произвольны, то для любой линии тока справедливо
взяты произвольны, то для любой линии тока справедливо
 – если концы трубки на одной высоте
– если концы трубки на одной высоте (12)
(12) (любая жидкость протекает в трубке)
(любая жидкость протекает в трубке)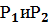 - давление на концах труб, R – радиус труб
- давление на концах труб, R – радиус труб – вязкость
– вязкость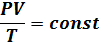
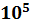 Па, Т=273K,
Па, Т=273K,

 – Клапейрона-Менделеева
– Клапейрона-Менделеева – постоянная Больцмана
– постоянная Больцмана
 – основное уравнение молекулярно-кинетической теории газов.
– основное уравнение молекулярно-кинетической теории газов.


