
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Исследование кривой насыщения водяного параСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Цель работы: ознакомиться с процессами фазового перехода веществ, с понятием теплоты парообразования и ее свойствами; освоить методику экспериментального исследования кривой насыщения водяного пара.
ОСНОВЫ ТЕОРИИ Процессы фазового перехода Фазовым переходом называют переход вещества из одной фазы в другую. Одно и тоже вещество в зависимости от внешних условий (давления и температуры) может находиться в различных агрегатных состояниях. Вещество в разных агрегатных состояниях имеет различные физические свойства и, в частности, плотность. Это различие объясняется характером межмолекулярного взаимодействия. Фазовый переход из твердой фазы в газообразную, происходящий при очень низких давлениях, называют сублимацией. Теплота сублимации больше, чем теплота плавления и теплота парообразования. При фазовом переходе обычно резко изменяется плотность вещества. При этом в случаях парообразования и сублимации плотность газовой фазы всегда меньше, чем плотность конденсированной фазы. Что же касается плавления, то здесь для разных веществ возможны различные случаи: плотность твердой фазы может быть либо больше, либо меньше плотности жидкости. Принята следующая классификация точек фазового перехода: точку перехода жидкость – пар называют точкой кипения (она же точка конденсации), точку перехода твердое тело – жидкость - точкой плавления (она же точка затвердевания), а точку перехода твердое тело-пар - точкой сублимации. На кривой фазового перехода в рТ -диаграмме состояние, в котором сосуществуют три фазы, изобразится точкой (так называемой тройной точкой). Наиболее характерной для чистого вещества является тройная точка, в которой сосуществуют твердая, жидкая и паровая фазы. Для воды тройная точка соответствует температуре 0,01 °С и давлению 611,7 Па (0,0062 кгс/см2).
Рис. 4.1 рТ – диаграмма вещества
На рис. 4.1 изображена характерная рТ-диаграмма вещества с нанесенными на ней кривыми фазовых переходов. Влево от линии АОВ расположена область твердого состояния вещества. Справа от линии КОВ расположена область газообразного состояния вещества, а между линиями ОА и ОК ‒ область жидкого состояния. Из рТ- диаграммы следует, что линия ОВ представляет собой кривую сублимации вещества, линия ОА - кривую плавления (затвердевания), а линия ОК - кривую кипения (конденсации). Кривую кипения обычно называют кривой (или линией) насыщения. Точка О представляет собой тройную точку, в которой вещество сосуществует в трех агрегатных состояниях. Кривая сублимации ОВ продолжается вниз в сторону низких температур. Кривая плавления ОА уходит вверх, в сторону больших давлений. Линия насыщения ОК оканчивается в точке К, называемой критической точкой. Поскольку свойства разных веществ отличаются друг от друга, то и рТ-диаграммы будут различными для различных веществ.
При достижении критических параметров (температуры и давления) вещество переходит сверхкритическое состояние. Выше критических параметров двухфазное состояние не достижимо. В сверхкритическом состоянии имеются свободные молекулы и многочисленные слабо связанные кластеры молекул. Расстояние между частицами (молекулами и кластерами) значительно больше, чем в классической жидкости, но намного меньше, чем в обычных газах. Внутри кластеров молекулы располагаются хаотично. Энергия взаимодействия молекул в кластерах мала. В то же время скорости, с которыми отдельные молекулы входят в кластеры и покидают их, очень высоки. Отсюда вытекает исключительно низкая вязкость и одновременно высокая диффузионная способность сверхкритической среды. Плотность сверхкритической среды близка к плотности жидкости, что обеспечивает высокую растворяющую способность. Совокупность этих свойств лежит в основе практического использования веществ в сверхкритическом состоянии. Из рис. 4.1 видно, что линия сублимации и линия насыщения имеют положительный наклон. Это означает, что с ростом давления температура фазового перехода (сублимация и кипение) повышается. Такая закономерность справедлива для всех известных чистых веществ. Линия плавления для различных веществ может иметь как положительный, так и отрицательный наклон. Из рТ-диаграммы (рис. 4.1) видно также, как изменяется состояние вещества в процессе нагрева при постоянном давлении. Двигаясь по изобаре р1 = const из области, соответствующей твердому состоянию вещества, линия плавления пересекается в точке С – вещество переходит в жидкое состояние. При дальнейшем нагреве пересекается линия насыщения ОК в точке D – вещество превращается в пар. Дальнейшее продвижение по изобаре р1 = const в сторону больших температур соответствует нагреву вещества в газовой фазе.
Теплота парообразования Удельная теплота парообразования показывает количество теплоты, необходимое для превращения 1 кг жидкости в пар при температуре кипения. Удельная теплота парообразования определяется из формулы:
где Q – количество теплоты, Дж; m – масса тела, кг. Опытным путем найдены значения удельной теплоты парообразования различных веществ и составлены таблицы. Удельная теплота парообразования воды равна 2,257 МДж/кг. Это означает, что на каждый килограмм воды необходимо потратить количество энергии, равное 2,257 МДж, чтобы превратить ее в пар. Но при этом вода должна уже обладать температурой кипения. Если вода изначально была с более низкой температурой, то необходимо рассчитать количество теплоты, которое потребуется для подогрева воды до кипения. Различают два вида парообразования: кипение и испарение. Процесс кипения протекает интенсивно во всем объеме при строго определенной температуре (кипения). Испарение происходит только со свободной поверхности жидкости при любой температуре выше температуры плавления. Энтальпия сухого насыщенного пара i" определяется уравнением: i" = i'+ r, (4.2) где i' – энтальпия жидкости. Внутренняя энергия сухого насыщенного пара: u" = i" - pυ". (4.3) Для определения сухого насыщенного пара необходимо знание давления либо температуры. Влажный пар определяется давлением р или температурой tн и степенью сухости х. Энтальпия влажного пара i х определяется уравнением: iх = i'+ rx. (4.4) Внутренняя энергия влажного пара ux равна: ux = ix – pυx,(4.5) где υx – удельный объем влажного пара, который определяется как объем смеси, состоящий из сухого пара υ" и воды υ': υx= υ"х + (1- х) υ'. (4.6) Каждому давлению соответствует определенная температура кипения данной жидкости, являющаяся одновременно температурой насыщения пара Т н, с которой жидкость находится в равновесии. Связь между температурой и давлением насыщения выражается уравнением Клапейрона-Клаузиуса:
Поскольку υ" > υ' для фазового перехода «жидкость-пар», как это следует из уравнения, отношение Уравнение Клапейрона-Клаузиуса устанавливает связь между производной давления по температуре, калорическими (r) и термодинамическими (Тн, υ', υ") свойствами вещества, находящегося в различных агрегатных состояниях. Контрольные задания Задача 1. Какое количество энергии (теплоты) требуется для превращения в пар 2 кг воды при температуре t? Таблица 4.1
Задача 2. Какое количество теплоты необходимо затратить, чтобы 500 г воды с начальной температурой t довести до кипения и 50 г превратить в пар? Изобразите процессы графически t = f (Q). Таблица 4.2
Задача 3. С использованием is -диаграммы определить теплоту парообразования r при абсолютном давлении р и степени сухости х. Таблица 4.3
Вопросы 1. Дать определение процессам: кипение, парообразование, испарение. 2. Процессы сублимации и плавления. 3. Тройная точка и критическая точка. Сверхкритическое состояние. 4. Определение теплоты парообразования. Уравнение Клапейрона- Клаузиуса. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ Описание установки Схема экспериментальной установки для определения зависимости давления насыщения воды от температуры в двухфазной области в процессе изохорного охлаждения представлена на рис. 4.2. Используя эту зависимость и уравнение Клапейрона – Клаузиуса рассчитывается теплота парообразования r. Сосуд высокого давления 1, обмотанный электронагревателем 2, интенсивно охлаждается вентилятором 4. Снаружи сосуд изолирован кожухом 6. Для автоматического отключения нагревателя предусмотрен контактный манометр 7. Избыточное давление в сосуде измеряется образцовым манометром 8. Разность температур насыщения и окружающего воздуха измеряется дифференциальной термопарой 9, которая соединена с гальванометром 10. В установке предусмотрены переключатели электронагревателя 3 и вентилятора 5. В замкнутый сосуд высокого давления 1 налито такое количество воды, при котором удельный объем υ х двухфазной системы «жидкость – пар» (влажного насыщения пара) равен критическому значению:
Рис. 4.2. Схема экспериментальной установки
где V – объем сосуда, заполненный системой «жидкость – пар», м3; М – масса системы «жидкость – пар», кг; υкр – удельный объем системы в критической точке, м3/кг. В результате изохорного охлаждения (υ х = const) система будет все время находиться в двухфазном состоянии, начиная с критической точки.
Порядок проведения опытов Перед началом опыта необходимо включить электронагреватель. При достижении давления 220 кгс/см2 (37 делений) отключить электронагреватель и включить вентилятор. В дальнейшем при изохорном охлаждении системы «жидкость – пар» через каждые 4 деления записать в табл. 4.4 показания образцового манометра и гальванометра. По окончании опытов (Ризб = 5 делений) отключить вентилятор, измерить температуру окружающей среды tокр и атмосферное давление В. Результаты измерений занести в таблицу опытных данных (табл. 4.4).
Таблица 4.4
Здесь Ризб – показания образцового манометра, tокр – температура окружающей среды, В – барометическое давление, ∆ t – показания гальванометра.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 1159; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.28.90 (0.008 с.) |


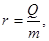 (4.1)
(4.1)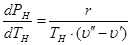 . (4.7)
. (4.7) - всегда больше нуля, т.е. с ростом температуры давление насыщения увеличивается.
- всегда больше нуля, т.е. с ростом температуры давление насыщения увеличивается.




