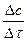Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кінетика біохімічних і мікробіологічних процесів
Біохімічними вважають ті процеси, які відбуваються за участю ферментів самої харчової сировини або чистих препаратів і їх сумішей. Мікробіологічними являються процеси, що відбуваються за участю певних культур мікроорганізмів, або їх фрагментів, які містять ферменти. Ці процеси дуже поширені в харчових виробництвах. На їх використанні засновано дуже багато галузей харчопереробного комплексу. Швидкість перебігу цих процесів залежить не тільки від концентрацій вихідної речовини, тобто субстрату, і ферменту, від температури і тиску, але і від стану ферменту, ступеню його чистоти, від рН, впливу активаторів і інгібіторів. Сутність ферментативного каталізу базується на теорії фермент-субстратного проміжного комплексу, який незворотно розкладається на продукти реакції з вивільненням ферменту за схемою S + F S – субстрат; F – фермент; FS – проміжний комплекс фермент-субстрат; P – продукт реакції; k1 – константа швидкості утворення комплексу; k2 – константа швидкості дисоціації комплексу. Згідно закону діючих мас швидкості реакцій утворення та дисоціації υ1 = k1 [S] · [F]; υ2 = k2 [FS]; У стані рівноваги υ1 = υ2, тоді константа рівноваги буде k = де: k – константа рівноваги; [FS] = [F] = [S] = S – концентрація субстрату. Концентрація субстрату завжди є надлишковою по відношенню до концентрації ферменту, тому можна вважати, що швидкість процесу залежить переважно від концентрації ферменту та його стану. Фермент, як каталізатор, не витрачається в ході процесу, тому його загальна концентрація Тоді рівняння можна записати: k = Для швидкості реакції розпаду фермент - субстратного комплексу на кінцевий продукт можна написати υ3 = k2 Для характеристики перебігу таких реакцій частіше використовують початкову швидкість, тоді рівняння для характеристики швидкості реакції утворення продукту буде мати інший вигляд. Це рівняння називають загальним законом ферментативного каталізу або рівнянням Михаеліса-Ментена
υ0 = де υ0 – початкова швидкість процесу; k2 – константа швидкості дисоціації фермент-субстратного комплексу; s0 – початкова концентрація субстрата; ks – константа Михаеліса. Хімічна кінетика Предметом хімічної кінетики є суто хімічні процеси: механізм, швидкість та закономірності перебігу хімічних реакцій. Швидкість реакції визначається кількістю молекул речовини, яка вступає у взаємодію за одиницю часу в одиниці об’єму. Швидкість можна визначити за зменшенням концентрації реагуючих речовин, або за зростанням концентрації продуктів реакції. У випадку модельної реакції миттєва швидкість у певний момент часу буде визначатись рівняннями υ = - де – -
Якщо швидкість визначати за витратами вихідних речовин, вона буде Механізм і швидкість хімічних реакцій залежать від багатьох факторів. Для різних типів реакцій існують розрахункові формули для обчислення їх констант швидкості. Всі вони базуються на загальному хімічному законі діючих мас, згідно з яким швидкість реакції прямо пропорційна добутку концентрацій реагуючих речовин υ = kc де k – константа швидкості реакції c m, n – стехіометричні коефіцієнти. Щоб визначити середню швидкість за весь час перебігу реакції, рівняння які характеризують миттєву швидкість необхідно про інтегрувати. Для цього використовують рівняння υ = де
Початкова швидкість υо = tg α; миттєва швидкість υ де ∆с – інтервал концентрацій ∆
|
|||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 300; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.147.215 (0.007 с.) |
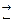
 FS + P
FS + P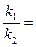
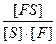 або k =
або k = 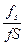
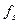 – концентрація фермент-субстратного комплексу;
– концентрація фермент-субстратного комплексу;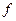 – концентрація вільного ферменту;
– концентрація вільного ферменту;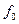 буде складатися з концентрації вільного ферменту
буде складатися з концентрації вільного ферменту 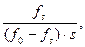 а
а 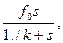
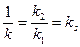 – називається константою Михаеліса.
– називається константою Михаеліса.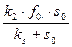
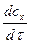 ; або υ = -
; або υ = - 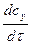 ; або υ =
; або υ = 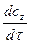 ;
;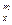 · c
· c 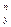
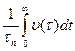
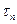 – повний час проведення процесу
– повний час проведення процесу На практиці частіше за все розраховують початкову і середню швидкість. Для цього використовують графічний метод. Для побудови графіка в координатах «концентрація продукту – час реакції» використовують експериментальні дані. На цьому графіку тангенс кута нахилу дотичної до осі абсцис буде чисельно дорівнювати швидкості реакції в той момент часу, який відповідає точці дотику. Початкова швидкість чисельно дорівнює тангенсу кута нахилу кривої до осі абсцис.
На практиці частіше за все розраховують початкову і середню швидкість. Для цього використовують графічний метод. Для побудови графіка в координатах «концентрація продукту – час реакції» використовують експериментальні дані. На цьому графіку тангенс кута нахилу дотичної до осі абсцис буде чисельно дорівнювати швидкості реакції в той момент часу, який відповідає точці дотику. Початкова швидкість чисельно дорівнює тангенсу кута нахилу кривої до осі абсцис.


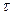 о = tg β;
о = tg β; 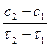 , тобто υ =
, тобто υ =