Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
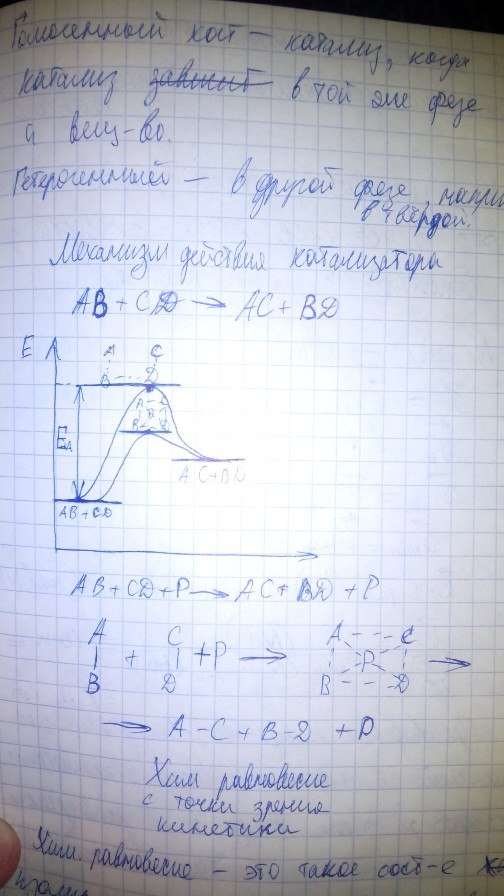
Механизм действия катализатора.Содержание книги
Поиск на нашем сайте
Вопрос 30 Понятие эквивалента. Закон эквивалентов. Все вещества реагируют, соединяются в строго определённых соотношениях. Все вещества реагируют в эквивалентных соотношениях. Эквивалентное число (z) – зависит от природы в-ва и определяется по стехиометрии реакции. Расчёт чисел эквивалентности. 1.Число эквивалентности элемента=валентности Zкислота = nH 2. Zкислота = ZH 1) H2SO4+2NaOH=Na2SO4+2H2O Z(H2SO4)=2 2) H2S04+NaOH=NaHSO4+H20 Z(H2SO4)=1 3. Число эквив. Основания=nOH(число групп замещенных реакций) 1) Сa(OH)2+2HCl=CaCl2+2H2O Z(Ca(OH)2)=2 2) Ca(OH)2+HCl=CaOHCL+H20 Z(Ca(OH)2)=1
4. Число эквивалентности окислителя Zокислителя = nпринятых электронов 5. Zвосстановителя=nотданных электронов 6. Zсоли = Вme * nme (валентность металла на число атомов металла) Молярная масса эквивалента Это масса одного моля эквивалента вещества Mэ=M/Z Кол-во в-ва эквивалента или число эквивалентов в-ва nэ=m/Mэ nэ=m/Mэ=m/M/z=z*m/M=Z*n nэ=z*n Закон эквивалента Числа эквивалента взаимодействующих в-в равны nэ1=nэ2 m1/m2=Mэ1/Мэ2
+Моль и эквивалент в-ва. Закон эквивалентов Моль - кол-во в-ва, в котором содержится 6.02*1023 молекул 1 моль любого газообразного в-ва при н.у занимает объем 22.4 л Н.у это p=a*m*M (1.013*10a) Число моль: n=m/M
Метод молекулярных орбиталей. Связывающие и разрыхляющие орбитали. Основные положения метода молекулярных орбиталей. 1) Всея молекула рассматривается как единое целое, состоящее из ядер и электронов 2) Все электроны являются общими для всех ядер 3) Состояние электронов в молекуле описывается с помощью соответствующего уравнения Шредингера 4) В методе молекулярных орбиталей используется линейная комбинация атомных орбиталей (ЛКАО) Принцип Ле-Шателье Если на систему, находящуюся в равновесии оказать какое-либо воздействие,то равновесие сместиться в сторону уменьшения оказанного воздействия Химическое равновесие с точки зрения кинетики - это такое состояние изолированной системы, в которой заканчиваются хим. Превращения, то есть не происходят изменения числа моль в-ва участников реакции. Состояние равновесия - это конечное состояние системы. Это такое состояние, в котором скорость прямой и обратной реакции равны. Влияние концентрации Увеличение концентрации в-ва приводит к смещению равновесия в сторону расхода этого в-ва. При уменьшении концентрации в-ва равновесие смещается в сторону образования этого в-ва.
Давление Изменение давления учитываем только с газообразными в-вами. Если в твердой или жидкой фазе влияние смещения равновесия пренебрегает при увеличении давления, равновесие смещается в сторону меньшего образования молекул газа При уменьшении давления, равновесия смещается в сторону большего образования молекул газа Температура При увеличении температуры равновесие смещается в сторону протекания эндотермической реакции. При уменьшении температуры равновесия смещается в сторону протекания экзотермической реакции.
41. Катализ. Механизм действия катализатора Катализ - химическое явление, суть которого заключается в изменении скоростей химических реакций при действии некоторых веществ (их называют катализаторами). Катализатор-химическое в-во, которое увеличивает скорость реакции, при этом само участие не принимает Гомогенный катализ - катализ, когда катализатор находится в той же фазе, что и в-во Гетерогенный катализ - катализ, когда находится в другой фазе, обычно твердой, катализатор легко отдаляется Механизм действия катализатора
|
|||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 328; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.208.215 (0.005 с.) |