Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основные законы атомно-молекулярной теорииСодержание книги
Поиск на нашем сайте
Вопрос 1 Основные законы атомно-молекулярной теории
Атом – это система взаимодействующих элементарных частиц, состоящих из положительно заряженного ядра и отрицательно заряженных нейтронов. Также атом – это наименьшее химически неделимая частица вещества. Химический элемент – это определенный вид атомов, имеющий одинаковый заряд ядра. Изотопы – это атомы одного и того же элемента, имеющие разное число электронов в ядре. Молекула – это наименьшая частица веществ, обладающая его свойствами.
Вопрос 2 Агрегатное состояние вещества Твёрдое состояние вещества. Eвзаимодействия > Eкинетич. движ-я Свойство состояний 1) Твёрдое кристаллическое. Вещества обладают кристаллической структурой. Кристаллическая структура обладает определённой симметрией. 2) Твёрдое аморфное. В отличие от кристаллов, стабильно-аморфные вещества не затвердевают с образованием кристаллических граней. состояние твердого тела, характеризующееся изотропией физических свойств, обусловленной неупорядоченным расположением атомов и молекул. Кристаллическая решётка. Показывает пространственное расположение атомов или молекул. Узлы кристаллической решетки – это то место в пространстве, где находятся частицы. В межузлиях находятся другие элементы. Особенности кристаллического состояние: 1) Высокая степень упорядоченности 2) Симметрия 3) Анизотропия Анизотропия – наличие разных свойств в разных направлениях. Типы кристаллических решеток: 1) Атомная (в узлах находится ковалентная сильная связь) Алмаз, кремень. 2) Молекулярная (в узлах молекулы, связь межмолекулярная слабая) Неметаллы 3) Ионная (в узлах ионы, связь ионная, очень прочная) Оксиды и соли 4) Металлическая (в узлах атомы металлов, в мужузлие электронный газ, связь металлическая. Особенности аморфного состояния (расплавленное): (смолы, стекло) 1) Тягучесть 2) Плавка в интервале температур 3) Ближний порядок 4) Менее устойчивое состояние. Жидкое состояние: Eвз. ≈ Eкин. движ Особенности: 1) Тягучесть 2) Изотропность 3) Ближний порядок 4) Высокая плотность 5) Малая сжимаемость Газообразное состояние: E кин. > E вз. Особенности: 1) Слабое межмолекулярное взаимодействие
2) Отсутствие порядка 3) Высокая сжимаемость 4) Малая плотность 5) Газ занимает весь предоставленный объём Плазма: E кин. > E ионизации (ионизированный газ) Протекают процессы ионизации или комбинации. Плазма – это такое состояние вещества в котором одновременно протекают процессы ионизации и рекомбинации Свойства: 1) Высокая электропроводность 2) Может взаимодействовать с электромагнитным полем 3) Квазинейтральна 4) Динамическое состояние Вида плазмы 1) Низкотемпературная 2) Высокотемпературная Промежуточное состояние вещества 1) Жидкокристаллическое состояние 2) Нанокристаллическое (между твердым кристаллическим и аморфным состоянием) Вопрос 3 Строение атома. Квантовые числа. Принцип Паули, правила Хунда и Клечковского. Модель Резерфорда (планетарная)
Свойства электронов и их соединений находятся в период зависимости от зарядов ядер атомов. Спектр испускания – это совокупность частот электромагнитного излучения, испускаемого вещества. Спектр поглощения – это совокупность частот электромагнитного излучения поглощаемого вещества. Квантовые числа. Квантовое число – это решение уравнения Шредингера. Решением уравнения Шр. Являются 4 квантовых числа, которые характеризуют состояние энергии электрона в атоме. 1) n – главное квантовое число, характеризующее энергию элементов в атоме и меняется от 1 до 7 Если n=1, то электрон на 1-м энергетическом уровне Главное квантовое число – номер периода. 2) L – побочное, орбитальное квантовое число, которое показывает формулу электронного облака. Принимает значения L=0, 1 …, (n-1) 3) mi - магнитное квантовое число, характеризующее ориентацию электронного облака в пространстве. mi = -L, …-1,0,1…+L 4) Спиновое квантовое число (ms) – характеризует момент вращения электрона вокруг своей оси. Ms = +1/2; -1/2 Cпин Принцип Паули. В атоме не может быть электронов со всеми четырьмя квантовыми числами. Правило Клечковского 1. Электрон обладает наименьшей энергией на тех подуровнях, где n + L= min 2. Если n+L – одинакова, то электрон обладает наименьшей энергией на том подуровне, где n – квантовое число минимально Правило Гунда В наиболее устойчивом состоянии атома, электроны в пределах одного подуровня, распадаются так, чтобы суммарный спин был максимальным.
+Энергия электрона в атоме (вопрос 25) Состояние электрона в атоме описываем с помощью ᴪ. Она показывает состояние электрона в пространстве. ᴪ∆V – вероятность обнаружить электрон в ∆V Нельзя одновременно и достаточно точно определить импульс и координату электрона в атоме. Вопрос 4 и 26 Типы химических реакций. Примеры. Соединения - Реакции между двумя простыми веществами, или между несколькими сложными, при этом образуется одно сложное или более сложное вещество. Обмена - Реакции между двумя сложными веществами, при которых они обмениваются своими составными частями. Разложения - Реакции, при которых из одного вещества образуется несколько простых или сложных веществ. Замещения - Реакции между сложным и простым веществами, при которых атомы простого вещества замещают один из атомов сложного. 1) Cоединения: N2+3H2=2NH3 3) Разложения: 2NaNO3=2NaNO2+O2 Вопрос 5 Кислотно основные свойства. При движении к 1-й группе свойства кислот будут убывать. Вопрос 6 Вопрос 7 Вопрос 8 Основные классы неорганических соединений. Примеры и свойства. Простые вещества 1) Металлы Na, Mg, Al. 2) Неметаллы Si, P, S, Cl2. Сложные вещества 1) Оксиды I. Несолеобразующие ( CO, SO, NO ) II. Солеобразующие А) основные ( Na2O, MgO ) Б) амфотерные ( Al2O3 ) В) кислотные ( SiO2, P2O5, SO3, Cl2O7 ) 2) Гидроксиды А) основания ( NaOH, Mg(OH)2 ) Б) амфотерные ( Al(OH)3 ) В) кислотные ( H2SiO3, H2SO4,HClO4, HPO3 ) Соли А) основания ( AlOH ) Б) средние ( AlPO4 ) В) кислые ( Al2(HPO4)3, Al(H2PO4)3 ) Определения Гидроксиды - это электролит при диссоциации которого в водных растворах образуется катион металла и отрицательно заряженный гидроксид анион. Кислоты -сложные вещества, молекулы которых в результате электролитической диссоциации образуют катион водорода H+ и анион кислотного остатка Основание -сложные вещества, молекулы которых в результа- те электролитической диссоциации образуют ион металла, либо ион аммония Соли -сложные вещества, молекулы которых в результате электролитической диссоциации в большинстве случаев образуют катион металла Men+ и анион кислотного остатка Acm– Вопрос 9 Вопрос 10 Правило фаз Гиббса П.Ф Гиббса показывает сколько параметров можно менять независимым образом, так, чтобы число и природа сосуществовавших фаз оставались неизменными
К – число компонентов Сигма – число фаз fmin=0 сигмаmax = K+2 Вопрос 11 Кислоты и их свойства Кислота – это электролит, при диссоциации которого в водном растворе образуется катион водорода и анион кислотного остатка Классификация кислот 1) Все кислоты делятся на бескислородные и кислородоодержащие (HCl, H2S) 2) Все кислоты делятся по основности Основность кислот n=1 HBr, HNO n=2 H2CO3 n=3 H3PO4 Кислотность оснований n=1 NaOH n=2 Ca(OH)2 n=3 Fe(OH)3 Свойства кислот 1) Кислоты реагируют с основаниями образуя соль и воду H2SO4+KOH=K2SO4+2H2O 2) Кислоты реагируют с основными оксидами H2SO4+CuO=CuSO4+H20 3) Кислоты реагируют с кислотами солей H2SO4+K2SiO3=K2SO4=H2SiO3 4) Реакция с металлами Fe+2HCl=FeCl2+H2 Вопрос 12 Вопрос 13 Закон Гесса. Тепловой эффект хим. Реакции при постоянстве давления или при постоянстве объёма и при приведении всех участников реакции к одной температуре, не зависят от пути процесса, а определяются только начальное и конечное состоянием процесса.
Qp=∆Hp = Hкон – Hнач.
Вопрос 14 G – энергия Гиббса Определение направленности реакций. ∆GT,p < 0, то реакция протекает самопроизвольно ∆GT,p = 0, - равновесие ∆GT,p > 0 – реакция невозможна. ∆GT,p = ∆HT,p - T∆ST, p -3-й закон Гесса Н - энтальпия dSp = CpdT/T Е начало термодинамики. Постулат Планка. Энтропия простого вещества при T=0, равна 0 S(T=0)=0 Энтропия - функция состояния системы которая показывает направление протекания процессов в природе. Мера хаотичности и неупорядоченности системы. Энтальпия является мерой энергии, накапливпемой веществом при его образовании Когда энтропия максимальна, энтальпия минимальна и наоборот. Вопрос 15 Основные оксиды. Оксиды, гидратами которых являются основания, называются основными оксидами. Основные оксиды образуют металлы в степени окисления +1, +2, иногда +3. Хим. связь основного оксида, как правило ионная. Хим. свойства. 1) Оксиды щелочных и щелочно-земельных металлов реагируют с водой образуя основания. BaO + H2O = Ba(OH)2 2) Все основные оксиды реагируют с кислотами. Fe2O3+3H2(SO4) = Fe2(SO4)3+3H2O 3) Основные оксиды реагируют с кислотами FeO+SiO2 =t FeSiO3 Кислотные оксиды. Оксиды, гидратами которых являются кислоты, называются кислотными. Кислотные оксиды образуют все неметаллы и металлы в степенях (+4, +5, +6, +7) CO2, Mn2O7, SO3 Хим. связь: полярная ковалентная или ионная. Амфотерные оксиды Оксиды которые могут реагировать как с кислотами, так и с основаниями, называются амфотерными. (с водой не взаимодействуют)
Вопрос 16 Вопрос 17 Вопрос 18 Вопрос 19 (см. 11 вопрос!!) Вопрос 20 Понятие функции состояния. Примеры. Функция состояния системы – некая аналитическая функция, которая зависит от термодинамических параметров системы в данном состоянии. Значение не зависит от предыстории системы, а при переходе из одного состояния в другое не зависит от пути процесса. Определяется лишь начальным и конечным состоянием системы. ∆U1,2=U2-U1 Вопрос 21 Вопрос 22 Энтальпия и энтропия образования химических веществ. Энтропия - функция состояния системы которая показывает направление протекания процессов в природе. Мера хаотичности и неупорядоченности системы. Энтальпия является мерой энергии, накапливпемой веществом при его образовании
Когда энтропия максимальна, энтальпия минимальна и наоборот.
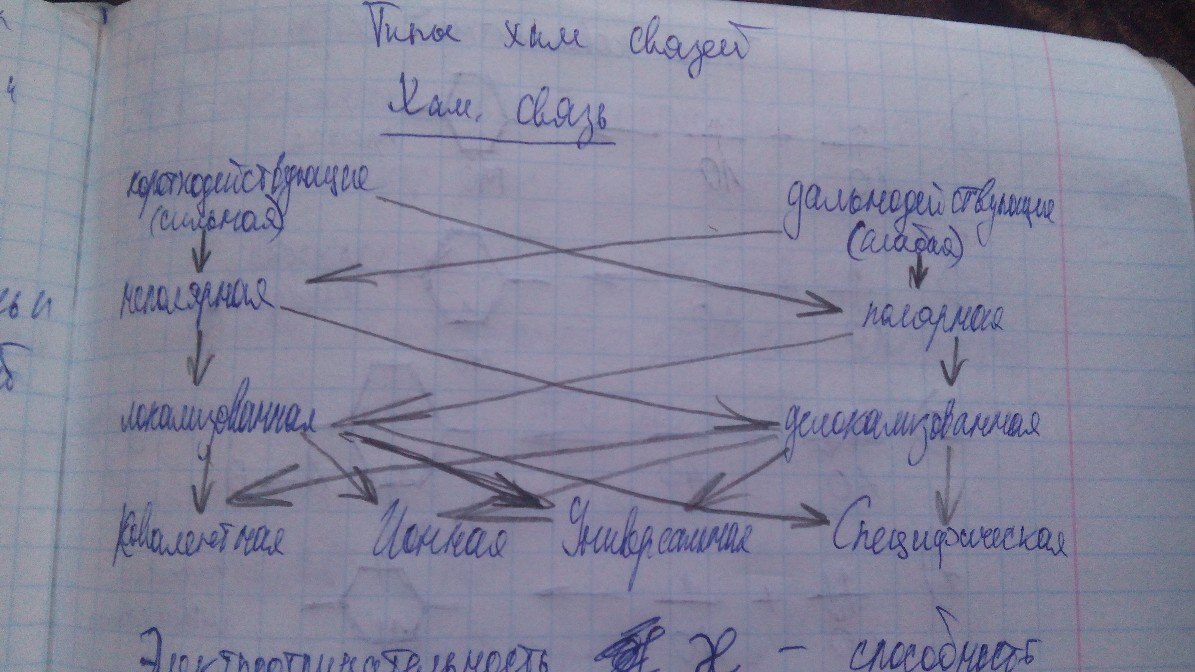
Вопрос 23 Типы хим. связей.
Электроотрицательность – способность атомов оттягивать на себя электронную плотность. Ковалентная связь – двухатомная связь, 2 атома и 2 электрона обазательных. (сильная связь, локализованная) Ионная связь – предельный случай ковалентной полярной связи; электростатическое взаимодействие которое возникает между катионами и анионами. Универсальная связь – вандервальсовыемежмолекулярные Специфические 1) Металлическая. Все электроны образуют электронный газ 2) Водородная связь. Основана на свойстве атомов H, связанного сильно электроотрицательным элементом. Вопрос 24. Вопрос 25 (см. вопрос 3) ВОПРОС (СМ.4 ВОПРОС) ВОПРОС 28 Термическое равновесие 2. р1=р2=…=рα= рϬ Механическое равновесие
Химическое равновесие
Вопрос 29 Вопрос 30 Молярная масса эквивалента Это масса одного моля эквивалента вещества Mэ=M/Z Кол-во в-ва эквивалента или число эквивалентов в-ва nэ=m/Mэ nэ=m/Mэ=m/M/z=z*m/M=Z*n nэ=z*n Закон эквивалента Числа эквивалента взаимодействующих в-в равны nэ1=nэ2 m1/m2=Mэ1/Мэ2
+Моль и эквивалент в-ва. Закон эквивалентов Моль - кол-во в-ва, в котором содержится 6.02*1023 молекул 1 моль любого газообразного в-ва при н.у занимает объем 22.4 л Н.у это p=a*m*M (1.013*10a) Число моль: n=m/M
Принцип Ле-Шателье Если на систему, находящуюся в равновесии оказать какое-либо воздействие,то равновесие сместиться в сторону уменьшения оказанного воздействия Химическое равновесие с точки зрения кинетики - это такое состояние изолированной системы, в которой заканчиваются хим. Превращения, то есть не происходят изменения числа моль в-ва участников реакции. Состояние равновесия - это конечное состояние системы. Это такое состояние, в котором скорость прямой и обратной реакции равны. Влияние концентрации Увеличение концентрации в-ва приводит к смещению равновесия в сторону расхода этого в-ва. При уменьшении концентрации в-ва равновесие смещается в сторону образования этого в-ва. Давление Изменение давления учитываем только с газообразными в-вами. Если в твердой или жидкой фазе влияние смещения равновесия пренебрегает при увеличении давления, равновесие смещается в сторону меньшего образования молекул газа При уменьшении давления, равновесия смещается в сторону большего образования молекул газа Температура При увеличении температуры равновесие смещается в сторону протекания эндотермической реакции. При уменьшении температуры равновесия смещается в сторону протекания экзотермической реакции.
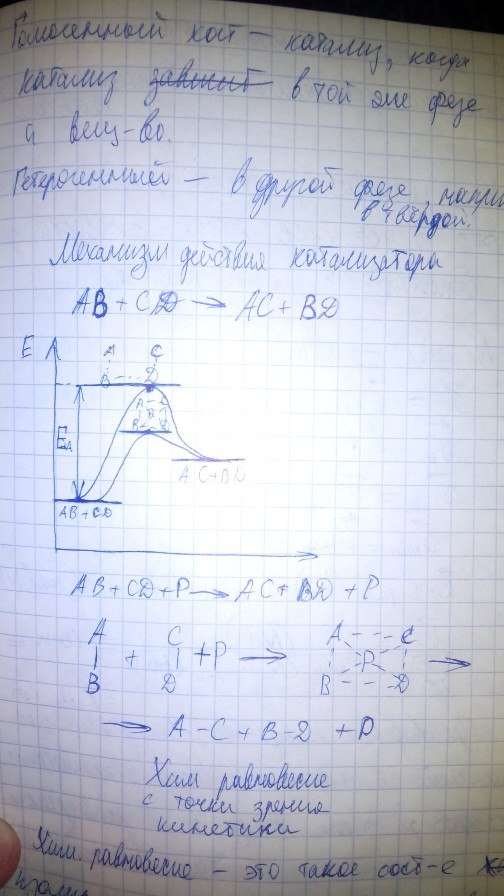
41. Катализ. Механизм действия катализатора Катализ - химическое явление, суть которого заключается в изменении скоростей химических реакций при действии некоторых веществ (их называют катализаторами). Катализатор-химическое в-во, которое увеличивает скорость реакции, при этом само участие не принимает
Гомогенный катализ - катализ, когда катализатор находится в той же фазе, что и в-во Гетерогенный катализ - катализ, когда находится в другой фазе, обычно твердой, катализатор легко отдаляется Механизм действия катализатора
ОВР. Степень окисления. ОВР – реакции, проходящие с изменением степени окисления Степень окисления – число электронов принятых атомом (-), или отданных (+) Номер группы – число электронов на внешнем уровне Максимальная степень окисления = № группы Минимальная степень окисления = № группы – 8 Типы ОВР: 1) Межмолекулярные 2) Внутримолекулярные (реакции, в которых разные атомы находятся в одной степени окисления) 3) Самоокисляющиеся, самовосстанавливающиеся 4) Диспропорционирование (реакции в которых окислитель и восстановитель являются одним и тем же в промежуточной степени окисления. Окислитель - принимающий электроны.
Основные понятия термодинамики: термодинам. Система, её начальное и конечное состояние, параметры системы, состояние равновесия. Классификация термодинам. Систем (изолированная, закрытая, открытая) Термодинамическая система – совокупность материальных предметов тем или иным способом выделенная из окружающего нас мира. Классификация 1) Простая система – это система, для описания свойств которой необходимо 2 параметра. Взаимодействует с окружением только за счёт механической работы и теплообмена 2) Изолированная система – не обменивается с окружением ни энергией, ни веществами 3) Открытая система – может обмениваться с окруж. Веществами 4) Закрытая – не может обмениваться. Параметры Термодинамический параметр – это физическое свойство системы, которое можно измерить либо вычислить. Все термодинамические параметры делятся на интенсивные и экстенсивные Экстенсивный параметр зависит от массы системы (при удвоении системы удваивается) Интенсивный параметр не зависит от массы, принимает одинаковое значение при конкретном равновесии. Имеет значение в точке. Вопрос 1 Основные законы атомно-молекулярной теории
Атом – это система взаимодействующих элементарных частиц, состоящих из положительно заряженного ядра и отрицательно заряженных нейтронов. Также атом – это наименьшее химически неделимая частица вещества. Химический элемент – это определенный вид атомов, имеющий одинаковый заряд ядра. Изотопы – это атомы одного и того же элемента, имеющие разное число электронов в ядре. Молекула – это наименьшая частица веществ, обладающая его свойствами.
Вопрос 2
|
||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 285; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.128.18.131 (0.012 с.) |