
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Вопрос. Круговой процесс (цикл).
Цикл на диаграмме изображается замкнутой кривой. Цикл можно разбить на процессы расширения и сжатия 2-1. Работа расширения положительна
Вопрос. Энтропия. Для выяснения физического содержания этого понятия рассматривают отношение теплоты Q полученной телом в изотермическом процессе к температуре К теплоотдающего тела называемая приведенным количеством теплоты
Найдем изменение энтропии в разных процессах идеального газа так как или
|
|||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 344; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.184.162 (0.004 с.) |
 Циклом называется система, пройдя через ряд состояний, возвращается в исходную.
Циклом называется система, пройдя через ряд состояний, возвращается в исходную. работа сжатия отрицательная
работа сжатия отрицательная  . Работа совершаемая газом за цикл определяется площадью заштрихованной фигурой. Если работа за цикл положительная (рис а)
. Работа совершаемая газом за цикл определяется площадью заштрихованной фигурой. Если работа за цикл положительная (рис а) 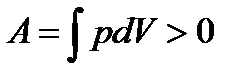 то такой цикл называется прямым (протекает по часовой стрелке). Если работа за цикл отрицательная (рис б)
то такой цикл называется прямым (протекает по часовой стрелке). Если работа за цикл отрицательная (рис б)  то такой цикл называется обратным (протекает против часовой стрелки). Прямой цикл используется в тепловых двигателях это периодически действующие двигатели совершающие работу за счёт полученной извне теплоты. Обратный цикл используется в холодильных машинах, в которых за счет работы внешних сил теплота переносится к телу с более высокой температурой. В результате кругового процесса система возвращается в исходное состояние, следовательно
то такой цикл называется обратным (протекает против часовой стрелки). Прямой цикл используется в тепловых двигателях это периодически действующие двигатели совершающие работу за счёт полученной извне теплоты. Обратный цикл используется в холодильных машинах, в которых за счет работы внешних сил теплота переносится к телу с более высокой температурой. В результате кругового процесса система возвращается в исходное состояние, следовательно 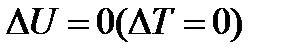 . Первое начало термодинамики для цикла имеет вид
. Первое начало термодинамики для цикла имеет вид  в результате кругового процесса система может как получать теплоту
в результате кругового процесса система может как получать теплоту  , так и отдавать
, так и отдавать  .
. цикл характеризуется термическим коэффициентом полезного действия
цикл характеризуется термическим коэффициентом полезного действия  . Термодинамический процесс называется обратимым если он может происходить как в прямом так и в обратном направлении.
. Термодинамический процесс называется обратимым если он может происходить как в прямом так и в обратном направлении. . Приведенное количество теплоты сообщаемое телу в любом обратимом круговом процессе
. Приведенное количество теплоты сообщаемое телу в любом обратимом круговом процессе  из равенства 0 интеграла следует что под интегральное выражение есть полный дифференциал некоторой функции которая определяется только состоянием системы и не зависит от пути которым система пришла в это состояние обозначается она
из равенства 0 интеграла следует что под интегральное выражение есть полный дифференциал некоторой функции которая определяется только состоянием системы и не зависит от пути которым система пришла в это состояние обозначается она  функция состояния
функция состояния  называется энтропией. Для обратимых процессов изменение энтропии
называется энтропией. Для обратимых процессов изменение энтропии  для необратимых энтропия возрастает
для необратимых энтропия возрастает  . Последние выражения относится только к замкнутым системам если система обменивается теплотой с внешней средой то ее энтропия может вести себя любым образом. Изменение энтропии можно представить в ввиду неравенства Клаузиуса. Если система совершает переход из состояния 1 в состояние 2 то изменение энтропии
. Последние выражения относится только к замкнутым системам если система обменивается теплотой с внешней средой то ее энтропия может вести себя любым образом. Изменение энтропии можно представить в ввиду неравенства Клаузиуса. Если система совершает переход из состояния 1 в состояние 2 то изменение энтропии  . Физический смысл имеет не сома энтропия а разность.
. Физический смысл имеет не сома энтропия а разность.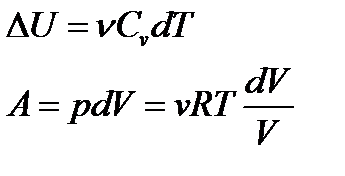 тогда изменение энтропии
тогда изменение энтропии 
 то есть изменение энтропии при переходе идеального газа из состояния 1 в состояние 2 не зависит от вида процесса. Для адиабатного процесса Q=0 тогда
то есть изменение энтропии при переходе идеального газа из состояния 1 в состояние 2 не зависит от вида процесса. Для адиабатного процесса Q=0 тогда  =0 а значит энтропия для данного процесса величина постоянная. Адиабатный процесс называют изоэнтропийным. Из последнего выражения следует что при изотермическом процессе (Т1=Т2)
=0 а значит энтропия для данного процесса величина постоянная. Адиабатный процесс называют изоэнтропийным. Из последнего выражения следует что при изотермическом процессе (Т1=Т2)  . Для изохорного процесса (V2=V1)
. Для изохорного процесса (V2=V1)  .
.


