Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Производные стероидных гормонов
Производные стероидных гормонов получают путем структурных изменений в молекуле взятого за основу стероида. Таким образом, получают стероиды имеющие высокую степень сродства с взятым за основу стероидом, но с измененными в нужную сторону параметрами. Алкилированием (алькилированием) называется введение в молекулы соединений алкила, например, метила CH3 (метилирование) или этила C2H5 (этилирование). Большинство оральных стероидов алкилированы по 17-альфа: к 17-ой позиции молекулы присоединена метиловая группа (СН3), что предохраняет стероид от быстрого разрушения в печени (при этом оказывая токсичное действие на нее), увеличивая период полураспада стероида до нескольких часов. В зависимости от характера биологической активности производные стероидных гормонов разделяют на три группы: кортикоидные (кортикостероиды), анаболические андрогенные (анаболические андрогенные стероиды, ААC, АС) и эстрогенные стероидные гормоны. Однако в организме, многие производные стероидных гормонов подвережены ферментативным реакциям в стероид-продуцирующих тканях, и могут превращаться в другие стероидные гормоны, являясь в этом случае одновременно и прогормонами (прекурсорами). Различные производные стероидных гормонов могут применяться перорально (в виде таблеток или капсул), в виде внутримышечных инъекций, а также в виде мазей (кремов или гелей) и ингаляционно (в виде спреев). Глава 2. Андрогенные гормоны История
Еще в 1849 г. Бертольдом было установлено, что у петухов при кастрации наступает атрофия гребня и что, наоборот, при пересадке семенников молодым кастрированным петушкам у них восстанавливаются вторичные половые признаки, т. е. рост гребешка, голос, поведение. Отсюда был сделан вывод, что в семенниках птиц содержатся какие-то активные вещества, обусловливающие половые отличия и половую деятельность. Кох и Мур и другие авторы приготовили первые активные андрогенные экстракты, для определения активности которых предлагались различные методы. В 1927 г. было обнаружено, что активное начало андрогенов содержится не только в семенниках, но и в моче мужчин. По Вальтеру и Пецарду, тест петушиного гребня основан на регенерации утраченных у каплунов характерных признаков. По Галахеру и Коху, петушиной, или каплуньей единицей называется то количество вещества, которое, спустя 5 дней при ежедневном инъекционном введении масляного раствора, увеличивает длину гребня на 5 мм. Единицей действия также считают то наименьшее количество вещества, которое вызывает рост гребня на 15—20% («петушиная единица»). Леве и Восс предложилии другой тест, основанный на росте семенных пузырьков у кастрированных грызунов. Дегенерированные после кастрациипузырькивновь вырастают при инъекции гормонаи, таким образом,секреторнаядеятельность восстанавливается.
Первым андрогенным гормоном, выделенным Бутенандтом и Чернингом в 1931 г. из мужской мочи, был андростерон. Он оказался оксикетоном. Вскоре Бутенандту, Данненбауму и другим авторам удалось выделить еще один активный непредельный кетон состава С19Н28О2. Из 5 мг мочи Бутенандту удалось выделить 15 мг мужского гормона. На основанииданныханализа, наличия окси- и кетогрупп, а также предположения о генетической связи гормона, названного андростероном (I), с холестерином ему было установлено строение андростанол-З-она-17 (I). В 1934 г. Ружичка подтвердил это строение синтезом и определил его пространственную конфигурацию, получив ацетат андростерона, окислением 3α-ацетата холестанола (II), в свою очередь полученного из холестанона (III):
В дальнейшем Бутенандтом был предложен более эффективный метод получения андростерона из дегидроэпиандростерона (IV). Взаимодействием последнего с пятихлористым фосфором был получен 3-хлоркетон (V), который после гидрирования (VI) и обменной реакции с ацетатом калия превращался в ацетат андростерона (VII):
Несмотря на доступность андростерона, он почти не нашел практического применения, так как в 1935 г. Лакером (Нидерланды) было показано, что в семенниках быков (и других животных) содержится более активный мужской гормон, названный тестостероном (VIII): Тестостерон активнее андростерона в 7 раз. Первый синтез тестостерона был осуществлен также Бутенандтом. При гидрировании ацетата дегидро- эпиандростерона (IX) водородом в присутствии скелетного никелевого катализатора был получен 3-ацетат-Δ5-андростендиола-3β,17β (Х), который бензоилированием в присутствии пиридина превращен в 3β-ацетат-17-бензоат-Δ5-андростендиола (XI), а затем частичным гидролизом ацетильной группы при температуре не выше 11° в 17-бензоат-Δ5-андростендиол-Зβ, 17β (ХII).
Окислением хромовым ангидридом, в присутствии уксусной кислоты (XI), после предварительной защиты двойной связи бромированием и последующего дебромирования цинком получен в результате гидролиза тестостерон (VIII):
В литературе описан ряд вариантов синтеза тестостерона из дегидроэпиандростерона (IV), андростендиона (XIII) и другого исходного сырья. По методу Мамоли, дегидроэпиандростерон (IV) окисляют по Оппенауэру в андростендион (XIII), который под влиянием дрожжевых грибков восстанавливают до тестостерона:
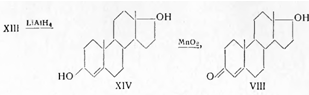
При использовании в качестве исходного продукта андростендиона его восстанавливают литий-алюминий-гидридом доандростендиола и затем окисляют перекисью марганца в нейтральном растворе. Этот реагент окисляет селективно лишь аллильные спирты, в результате чего образуется тестостерон (VIII):
В качестве исходного сырья для синтеза тестостерона использована также Δ5-3-оксиэтиохоленовая кислота. С помощью хлористого тионила 3-ацетат ее превращается в хлорангидрид 3-ацетоксиэтиохоленовой кислоты, затем азидом натрия (в сухом толуоле) и обработкой 60%-ной серной кислотой — в амин. После защиты двойной связи бромированием гидроксильная группа при С3 окисляется хромовой кислотой, бром отщепляется цинком и с помощью диазотирования нитритом натрия и разложения неустойчивого диазосоединения, в присутствии уксусной кислоты, он превращается в тестостерон: Тестостерон — мелкий белый кристаллический порошок, т. пл. 166— 171° не растворим в воде, растворяется в спирте, эфире, хлороформе. Применяют обычно в виде сложных эфиров — пропионата или энантата. При синтезе стероидных гормонов большое значение имеет доступность исходного сырья; в этом отношении β-ситостерин, получаемый из отходов производства бумаги, является весьма перспективным.
Как показали исследования Д.М. Халецкого с сотр., технология производства стероидных гормонов из β-ситостерина мало отличается от их производства из холестерина. Между тем, холестерин является дорогим сырьем животного происхождения, в то время как β-ситостерин — недефицитными дешевым. Тестостерон и его полусинтетические аналоги обладают способностью оказывать стимулирующее действие на синтез белков в организме (анаболический эффект). Анаболическое действие проявляют тестостерон, его эфиры, метилтестостерон. Однако у них этот эффект намного менее выражен, чем андрогенная активность. Метандриол (метиландростендиол), являющийся промежуточным продуктом синтеза метилтестостерона, проявляет слабую андрогенную и относительно более высокую анаболическую активность. Еще более избирательным анаболическим действием обладает метандиенон (метандростенолон). Впервые Мишером, Ветштейном и Шоппом было найдено, что андрогенное действие тестостерона усиливается жирными кислотами (1936 г.); аналогичное действие наблюдается и в присутствии высших спиртов, например стеарилового спирта. Дальнейшие исследования показали, что действие тестостерона повышается также при его этерификации. В связи с этим Ружичка и Ветштейном были синтезированы эфиры муравьиной, уксусной, пропионовой, масляной и изомасляной кислот, а также пальмитиновой и стеариновой; оказалось, что первые три эфира проявляют активность (на петушином гребне) уже в дозах 20 вторые два — в дозах 60—70γ, а последние два в дозах 1000γ. Слабее действуют ароматические эфиры, например бензойной кислоты — 100γ. На основании этих данных в медицину был введен тестостерон-пропионат.
Тестостерон-пропионат
Testosteronum рropionicum. Testosteroni propionas. Тестостерон-пропионат. Δ4-андростен-3-он-17 (р)-ол-17-пропионат. С22Н32О3. М = 314,50
Синонимы: Homosteron, Perandren, Testoviron и др. Получают нагреванием тестостерона с пропионовым ангидридом при 110—114°, с последующей перекристаллизацией из метилового спирта:
Тестостерон-пропионат — белый или белый с кремовым оттенком кристаллический порошок, т. пл. 158—123°, нерастворим в воде, растворяется в спирте, эфире, растительных маслах; удельный показатель поглощения при длине волны 241 ммк не ниже 465 (с = 0,001, 95% спирт). При гидролизе препарата 1%-ным спиртовым раствором едкого кали и последующей нейтрализации соляной кислотой выделяют тестостерон с т. пл. 150—153°. При нагревании со спиртовым раствором хлоргидрата гидроксиламина, в присутствии ацетата натрия, выделяют оксим тестостерон-пропионата с т. пл. 166—171°:
Чистоту препарата определяют по отсутствию потери в весе при высушивании и прокаливании. Хранят с предосторожностью (список Б), в хорошо закупоренных банках, в сухом месте, защищенном от действия света. Высшая разовая и суточная дозы — 0,05 г. Применяется при половом недоразвитии, мужском климактерии, нервных расстройствах по 0,025 г; у женщин — при нервных расстройствах, опухолях молочной железы, маточных кровотечениях и др. по 0,005—0,01 г. Выпускают в виде 1,2,5 и 5%-ного раствора в масле (в ампулах). Тестостерон-энантат
Testosteronum aenanticum. Тестостерон-энантат. Δ4-андростен-3-он-17-ол-17-энантат. С20Н40О3. М = 400,6
Получают по схеме:
Энантовую кислоту, т. кип. 116—118°, при 14 мм рт. ст. с помощью хлористого тионила превращают в хлорангидрид, т. кип. 65—66° при 14 мм рт. ст. и последний взаимодействием с тестостероном (в сухом пиридине и бензоле) при 50—55° в тестостерон-энантат. Для удаления избытка хлорангидрида энантовой кислоты смесь перемешивают с диэтиламиноэтанолом и выливают в раствор разбавленной соляной кислоты. После отгонки бензола получают энантат тестостерона, т. пл. 36—37,5°, удельное поглощение 390. При гидролизе спиртовым раствором едкого кали, с последующей очисткой ацетоном, температура плавления выделенного тестостерона 151—153°. Чистоту препарата определяют по отсутствию сульфатной золы и энантовой кислоты. Примесь последней определяют алкалиметрическим титрованием в спиртовой среде в присутствии индикатора фенолфталеина (содержание ее не должно превышать 0,15%).
Хранят с предосторожностью (список Б) Применяют для тех же целей, что и тестостерон-пропионат; обладает более сильным и более длительным андрогенным действием. Вводят внутримышечно в виде 5%-ного масляного раствора по 1 мл. Физиологическое действие андрогенов зависит от характера кислородных заместителей, но еще в большей степени от их пространственной конфигурации и характера сочленения колец в молекуле. Так, андростандион-3,17 (I) обладает активностью 130γ, почти равной активности андростерона, а андростандиол-3α, 17ß (II) — активностью в 20—25γ. С другой стороны, эпиандростерон (III) в 5—6 раз менее активен, чем андростерон, а изомер последнего — тестанол-3-он-17 (IV) с цис-сочленением колец А и В вообще неактивен:
Аналогично 17-изотестостерон (V) в 20 раз слабее тестостерона, а Δ4-андростендион (VI) слабее его лишь в 5—6 раз. Дигидротестостерон (VII) не отличается по силе действия от тестостерона, а 5-эпимер андростандиона- 3,17 (VIII) с цис-сочленением колец А и В неактивен:
Высокую андрогенную активность обнаруживают дитестостерон-янтарный и глутаровый эфиры (1949), а также гликозиды и ацетали тестостерона. Полученный из тестостерон-пропионата и пропандиола-1,3 в присутствии толуол сульфокислоты тестостерон-пропионат пропандиол-(Г,3') ацеталь обнаружил пролонгированное действие; в дозах 100у он действует 22 дня на петушиный гребень, в то время как тестостерон 15 дней. Как показали Ружичка и Кэги (1937 г.), 17-р-тестостерон в 15—25 раз менее активен, чем его 17-а-изомер; исключение представляет Дб-андростен-3-а-17-Рдиол, который лишь в 5 раз менее активен, чем его транс-аналог.
Метилтестостерон
Меlтеsтosтеrоnum. Метилтестостерон. 17-α-метилтестостерон. 17-α-метил –Δ4-андростен-3-он-17-ол. С20Н30О2. М = 302,4
Синонимы: Androral, Oraviron, Testoral и др. Получают действием магнийбромметила на 3-ацетатдегидроэпиандростерона-17 в эфире, с последующим окислением образовавшегося 17-метиландростендиола-3,17 по Оппенауэру (циклогексаноном в присутствии изобутилата алюминия и толуола):
17-Метилтестостерон — белый или белый с кремовым оттенком кристаллический порошок, т. пл. 161—167°, без запаха, не растворим в воде, растворяется в спирте, эфире, ацетоне, мало растворим в растительных маслах. Удельный показатель поглощения от 520 до 540 (с = 0,001, 95%-ный спирт) при длине волны 240 ммк. На воздухе слегка гигроскопичен. При ацетилировании уксусным ангидридом в присутствии пиридина, образует 17-ацетат-17α-метилтестостерона т. пл. 173-176°.
При оксимировании гидрохлоридом гидроксиламина, в присутствии ацетата натрия в среде метилового спирта, образует 3-оксим 17-метилтестостерона, т. пл. 210—216°. Чистоту препарата определяют по потере в весе (не более 1,5%) при высушивании до постоянного веса при 100—105° и отсутствии сульфатной золы (не более 0,1%). Хранят с предосторожностью (список Б), в хорошо закупоренных банках, защищенных от действия света. Высшая разовая доза — 0,05 г, суточная — 0,1 г. Применяют при половом недоразвитии и функциональных нарушениях половой сферы, а также при маточных кровотечениях в предклимактерическом и климактерическом периодах. Для большего эффекта действия рекомендуют сублингвальное применение; таблетку метилтестостерона задерживают под языком до полного рассасывания. Выпускают в таблетках по 0,005 г.
Метиландростендиол
Methylandrostendiolum. Methandriolum. Метиландростендиол. 17-α-метил-Δ5-андростен-3β-17β-диол. С20Н32О2. М = 304,48.
Синонимы: Androdiol, Metandiol, Notandron, Testodiol и др. Является промежуточным продуктом при синтезе 17-метилтестостерона. 17-Метиландростендиол — белый кристаллический порошок. Не растворим в воде и мало в спирте, растворяется в хлороформе, пиридине и кипящем метиловом спирте, т. пл. 202—206°. Раствор препарата в 80%-ной уксусной кислоте в присутствии концентрированной серной кислоты дает на границе слоев оранжевую полосу и затем зеленовато-желтую флуоресценцию. При ацетилировании уксусным ангидридом, в присутствии пиридина, образуется ацетильное производное, т. пл. 133—136°. Чистоту препарата определяют по отсутствию кетостероидов (0,002 г препарата растворяют в 1 мл 95%-ногоспирта и прибавляют 1 мл 95%-ного раствора м-динитробензола и 1 мл 15%-ного раствора едкого натра — спустя 1 ч раствор не должен быть темнее смеси 1 мл 95%-ного спирта с теми же реактивами). Хранят с предосторожностью (список Б), в сухом месте, защищенном от действия света. Применяют сублингвально для усиления белкового анаболизма у реконвалесцентов после тяжелых травм, операций, инфекционных и других заболеваний по 0,025—0,05 г на прием в виде таблеток. Обладая значительно меньшей андрогенной активностью, нежели метилтестостерон, препарат может применяться и в женской практике с целью повышения анаболизма, а также для уменьшения активности фолликулярного гормона в климактерическом периоде (и при раке молочной железы). При длительном применении иногда наблюдается усиленный рост волос на лице и туловище и увеличение сальности кожи. Кувада и Мнгасака (1938) синтезировали различные эфиры 17-метилтестостерона, но не получили интересных для медицины препаратов. Недеятельным оказался 17-аллилтестостерон, синтезированный Бутенандтом и Петерсом (1938 г.). При окислении Δ4-двойной связи тестостерона перекисью водорода получено соединение строения:
не обладающее андрогенной активностью. Аналогичны и другие полиоксисоединения, как андростантриол-3,5,6-он-17, андростантрион-3,16,17-ол-5, Δ5-андростентрион-3,4,17 и андростантриол-3,14,17 — оказались неактивными. Напротив, андростентрион-3,6,17 и 6-оксотестостерон в опытах на кастрированных крысах (самках) вызывали течку, т. е. проявляли активность женского гормона. 3-Галогенопроизводные дегидроэпиандростерона неактивны, но 17-хлор-Δ5-андростенол-3-ацетат достаточно активен (Вестфаль); слабой биологической активностью обладают 17-аминопроизводные андростана.
Замена пятичленного кольца D на шестичленное приводит к незначительному уменьшению активнрсти D-гомотестостерона (20—30γ). Он получен из циангидрина дегидроэпиандростерона (I), который при восстановлении дает оксиамин (II), а при действии на него азотистой кислоты перегруппировывается по Демьянову с расширением кольца вD -гомоаналог дегИдроэпиандростерона (III) и по методу Мамоли переводится в D-гомо- тестостерон (IV):
Полученный из Зα-окси-D-гомоандростерона 4,5-гомодигидротестостерон действует в опытах на крысах аналогично дигидротестостерону. Для проявления андрогенной активности необязательно присутствие С19-метильной группы; 19-нортестостерон также обладает андрогенной активностью. Он получается из эстрона (V) через метиловый эфир эстрадиола, с последующим восстановлением ароматического кольца литием и спиртом в жидком аммиаке в метоксикарбинол (VI); последний при кислотном гидролизе переходит в 19-нортестостерон (VII):
|
|||||||||
|
Последнее изменение этой страницы: 2017-01-26; просмотров: 277; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.174.95 (0.053 с.) |