Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Глава 5. Кортикостероидные гормоныСодержание книги
Поиск на нашем сайте
Характеристика
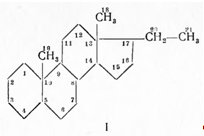
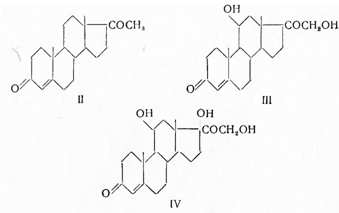
В надпочечниках различают корковый и мозговой слои. Мозговой слой выделяет гормон адреналин, обладающий сосудосуживающим действием. Из коры надпочечников выделено 29 кристаллических стероидных соединений, получивших название кортикостероидов, из которых 6 оказались способными продлевать жизнь адреналэктомированных животных. Все они являются прегнановыми производными, содержащими в кольце А Δ4-3-кетонепредельную группировку, а в положении 17-кетольную или диоксиацетоновую цепочку; часть из них при Сп имеет карбонильную или гидроксильную группу. Упомянутые кристаллические соединения обладают различной активностью как в качественном, так и в количественном отношениях. Так, дезоксикортикостерон (II), который относят к минералокортикоидам, регулирует солевой обмен; он способствует задержке в организме воды, натрия и повышает выделение из организма калия; кроме того, он усиливает явление анаболизма (синтез белка) и воспалительные процессы (повышает «воспалительный потенциал» организма), т. е. способность отвечать на раздражение воспалительной реакцией. Кортизон и другие родственные стероиды относят к глюкокортикоидам; они влияют на углеводный и белковый обмен и меньше на солевой обмен. По химическому строению стероидные гормоны надпочечников являются производными прегнана (I):
они могут быть разделены на 11-дезоксистероиды, например дезоксикорти костерон (II), 11-оксистероиды (III) и 11,17-диоксистероиды (IV)—кортизон и родственные ему соединения:
Представители глюкокортикоидов способствуют накоплению гликогена в печени, повышают содержание сахара в крови, вызывают увеличение выделения азота с мочой, обладают противовоспалительным действием. Адренокортикотропный гормон гипофиза (АКТГ) является физиологическим стимулятором коры надпочечников, без которого невозможна нормальная функция последней.
Дезоксикортикостерон-ацетат
Desoxycorticosteronum aceticum. Desoxycorticosteroni acetas. Desoxycortoni acetas. Дезоксикортикостерон-ацетат. 11-дезоксикортикостерон-21-ацетат. С23Н32О4. М = 372,51.
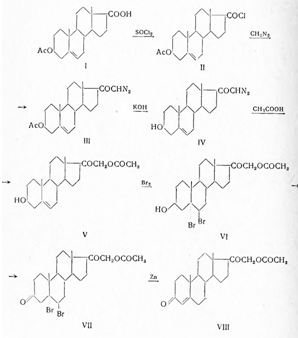
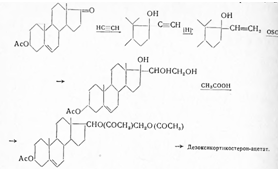
Синонимы: Соrtеnil, Соrtехоn, Соrtiron, DОСА и др. В отличие от многих кортикоидов, дезоксикортикостерон получен впервые в 1937 г. не изолированием из органов, а полусинтетическим путем (Штейгер, Рейхштейн) из 3β-ацетокси-5-этиеновой кислоты (I) — побочного продукта окисления 5,6-дибром-3-ацетата холестерина при синтезе дегидроэпиандростерона. С помощью тионилхлорида кислота эта превращена в хлорангидрид (II) и затем с помощью диазометана в диазокетон (III). При гидролизе 3-ацетильной группы едкой щелочью получен (IV), который ацетолизом превращен в 21-ацетокси-5-прегнен-3-ол-20-он. После присоединения одной молекулы брома образующийся дибромид (VI) окислен хромовой кислотой до 3-кетопроизводного (VII) и дебромированием цинковой пылью получен дезоксикортикостерон-ацетат (VIII):
В дальнейшем метод этот (1940) был улучшен; диазокетон по Оппенауэру окислен до 21-диазопрогестерона (IV) и затем уже ацетолизом превращен в дезоксикортикостерон-ацетат (VIII). Как показал далее Рейхштейн, 3-кето-4-этиеновая кислота (X), полученная окислением хромовой кислотой Зβ-окси-5-этиеновой кислоты (IX), после предварительного присоединения брома к двойной связи и последующего дебромирования, может быть превращена в 21-ацетоксипрегнан-3,20-дион (XIII), при бромировании с заменой водорода у С4 (XI) и отщеплении бромистого водорода с помощью пиридина (XII), а также других реакций, описанных ранее:
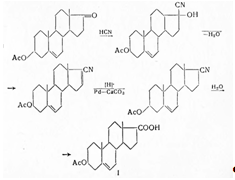
Вилдс и Шунк (1948) показали, что при действии оксалилхлорида на натриевую соль 3-кето-4-этиеновой кислоты (X) образуется хлорангидрид, который диазометаном переводят в 21-диазопрогестерон и действием затем уксусной кислоты в дезоксикортикостерон-ацетат. Лучшие выхода получены Шормом и Черни (1952) при присоединении цианистого водорода к дегидроэпиандростерон-ацетату, отщеплении воды и селективном гидрировании дегидронитрила в присутствии Рd-СаСO3. При гидролизе образуется кислота I:
Еще в 1939 г. дезоксикортикостерон-ацетат был получен из дегидроэпиандростерона присоединением ацетилена, с частичным гидрированием 17-виниландростен-3,17-диола и его окислением с помощью четырехокиси осмия до глицеринового производного. При отщеплении воды образуется дезоксикортикостерон; еще лучше ацетилированный продукт путем перегонки с цинковой пылью превращать в дезоксикортикостерон-ацетат;
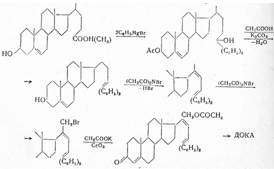
Практическое значение имеет использование Зβ-окси-5-холеновой кислоты (I), получаемой в качестве побочного продукта при окислении холестерилацетатдибромида. После превращения ее в метиловый эфир и действия 2 мол магний-бром-фенила получают соответствующий третичный спирт, который ацетилируют. При отщеплении воды кипячением с уксусной кислотой и дезацетилировании с помощью поташа вторичная спиртовая группа при С3 окисляется по Оппенауэру и бромированием с помощью N-бромсукцинимида, а также последующим отщеплением бромистого водорода с помощью диметиланилина получают диен. При дальнейшем действии N-бромсукцинимида на свету образуется 21-бромпроизводное, от которого боковую цепь отщепляют хромовой кислотой после предварительного ацетилирования:
В дальнейших, технически важных синтезах в качестве исходного продукта использовали 5-прегнен-3-β-ол-20-онацетат. При обработке его тетраацетатом свинца образуется 21-ацетоксипроизводное, которое при действии раствора гидрокарбоната калия селективно деацетилируется у С21 и полученное соединение с помощью хлористого тнонила превращают в С21-хлорид, а при дезацетилировании при С3 и окислении по Оппенауэру — в 21-хлорпрогестерон. При взаимодействии последнего с ацетатом натрия образуется дезоксикортикостерон-ацетат:
Дезоксикортикостерон-ацетат — белый или белый с кремовым оттенком кристаллический порошок без запаха, т. пл. 154—160°. Растворим в хлороформе, ацетоне, диоксане и спирте, не растворим в воде. Вращает плоскость поляризации вправо. Удельный показатель поглощения 430 (с = 0,001, 95%-ный спирт) при 240 ммк. Восстанавливает аммиачный раствор нитрата серебра и окрашивается концентрированной серной кислотой; при прибавлении хлороформа последний окрашивается в оранжевый цвет с красной флуоресценцией, водный слой окрашивается в зеленоватый цвет. Чистоту препарата определяют по отсутствию сульфатной золы и потере в весе (допускается потеря при высушивании до постоянного веса при 100—105° не более 0,5%). Хранят с предосторожностью (список Б), в банках оранжевого стекла с притертыми пробками, в сухом месте. Высшая разовая доза — 0,01 г, суточная — 0,02 г. Применяют при болезни Аддисона, общей мышечной слабости и других заболеваниях внутримышечно в масляных растворах по 5 мг 3 раза в неделю до 10 мг ежедневно. Препарат вызывает задержку ионов натрия и повышение выделения калия; противопоказан при гипертонической болезни, сердечной недостаточности, атеросклерозе и др. Кортизон-ацетат
Cortisonum aceticum. Cortisoni acetas. Кортизон-ацетат. 11-дегидро-17-α-оксикортикостерон-21-ацетат Δ4-прегнендиол-17α,21-трион-3,11,20,21-ацетат. С23н30о6. М = 402,5.
Синонимы: Аdreson, Соrtisуl, Соrtоnе. Описаны многочисленные методы синтеза; из них практический интерес имеют лишь те, которые приводят к значительным выходам. Всего целесообразнее исходить из прогестерона, который с помощью микробиологического окисления превращают в 11-оксипрогестерон и затем окислением в кортизон:
Петерсоном с сотрудниками (1953) было показано, что для синтеза кортизона целесообразно использование вещества S Рейхштейна (I), которое при окислении превращают в 11-эпигидрокортизон (II); при окислении ацетата последнего образуется кортизон (III):
Вещество S Рейхштейна не получило медицинского применения, но оказалось важным для синтеза кортизона. Еще в 1937 г. автором было показано, что оно может быть синтезировано из дегидроэпиандростерона по схеме: Как следует из схемы, необычным является образование диена (IV), который возникает в результате дегидратации (II), и перегруппировка (V) в (VI), под влиянием пиридина, открытая еще в 90-х годах Лобри-де-Брюином на примере глицеринового альдегида, изомерирующегося в диоксиацетон.
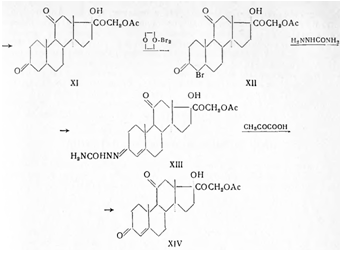
Синтез кортизона осуществлен также по методу Н.Н. Суворова из прогестерона (I) с применением микробиологических реакций. С помощью плесневого грибка Rhizopus nigricans [I] окисляют до И ос-оксипрогестерона (II) и двойную связь при С4 гидрируют в присутствии палладия, осажденного на кальции карбонате, при обычных условиях в среде пиридина до образования прегнанол-11α-диона-3,20 (III). Последний подвергают окислению бихроматом калия в присутствии серной кислоты и образовавшийся прегнантрион-3,11,20 (IV) вновь восстанавливают в пиридиновом растворе боргидридом натрия. При выливании в охлажденную разбавленную соляную кислоту выделяется прегнанол-3α-дион-11,20 (V). С целью получения прегнандиол-3α,17α-диона-11,20 (VIII), прегнанол-3α-дион-11,20 (V) подвергают кипячению с уксусным ангидридом и получают енолацетат (VI), который окисляют надфталевой кислотой. Образовавшуюся окись (VII) гидролизуют 1%-ным водно-метанольным раствором едкого натра и продукт реакции - прегнандиол-3α,17α-дион-11,20 (VIII) извлекают хлороформом. Бромирование (VIII) производят диоксандибромидом, в результате чего получают 21-бромпрегнан-диол-3α,17α-дион-11,20 (IX). Окисление производят бромсукцинимидом в метаноле при обычной температуре; при этом образуется 21-бромпрегнанол-17α-трион-3,11,20 (X). Для получения ацетата дигидрокортизона (XI) 21-бромпрегнанол-17α-трион-3,11,20 нагревают в диметилформамиде с безводным ацетатом натрия и продукт реакции высаживают водой. Бромирование ацетата дигидрокортизона (XI) производят диоксандибромидом в диметилформамиде в присутствии катализатора п-толуолсульфокислоты и полученный бромид (XII) высаживают водой. Превращение бромида (XII) в семикарбазон кортизон-ацетата (XIII) производят обработкой семикарбазидом в смеси хлороформа и третичнобутилового спирта. При растворении последнего в уксусной кислоте и действии пировиноградной кислоты происходит пересемикарбазирование и образуется кортизон-ацетат (XIV):
Кортизон-ацетат — белый или белый с желтоватым оттенком порошок, т. пл. 235—245° (с разл.), не растворим в воде, мало растворим в спирте и в ацетоне, растворяется в хлороформе, вращает плоскость поляризации вправо. Удельный показатель поглощения 390±10 (с = 0,001, 95% спирт) при 238 ммк. При нагревании до 70° метанольного раствора препарата с раствором фенилгидразинсульфата возникает желтая окраска, а при щелочном гидролизе спиртовым раствором едкого кали и прибавлении серной кислоты ощущается запах этилацетата. Раствор препарата в концентрированной серной кислоте обнаруживает желтую флуоресценцию, которую лучше наблюдать при нанесении на белую фарфоровую пластинку (отличие от преднизона).
Чистоту препарата определяют по отсутствию галогена (проба Бейльштейна), потере в весе (не более 0,5% при высушивании до постоянного веса при 100—105°), золы, семикарбазона кортизонацетата (минерализованный концентрированной серной кислотой в присутствии пергидрола препарат с реактивом Несслера в щелочной среде не должен обнаруживать более интенсивной окраски, нежели эталон на аммиак, приготовленный с теми же реактивами по ГФ). Кортизон-ацетат количественно может быть определен по оптической плотности при реакции с антроном в концентрированной серной кислоте. Кортизон-ацетат растворяют в абсолютном спирте (примерно 1 мг в 1 мл), часть раствора доводят до объема в 2 мл абсолютным спиртом, прибавляют 2 мл реактива (0,2%-ный раствор анилина в 96%-ной серной кислоте) и спустя 1 ч оптическую плотность определяют при 480 ммк спектрофотометром. Хранят с предосторожностью (список Б), в стеклянных, хорошо закупоренных банках, в защищенном от света месте. Высшая разовая доза — 0,15 г, суточная —0,3 г. Применяют внутрь и внутримышечно при ревматизме, подагрических, инфекционных и псориатических артритах, бронхиальной астме, острых лейкозах и других заболеваниях. Детям кортизон назначают внутримышечно, начиная с 0,05 г 2 раза в день. Выпускают в порошках, таблетках по 0,025 и 0,05 г, флаконах по 5 и 10 мл суспензии, содержащей 25 мг в 1 мл.
|
||||
|
Последнее изменение этой страницы: 2017-01-26; просмотров: 352; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.139.164 (0.009 с.) |