

Мы поможем в написании ваших работ!
ЗНАЕТЕ ЛИ ВЫ?
|
КИМ для интерактивного занятия № 1
| Параметр
| Баллы
| | Студент активно участвует в обсуждении выбора способов приготовления растворов, подготовил аргументы в пользу решения поставленных задач, предложил альтернативы. Студент выслушал мнения других. Студент внес вклад в работу группы. Выполнил лабораторную работу и ответил индивидуально на 5 вопросов тестового задания.
|
| | Студент активно участвует в обсуждении, не подготовил аргументы в пользу решения поставленных задач, предложил альтернативы. Студент выслушал мнения других. Студент внес вклад в работу группы. Выполнил лабораторную работу и ответил индивидуально на 4 вопроса тестового задания.
|
| | Студент безынициативно участвует в обсуждении, не подготовил аргументы в пользу решения поставленных задач, не предложил альтернативы. Студент выслушал мнения других. Допускал коммуникативные ошибки. Выполнил лабораторную работу и ответил индивидуально на 3 вопроса тестового задания.
|
| | Студент выполнял функцию наблюдателя. Не внес вклада в групповой ответ. Выполнил неверно лабораторную работу и ответил индивидуально на 2 и менее вопросов тестового задания.
|
| Подготовка к тестовому заданию приводится по учебнику: Коренман, Я. И. Практикум по аналитической химии. Анализ пищевых продуктов / Я. И. Коренман, Р. П. Лисицкая. – Воронеж: ВГТА, 2006.– 408 с. (с. 36-48)
КИМ для интерактивного занятия № 2
| Параметр
| Баллы
| | Студент активно участвует в обсуждении выбора формул расчета рН в растворах электролитов, подготовил аргументы в пользу решения поставленных задач, предложил альтернативы. Студент выслушал мнения других. Студент внес вклад в работу группы. Ответил индивидуально на 5 вопросов тестового задания.
|
| | Студент активно участвует в обсуждении, не подготовил аргументы в пользу решения поставленных задач, предложил альтернативы. Студент выслушал мнения других. Студент внес вклад в работу группы. Ответил индивидуально на 4 вопроса тестового задания.
|
| | Студент безынициативно участвует в обсуждении, не подготовил аргументы в пользу решения поставленных задач, не предложил альтернативы. Студент выслушал мнения других. Допускал коммуникативные ошибки. Ответил индивидуально на 3 вопроса тестового задания.
|
| | Студент играл роль наблюдателя. Не внес вклада в групповой ответ. Ответил индивидуально на 2 и менее вопросов тестового задания.
|
| Подготовка к тестовому заданию приводится по учебнику: Коренман, Я. И. Практикум по аналитической химии. Анализ пищевых продуктов / Я. И. Коренман, Р. П. Лисицкая. – Воронеж: ВГТА, 2006.– 408 с. (с. 68-83)
КИМ для интерактивного занятия № 3
| Параметр
| Баллы
| | Студент активно участвует в обсуждении метода количественного физико-химического анализа, подготовил аргументы в пользу решения поставленных задач, предложил альтернативы. Студент выслушал мнения других. Студент внес вклад в работу группы. Ответил индивидуально на 5 вопросов тестового задания.
|
| | Студент активно участвует в обсуждении, не подготовил аргументы в пользу решения поставленных задач, предложил альтернативы. Студент выслушал мнения других. Студент внес вклад в работу группы. Студент внес вклад в работу группы. Ответил индивидуально на 4 вопроса тестового задания.
|
| | Студент безынициативно участвует в обсуждении, не подготовил аргументы в пользу решения поставленных задач, не предложил альтернативы. Студент выслушал мнения других. Допускал коммуникативные ошибки. Ответил индивидуально на 3 вопроса.
|
| | Студент выполнял функцию наблюдателя. Не внес вклада в групповой ответ. Ответил индивидуально на 2 и менее вопросов тестового задания.
|
| 6 Форма и содержание текущего и промежуточного контроля
Текущий контроль
Проверка знаний в форме устных опросов, оценка за активное участие в деловых играх, принятие отчетов по лабораторным работам, оценка за тестовое задание
| № недели
| Тема
| Вид контроля
| | 3-4
| Приготовление растворов. Расчет при приготовлении растворов и результатов анализа в титриметрии.
| Отчет по лабораторной работе, оценка за активность в интерактивном обсуждении, ТЗ
| | 6-7
| Протолитометрия. Редоксиметрия.
Комплексонометрия.
| Отчет по лабораторным работам, оценка за активность в интерактивном обсуждении, ТЗ
| | 10-11
| Хроматографические методы анализа
| Отчет по лабораторным работам
| | 13-14
| Спектральные и оптические методы анализа
| Отчет по лабораторным работам
| |
| Электрохимические методы анализа
Оптические, электрохимические, хроматографические
методы анализа.
| Отчет по лабораторным работам.
Оценка за активность в интерактивном обсуждении, ТЗ
| Комплексное домашнее задание
(выдается студенту на 1 неделе обучения).
Для выполнения ДЗ нужен учебник:
Харитонов, Ю. Я. Аналитическая химия (аналитика): в 2 кн. – М.: Высш. шк., 2005.
Книга. 1: Общие теоретические основы. Качественный анализ.– 615 с.
Вопросы №№ 1-2 – общие, в скобках указаны страницы, где Вы можете найти соответствующую информацию. Вопрос № 4 – индивидуальный, Вам придется поразмышлять, возможно, будет необходима консультация лектора или преподавателя. Примерная схема ответа (выделена курсивом) на вопрос представлена после текста задания.
1. Приведите аналитические признаки веществ (с. 13). Аналитические реакции (с.13,18,20). Специфические (с. 18), селективные (с. 19), групповые (с. 19, 288) реагенты.
2. Систематический (12, 35) и дробный анализ (с. 11).
3. Составить обоснованную схему обнаружения ионов (катионы X,Y, анион Z) в растворе. Укажите последовательность и условия проведения определений. Составить уравнения соответствующих реакций.
| Х
| Катион
1 группы
| Y
| Катион
II (III) группы
| Z
| Анион
| |
| NH4+
|
| Ba2+
|
| Cl–
| |
| Na+
|
| Ca2+
|
| CH3COO–
| |
| K+
|
| Sr2+
|
| NO3–
| |
| Mg2+
|
| Fe2+
|
| CO3 2–
| |
| NH4+
|
| Cr3+
|
| SO42–
| |
| Na+
|
| Fe3+
|
| Br–
| |
| K+
|
| Mn2+
|
| Cl–
| |
| Mg2+
|
| Co2+
|
| CH3COO–
| |
| NH4+
|
| Ni2+
|
| NO3–
| |
| Na+
|
| Al3+
|
| CO3 2–
| Пример выполнения задания
Например, для анализа получена проба, содержащая ионы I–, Ba2+ и Ca2+.
Отмечают, что иодиды бария и кальция хорошо растворимы в воде. По сероводородной классификации катионы Ba2+ и Ca2+ относятся к II аналитической группе (групповой реагент – (NH4)2CO3)
Общая схема анализа
1. Обнаружение иодид-иона.
2. Действие группового реагента на катионы II аналитической группы.
3. Центрифугирование, отделение осадка карбонатов и растворение его в растворе уксусной кислоты.
4. Открытие и осаждение катионов бария по реакции с дихроматом калия.
5. Отделение осадка и обнаружение катионов кальция по реакции с оксалатом аммония.
Последовательность выполнения операций
1. Дробный анализ.
В отдельной порции раствора обнаруживают анионы I–.
2. Систематический анализ смеси.
К раствору добавляют аммонийный буферный раствор до рН 9,2 (контроль по универсальной индикаторной бумаге) и раствор (NH4)2CO3, осаждаются карбонаты кальция и бария:
Са2+ + CO32– → СаCO3↓,
Ва2+ + CO32– → ВаCO3↓.
Осадок отделяют центрифугированием, промывают дистиллированной водой и растворяют в уксусной кислоте:
МеCO3↓ + СН3СООН → (СН3СОО)2Ме + CO2↑ + Н2O.
К полученному раствору добавляют СН3СООNa (образуется ацетатная буферная смесь, рН = 5) и раствор K2Cr2O7, по выпадению ярко-желтого кристаллического осадка обнаруживают ионы Ва2+:
Ва2+ + Cr2O72+ → ВаCr2O7↓
Добавляют еще раствор K2Cr2O7, убеждаются, что все ионы бария удалены из раствора.
Смесь центрифугируют, осадок отделяют, к раствору центрифугата добавляют (NH4)2C2O4, по выпадению белого кристаллического осадка обнаруживают ионы кальция:
Са2+ + C2O42– → Са C2O4↓.
Справочные данные, необходимые для выполнения заданий 3-4 и решения задач, а также примеры их решения, варианты ответов на вопросы содержатся в учебном пособии [4].
Общая схема разделения катионов металлов наглядно представлена на с. 73 в учебнике:
Отто, М. Современные методы аналитической химии [Текст] / М.Отто.– М.:Техносфера, 2008.– 544 с.
КИМ для оценки домашнего задания
| Параметр
| Баллы
| | Студент самостоятельно выполнил домашнее задание, дал полную схему качественного определения ионов, указал условия определения, ответил на все вопросы, допустил не более 1 ошибки в ответе
|
| | Студент самостоятельно выполнил домашнее задание, дал полную схему качественного определения ионов, указал условия определения, ответил на вопросы, допустил более 1, но менее 3 ошибок
|
| | Студент самостоятельно выполнил домашнее задание, дал схему качественного определения ионов, но допустил ошибки, ответил не на все вопросы, но в тех, на которые дал ответ не допустил ошибки
|
| | Студент выполнил домашнее задание с ошибками, дал неполную схему качественного определения ионов, не ответил на вопросы, допустил более 5 ошибок
|
|
Промежуточный контроль
| № недели
| Тема
| Вид контроля
| |
| Химические методы анализа.
| К
| |
| Домашнее задание
| ДЗ
|
Вопросы для промежуточной аттестации
Вопросы к коллоквиуму по химическим методам анализа
| № вопроса
| Текст вопроса
| |
| Теория гомогенных равновесий. Кислотно-основное равновесия. Константы равновесия. Расчет рН в растворах кислот и оснований. Буферные системы. Расчет рН буферных растворов.
| |
| Качественный химический анализ. Основные понятия: аналитические реакции, дробный и систематический анализ, групповые реагенты.
| |
| Сущность титриметрического анализа. Требования, предъявляемые к реакциям, используемым в титриметрии. Стандартный раствор, титрант, титрование, точка эквивалентности, конечная точка титрования, индикатор, эквивалент, число и фактор эквивалентности, титр, титр стандартного раствора по определяемому веществу, массовая, молярная и молярная концентрация эквивалента.
| |
| Стандартные растворы: приготовленные (первичные стандартные растворы) и установленные (вторичные стандартные растворы). Первичные стандартные (установочные вещества), фиксаналы.
| |
| Классификация титриметрических методов по типу реакции титрования и по технике титрования. Вычисление результатов прямого, обратного титрования, титрования заместителя.
| |
| Метод кислотно-основного титрования. Задачи, решаемые методом. Расчет и построение кривых титрования сильных кислот (оснований) стандартизированным раствором сильных оснований (кислот), слабых кислот (оснований) стандартизированным раствором сильных оснований (кислот).
| |
| Скачок титрования; факторы, влияющие на величину скачка титрования.
| |
| Кислотно-основные индикаторы. Ионно-хромофорная теория индикаторов. Основное уравнение теории индикаторов. Интервал перехода окраски индикатора. Характеристика фенолфталеина и метилового оранжевого. Принципы выбора индикатора.
| |
| Общая характеристика и классификация методов окислительно-восстановительного титрования.
| |
| Окислительно-восстановительные реакции. Окислительно-восстановительный потенциал: стандартный и формальный (реальный). Уравнение Нернста.
| |
| Факторы, влияющие на величину окислительно-восстановительного потенциала
| |
| Кривые окислительно-восстановительного титрования. Редокс-индикаторы.
| |
| Характеристика методов окислительно-восстановительного титрования.
| |
| Перманганатометрия. Рабочий раствор, приготовление, стандартизация, хранение. Определение восстановителей методом прямого титрования.
| |
| Иодометрия. Стандартные растворы, приготовление, стандартизация, хранение. Условие проведения реакции иода с тиосульфатом натрия.
| |
| Комплексиметрическое титрование. Металлохромные индикаторы и принцип их действия на примере индикатора эриохромового черного Т. Требования, предъявляемые к металлохромным индикаторам.
| |
| Методы осадительного титрования. Аргентометрия. Определение галогенидов методом Мора. Роданидометрия. Метод Фольгарда.
| Вариант тестового задания
Общие вопросы анализа. Гомогенные равновесия.
Химические методы анализа.
| №
| Текст контрольно-измерительных материалов
| |
| Растворимость сульфата бария понизится при добавлении в насыщенный раствор– 1. H2O 3. KCl
2. H2SO4 4. KNO 3
| |
| Укажите ошибку при подготовке бюретки к работе
1. Закрепили в штативе
2. Ополоснули анализируемым раствором
3. «Носик» бюретки заполнили титрантом
4. Объем титранта установили на нулевой отметке
| |
| Титрант в кислотно-основном методе титрования (несколько вариантов)
1. Сильное основание
2. Сильная кислота
3. Слабая кислота
4. Сильный восстановитель
5. Комплексон ΙΙΙ
| |
| Укажите вещества по точной навеске которых можно приготовить стандартный раствор: (несколько вариантов)
1. CH3COOH
2. NaOH
3. HCl  4. H2C2O4·2H2O
5. K2Cr2O7
6. MgSO4
4. H2C2O4·2H2O
5. K2Cr2O7
6. MgSO4
| |
| Рассчитайте молярную концентрацию эквивалента (моль/дм3) раствора щавелевой кислоты с титром 0,0045 г/см3.
1. 0,1 2. 0,05
2. 0,07 4. 0,04
| |
| Для разбавления 20 см3 0,1 моль/дм3 раствора H2C2O4 в 10 раз следует взять мерную колбу вместимостью (см3):
1. 50
2. 100
3. 200
4. 1000
| |
| Выберите титрант и индикатор для определения в растворе CH3COOH:
| | №
| Титрант
| №
| Индикатор
| |
| HCl
|
| мурексид
| |
| Na2Н2Y
|
| фенолфталеин
| |
| Na2B4O7
|
| эриохромовый черный Т
| |
| KOH
|
| метиловый оранжевый
| |
| AgNO3
|
| дифениламен
|
| |
| Формула вещества, 0,1 М раствор которого характеризуется наименьшим начениием рН, имеет вид
1. H2СO3 3. НCl
2. H2S 4. Nа2НРO4
| |
| Значение рН 0,01 М раствора азотной кислоты (a = 1) равно….
1. 1
2. 3
3. 0
4. 2
| |
| Для нейтрализации 25 мл раствора гидроксида калия с молярной концентрацией эквивалентов 0,2 моль/л требуется _________ мл раствора серной кислоты с молярной концентрацией эквивалентов 0,1 моль/л (с точностью до точного значения).
1. 13 2. 50
2. 25 3. 100
| |
| 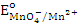 = 1,51 В. Восстановить = 1,51 В. Восстановить  в кислой среде (ответ поясните) может…
1. KbrO3; в кислой среде (ответ поясните) может…
1. KbrO3; 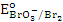 = 1,52 В
2. Na2C2O4; = 1,52 В
2. Na2C2O4;  = 0,49 B
3. H2O2; = 0,49 B
3. H2O2;  = 0,77 B
4. Na2S4O8; = 0,77 B
4. Na2S4O8;  = 2,0 B = 2,0 B
- F2;
 -= 2,87 B -= 2,87 B | |
| При установлении молярной концентрации эквивалента рабочего раствора перманганата калия в колбу для титрования помещали 10 см3 щавелевой кислоты и ….
| 1. аммонийный буферный раствор.
| | 2. раствор серной кислоты.
| | 3. раствор серной кислоты, эриохромовый черный Т.
| | 4. аммонийный буферный раствор, фенолфталеин.
|
| |
| При титровании в редоксиметрии меняется … раствора
- pH
- Е
- pMe
| |
| Продукты реакции FeSO4+KmnO4+H2SO4→ … Напишите уравнение реакции, расставьте коэффициенты.
- Fe2(SO4)3
- MnSO4
- MnO2
| - K2SO4
- H2O
- K2MnO4
|
| |
| Способ фиксирования ТЭ в перманганатометрии. Объясните причину изменения окраски титруемого раствора вблизи точки эквивалентности.
- применение специфического индикатора
- безиндикаторное титрование
- применение редокс-индикатора
- применение фенолфталеина
| |
| При определении окислителей методом иодометрии в качестве способа титрования, стандартного вещества и индикатора применяют …
| | №
| С
особ титрования
| №
| Стандартное вещество
| №
| Индикатор
| |
| Реверсное
|
| Н2С2О4
|
| крахмал
| |
| Прямое
|
| Н2С2О4 · Н2О
|
| фенолфталеин
| |
| Заместительное
|
| Na2S2O3
|
| эриохромовый черный Т
| |
| Обратное
|
| K2Cr2O7
|
| безиндикаторное титрование
| |
|
|
| крахмал
|
| дифениламен
|
| |
| Катионы, определяемые методом комплексонометрии (несколько вариантов)
| |
| Буферная смесь, применяемая в комплексонометрии, для поддержания pH>9
1. NH4OH+NH4Cl
2. CH3COOH+CH3COONa
3. HCOOH+HCOONa
4. C6H5OOH+C6H5OONH4
| |
| Укажите правильную формулу комплексоната магния:
| |
| 1.     ООС–Н2С СН2 –СООNa ООС–Н2С СН2 –СООNa
    N–СН2 –СН2– N N–СН2 –СН2– N
 NaООС–Н2С СН2 –СОО NaООС–Н2С СН2 –СОО
  Мg Мg
|  2. 2.     ООС–Н2С СН2 –СОО ООС–Н2С СН2 –СОО
    N–СН2 –СН2– N N–СН2 –СН2– N
 NaООС–Н2С СН2 –СОО NaООС–Н2С СН2 –СОО
  Мg Мg
 
| 3.  NaООС–Н2С СН2 –СООMg
N–СН2 –СН2– N NaООС–Н2С СН2 –СООMg
N–СН2 –СН2– N
 MgООС–Н2С СН2 –СООNa. MgООС–Н2С СН2 –СООNa.
| 4.   НООС–Н2С СН2 –СООMg
N–СН2 –СН2– N
NaООС– Н2С СН2 –СООН. НООС–Н2С СН2 –СООMg
N–СН2 –СН2– N
NaООС– Н2С СН2 –СООН.
|
| |
| Титрант и индикатор при определении хлорид-ионов в растворе методом Мора… Приведите уравнения протекающих реакций.
1. AgNO3, Fe(III) 3. AgNO3, K2CrO4
2. I2, крахмал 4. KSCN, Fe(III)
| |
| |
| Формула соли, в водном растворе которой индикатор фенолфталеин приобретает малиновую окраску, имеет вид
1. К2НРО4 3. KNO3
2. К2SO4 4. FeSO4
| |
| Для какой системы скачок на кривой титрования наибольший? Концентрация компонентов 0,01 моль/дм3.
| 1. КОН + Н2С2O4.
| 3. NH4OH + НNO3.
| | 2. НСl + NaOH.
| 4. NaOH + СН3СООН.
|
| |
| Масса азотной кислоты, содержащаяся в 5 л ее раствора, значение рН которого равно 3, составляет __________ г (a = 1).
1. 0,126
2. 0,315
3. 0,063
4. 0,56
| |
| Для какой системы точка эквивалентности не совпадает с точкой нейтральности и находится при рН < 7?
| 1. NaOH + СН3СООН.
| 3. КОН + Н2С2O4.
| | 2. NH4OH + НСl.
| 4. НСl + NaOH.
|
| |
| Напишите уравнение реакции в молекулярном, ионном виде и рассчитайте рН анализируемого раствора в точке эквивалентности при титровании 0,1 М раствора уксусной кислоты 0,1 М раствором гидроксида натрия. Выберите наиболее подходящий индикатор для такой системы, ответ обоснуйте.
1. рН = 7 2. рН = 8,9
3. рН = 9,9 4. рН = 5,1
| |
| Массовая доля примесей (%) в техническом образце NaOH массой 0,10 г, если на его титрование затрачено 20 см3 раствора соляной кислоты с молярной концентрацией эквивалента 0,02 моль/дм3…
1. 36,0 2. 67,7
3. 26,2 4. 64,0
| |
| Скачок на кривой титрования находится в интервале + 0,50... + 1,00 В. Какой редокс-индикатор применим для фиксирования точки эквивалентности?
| 1. ферроин; ЕoInd. = + 1,06 В, n = 1.
| | 2. Фенилантраниловая кислота; ЕoInd. = + 1,08 В, n = 1.
| | 3. Нейтральный красный; ЕoInd. = + 0,24 В, n = 1.
| | 4. Дифениламин; ЕoInd. = + 0,76 В, n = 2.
|
| |
| Соответствие между ионами металлов и условием их определения
| 1. Mg2+, Са2+
| 1. рН = 1 – 2
| | 2. Fe3+, Th4+
| 2. рН = 5 – 7
| | 3. Zn2+, Cu2+
| 3. рН = 9 – 10
|
| |
| Наименьшей растворимостью (моль/л) обладает карбонат двухвалентного металла, значение произведения которого равно
1. 3,8∙10-9
2. 1,8∙10-11
3. 4,0∙10-10
- 7,5∙10-14
| |
| |
| При перманганатометрическом титровании ( )анализируемый раствор КBr ( )анализируемый раствор КBr ( ) был подкислен раствором азотной кислоты ( ) был подкислен раствором азотной кислоты (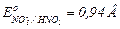 ). Правильные ли получены результаты? ). Правильные ли получены результаты?
- Нет, результаты завышены.
- Нет, результаты занижены.
- Да, результаты правильные.
4. Нет, воспроизводимость результатов отсутствует из-за неколичесвенного взаимодействия.
| |
| Формула соли, в водном растворе которой индикатор фенолфталеин приобретает малиновую окраску, имеет вид
1. К2НРО4
3. К2SO4
4. KNO3
5. FeSO4
| |
| При сливании 200 мл 0,1 М раствора Са(NО3)2 и 150 мл 0,2 М раствора К2СО3 образуется осадок массой _________ г.
1. 1000 2. 1,00
3. 2000 4. 2,00
| |
| Раствор гидроксида бария массой 200 г и массовой долей растворенного вещества 17,1 % разбавили водой до объема 400 мл. Молярная концентрация эквивалентов Ва(ОН)2 в полученном растворе составляет ________ моль/л.
1. 2 3. 0,5
2. 0,1 4. 1
| |
| H2C2O4 в растворе можно определить:
| | Метод
| Тирант
| Стан-дартное вещество
| Химическая
реакция
H2C2O4+Титрант
| Условия
| Способ фиксирования точки эквивалентности
| m(H2C2O4) =…
| |
|
|
|
|
|
|
|
|
|



 4. H2C2O4·2H2O
5. K2Cr2O7
6. MgSO4
4. H2C2O4·2H2O
5. K2Cr2O7
6. MgSO4
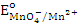 = 1,51 В. Восстановить
= 1,51 В. Восстановить  в кислой среде (ответ поясните) может…
1. KbrO3;
в кислой среде (ответ поясните) может…
1. KbrO3; 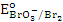 = 1,52 В
2. Na2C2O4;
= 1,52 В
2. Na2C2O4;  = 0,49 B
3. H2O2;
= 0,49 B
3. H2O2;  = 0,77 B
4. Na2S4O8;
= 0,77 B
4. Na2S4O8;  = 2,0 B
= 2,0 B
 -= 2,87 B
-= 2,87 B


 ООС–Н2С СН2 –СООNa
ООС–Н2С СН2 –СООNa



 N–СН2 –СН2– N
N–СН2 –СН2– N
 NaООС–Н2С СН2 –СОО
NaООС–Н2С СН2 –СОО

 Мg
Мg
 2.
2. 


 NaООС–Н2С СН2 –СООMg
N–СН2 –СН2– N
NaООС–Н2С СН2 –СООMg
N–СН2 –СН2– N
 MgООС–Н2С СН2 –СООNa.
MgООС–Н2С СН2 –СООNa.
 НООС–Н2С СН2 –СООMg
N–СН2 –СН2– N
NaООС– Н2С СН2 –СООН.
НООС–Н2С СН2 –СООMg
N–СН2 –СН2– N
NaООС– Н2С СН2 –СООН.
 )анализируемый раствор КBr (
)анализируемый раствор КBr ( ) был подкислен раствором азотной кислоты (
) был подкислен раствором азотной кислоты (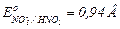 ). Правильные ли получены результаты?
). Правильные ли получены результаты?



