
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Продукты питания из растительного сырья»Содержание книги
Поиск на нашем сайте
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ ВОРОНЕЖСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ИНЖЕНЕРНЫХ ТЕХНОЛОГИЙ»
РАБОЧАЯ ПРОГРАММА ДИСЦИПЛИНЫ РП ВГУИТ Б2.В.1 260100 – 2011
Аналитическая химия
Направление подготовки Продукты питания из растительного сырья»
Профили подготовки
«Технология хранения и переработки зерна», «Технология хлеба, кондитерских и макаронных изделий», «Технология сахаристых продуктов», «Технология бродильных производств и виноделия»
Квалификация (степень) выпускника Бакалавр
Воронеж – 2011 1. Цели и задачи дисциплины
Цель преподавания дисциплины – формирование профессиональных компетенций, связанных со способностью выпускника обладать теоретическими знаниями фундаментальных основ различных разделов аналитической химии и физико-химических методов анализа для решения профессиональных задач в соответствии со следующими видами профессиональной деятельности: в производственно-технологической деятельности: Ø обеспечение входного контроля качества свойств сырья и полуфабрикатов; Ø участие в мероприятиях по организации эффективной системы контроля и качества сырья, учет сырья и готовой продукции на базе стандартных и сертификационных испытаний; · в экспериментально-исследовательской деятельности: Ø проведение измерений; анализ и математическая обработка экспериментальных данных; использование результатов исследований; подготовка материалов для составления научных обзоров, отчетов и публикаций; · в организационно-управленческой деятельности: Ø осуществление технического контроля и управление качеством продуктов питания из растительного сырья.
Задачи изучения дисциплины – обеспечить общенаучную подготовку по аналитической химии в плане непрерывной химической подготовки с учетом основных областей профессиональной деятельности бакалавров техники и технологии продуктов питания растительного происхождения:
Ø расширение и углубление теоретической общехимической подготовки студентов, развитие научного химического мышления; Ø овладение теоретическими основами аналитических методов; методологией выбора оптимального метода анализа и исследования материалов; Ø получение знаний химических и физических свойств веществ и их применению для получения аналитической информации в различных химических и физико-химических методах анализа; Ø овладение приемами и навыками аналитического эксперимента, обеспечивающие достоверность конечных результатов анализа при заданной надежности; Ø освоение типовой аппаратуры, применяемой в лабораториях пищевых предприятий; Ø приобретение навыков проведения качественного и количественного анализа модельных растворов по заданной методике химическими и физико-химическими методами.
Решение задач изучения дисциплины позволит студентам, освоившим курс, применить навыки проведения химического и физико-химического анализа с целью: Ø осуществлять входной контроль качества сырья растительного происхождения, пищевых добавок и улучшителей; Ø выполнять производственный контроль качества полуфабрикатов и параметров технологического процесса; Ø осуществлять контроль качества продукции в соответствии с требованиями санитарных норм и правил; Ø проведение измерений; использование результатов исследований; подготовка материалов для составления научных обзоров, отчетов и публикаций;
2. Место дисциплины в структуре ООП ВПО Дисциплина входит в математический и естественнонаучный цикл ООП (вариативная часть, Б2; В1). Для изучения дисциплины на основе освоения смежных дисциплин студент должен знать: Ø фундаментальные разделы математики в необходимом объеме для обработки информации и анализа данных; Ø фундаментальные разделы физики (общая теория относительности, законы электростатики, природа магнитного поля и поведение веществ в магнитном поле, законы электромагнитной индукции, волновые процессы, геометрическая и волновая оптика, основы квантовой механики, строение мноогоэлектронных атомов, строение ядра, классификация элементарных частиц);
Ø фундаментальные разделы общей, неорганической и органической химии в объеме, необходимом для понимания основных закономерностей физико-химических и химических процессов; атомно-молекулярное учение, строение, периодический закон и периодическая система элементов Д.И. Менделеева, химическая связь, комплексные соединения, координационная связь, химическое равновесие, растворы, теория электролитической диссоциации, химические свойства веществ и их смесей, окислительно-восстановительные процессы, основы электрохимии; классификацию и номенклатуру, строение органических соединений, свойства основных классов органических соединений; уметь: Ø использовать базовые знания в области математических и естественнонаучных дисциплин для управления процессом производства продуктов питания из растительного сырья; Ø применять математические понятия при описании прикладных задач и использовать математические методы при их решении; Ø решать типовые задачи по основным разделам курса физики; Ø проводить расчеты концентраций растворов различных соединений; Ø определять основные физические характеристики веществ; владеть: Ø методами математического описания типовых задач и интерпретации полученных результатов; Ø методами проведения физических измерений.
Дисциплина является предшествующей при изучении курсов «Физическая и коллоидная химия» (Б2.В2), «Органическая химия» (Б2.Б5), «Биохимия» (Б2.Б6), «Биохимия продуктов брожения» (Б.2ДВ2), «Методы исследования сырья и продуктов растительного происхождения» / «Комплексная оценка состава и свойств пищевых продуктов» / «Современные физико-химические методы анализа» (Б2. ДВ3), «Методы исследования свойств зернопродуктов и вторичного сырья перерабатывающих предприятий» / «методы физико-химического контроля и анализа зерна и продуктов его переработки» / «Современные физико-химические методы анализа зернопродуктов» (Б2. ДВ3), «Экология» (Б2.В3), «Безопасность жизнедеятельности» (Б3.Б5), «Метрология, стандартизация и сертификация» (Б2.В4), «Пищевая химия» (Б3.Б9), «Медико-биологические требования и санитарные нормы качества пищевых продуктов» (Б3. Б6), «Химико-технологический контроль на предприятиях отрасли» (Б3.В4), «Общая технология» / «Общая технология отрасли» /«Общая технология пищевых производств» (Б3.В5), Полученные знания необходимы студентам при подготовке, выполнении и защите выпускной квалификационной работы и при решении научно-исследовательских задач в будущей профессиональной деятельности. 3. Требования к результатам освоения содержания дисциплины Процесс изучения дисциплины направлен на формирование следующих компетенций: · общекультурные компетенции: использовать основные законы естественнонаучных дисциплин в профессиональной деятельности, применять методы математического анализа и моделирования, теоретического и экспериментального исследования (ОК-10); · в общепрофессиональной деятельности выпускник должен обладать: способностью использовать основные законы естественнонаучных дисциплин в профессиональной деятельности, применять методы математического анализа и моделирования, теоретического и экспериментального исследования (ПК-1);
· в производственно-технологической деятельности выпускник должен обладать способностью использовать в практической деятельности специализированные знания фундаментальных разделов химии для освоения физических, химических, биохимических, биотехнологических, микробиологических, теплофизических процессов, происходящих при производстве продуктов питания из растительного сырья (в соответствии с профилем подготовки) (ПК-8). · в экспериментально-исследовательской деятельности выпускник должен обладать: готовностью проводить измерения и наблюдения, составлять описания проводимых исследований, анализировать результаты исследований и использовать их при описании отчетов и научных публикаций (ПК-14).
В результате освоения дисциплины студент должен: Знать Ø основные законы естественнонаучных дисциплин, Ø основные законы физики и химии, применяемые при производстве продуктов из растительного сырья с привлечением химических и физико-химических методов анализа; Ø фундаментальные разделы химии и физико-химических методов анализа для освоения процессов, происходящих при производстве продуктов питания из растительного сырья; Ø основные этапы качественного химического анализа, теоретические основы и принципы количественного химического анализа; Ø химические и инструментальные методы качественного и количественного анализа; методы количественного анализа (титриметрические, гравиметрические, метод градуировочного графика, добавок и т.д.); Ø методики измерения физико-химических параметров модельных растворов при производстве продуктов из растительного сырья; Ø способы измерения основных физико-химических показателей; Ø назначение и устройство приборов инструментальных методов анализа; Уметь: Ø использовать в практической деятельности специализированные знания фундаментальных разделов аналитической химии; Ø проводить расчеты концентрации растворов различных соединений; Ø пользоваться аналитическими и техническими весами, мерной посудой, готовить и стандартизировать растворы, работать на приборах инструментальных методов анализа; Ø проводить измерения с привлечением приборной техники; Ø применять полученные знания и навыки для анализа модельных растворов. Владеть Ø методами определения концентраций веществ в растворах, Ø навыками проведения количественного анализа химическими и физико-химическими методами с применением современной приборной техники и реализовать их для анализа модельных растворов.
4. Объем дисциплины и виды учебной работы
Общая трудоемкость дисциплины составляет 3 зачетных единиц.
5 Содержание дисциплины 5.1 Содержание разделов дисциплины
5.2 Разделы дисциплины и междисциплинарные связи с обеспечиваемыми (последующими) дисциплинами
5.3 Разделы дисциплины и виды занятий
5.3.1 Лекции
5.3.3 Лабораторный практикум
5.3.2 Практические занятия (семинары) не предусмотрены 5.3.4 Занятия, проводимые в интерактивных формах обучения
Текущий контроль Проверка знаний в форме устных опросов, оценка за активное участие в деловых играх, принятие отчетов по лабораторным работам, оценка за тестовое задание
Комплексное домашнее задание (выдается студенту на 1 неделе обучения).
Для выполнения ДЗ нужен учебник: Харитонов, Ю. Я. Аналитическая химия (аналитика): в 2 кн. – М.: Высш. шк., 2005. Книга. 1: Общие теоретические основы. Качественный анализ.– 615 с. Вопросы №№ 1-2 – общие, в скобках указаны страницы, где Вы можете найти соответствующую информацию. Вопрос № 4 – индивидуальный, Вам придется поразмышлять, возможно, будет необходима консультация лектора или преподавателя. Примерная схема ответа (выделена курсивом) на вопрос представлена после текста задания. 1. Приведите аналитические признаки веществ (с. 13). Аналитические реакции (с.13,18,20). Специфические (с. 18), селективные (с. 19), групповые (с. 19, 288) реагенты. 2. Систематический (12, 35) и дробный анализ (с. 11). 3. Составить обоснованную схему обнаружения ионов (катионы X,Y, анион Z) в растворе. Укажите последовательность и условия проведения определений. Составить уравнения соответствующих реакций.
Пример выполнения задания Например, для анализа получена проба, содержащая ионы I–, Ba2+ и Ca2+. Отмечают, что иодиды бария и кальция хорошо растворимы в воде. По сероводородной классификации катионы Ba2+ и Ca2+ относятся к II аналитической группе (групповой реагент – (NH4)2CO3) Общая схема анализа 1. Обнаружение иодид-иона. 2. Действие группового реагента на катионы II аналитической группы. 3. Центрифугирование, отделение осадка карбонатов и растворение его в растворе уксусной кислоты. 4. Открытие и осаждение катионов бария по реакции с дихроматом калия. 5. Отделение осадка и обнаружение катионов кальция по реакции с оксалатом аммония. Последовательность выполнения операций 1. Дробный анализ. В отдельной порции раствора обнаруживают анионы I–. 2. Систематический анализ смеси. К раствору добавляют аммонийный буферный раствор до рН 9,2 (контроль по универсальной индикаторной бумаге) и раствор (NH4)2CO3, осаждаются карбонаты кальция и бария: Са2+ + CO32– → СаCO3↓, Ва2+ + CO32– → ВаCO3↓. Осадок отделяют центрифугированием, промывают дистиллированной водой и растворяют в уксусной кислоте: МеCO3↓ + СН3СООН → (СН3СОО)2Ме + CO2↑ + Н2O. К полученному раствору добавляют СН3СООNa (образуется ацетатная буферная смесь, рН = 5) и раствор K2Cr2O7, по выпадению ярко-желтого кристаллического осадка обнаруживают ионы Ва2+: Ва2+ + Cr2O72+ → ВаCr2O7↓ Добавляют еще раствор K2Cr2O7, убеждаются, что все ионы бария удалены из раствора. Смесь центрифугируют, осадок отделяют, к раствору центрифугата добавляют (NH4)2C2O4, по выпадению белого кристаллического осадка обнаруживают ионы кальция: Са2+ + C2O42– → Са C2O4↓. Справочные данные, необходимые для выполнения заданий 3-4 и решения задач, а также примеры их решения, варианты ответов на вопросы содержатся в учебном пособии [4]. Общая схема разделения катионов металлов наглядно представлена на с. 73 в учебнике: Отто, М. Современные методы аналитической химии [Текст] / М.Отто.– М.:Техносфера, 2008.– 544 с. КИМ для оценки домашнего задания
Промежуточный контроль
Вопросы для промежуточной аттестации Вопросы к коллоквиуму по химическим методам анализа
Вариант тестового задания Общие вопросы анализа. Гомогенные равновесия. Химические методы анализа.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-25; просмотров: 188; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.220.110.45 (0.018 с.) |

 4. H2C2O4·2H2O
5. K2Cr2O7
6. MgSO4
4. H2C2O4·2H2O
5. K2Cr2O7
6. MgSO4
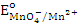 = 1,51 В. Восстановить
= 1,51 В. Восстановить  в кислой среде (ответ поясните) может…
1. KbrO3;
в кислой среде (ответ поясните) может…
1. KbrO3; 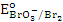 = 1,52 В
2. Na2C2O4;
= 1,52 В
2. Na2C2O4;  = 0,49 B
3. H2O2;
= 0,49 B
3. H2O2;  = 0,77 B
4. Na2S4O8;
= 0,77 B
4. Na2S4O8;  = 2,0 B
= 2,0 B
 -= 2,87 B
-= 2,87 B


