
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Дані потенціометричного титрування хлоридної кислоти лугомСодержание книги
Поиск на нашем сайте
Таблиця 20 Дані потенціометричного титрування хлоридної кислоти лугом (уточнення точки еквівалентності)
2. Титрування слабкої кислоти проводять аналогічно п. 1. Дані титрування заносять у таблиці 21, 22. Таблиця 21 Дані потенціометричного титрування оцтової кислоти лугом
Таблиця 22 Дані потенціометричного титрування оцтової кислоти лугом (уточнення точки еквівалентності)
3. За даними титрування будують інтегральний графік залежності рН від об’єму титранта (рис. 20) і диференціальний графік залежності ΔрН/ΔV від об’єму титранта (рис. 21). 4. Знаходять об’єми лугу, що пішли на титрування. По знайденому в точці еквівалентності об'єму лугу (Vе) розраховують абсолютну кількість відтитрованої кислоти n, використовуючи співвідношення, моль: n(кислоти)пр. = Nл · Vе, де Nл - молярна концентрація еквівалентів лугу, моль/л; Vе - об'єм лугу в точці еквівалентності, л. Знайдене значення порівнюють із кількістю молів еквівалентів кислоти, що взята для аналізу: n(кислоти)теор. = Nк · Vк, де Nк - молярна концентрація еквівалентів кислоти, моль/л; Vк - об'єм кислоти, який взято для аналізу, л. n(HCl)пр. = Nл·Vе _____________________________________________________________________ n(HCl)теор. = Nк·Vк____________________________________________________________________ n(СН3СООH)пр. = Nл·Vе _______________________________________________________________ n(СН3СООH)теор. = Nк·Vк______________________________________________________________ Визначають відносну похибку вимірів. ____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
5. Одержують у викладача контрольний розчин, титрують його, будують графіки титрування і визначають кількість кислоти. Визначають відносну похибку визначення в задачі. Дані заносять у таблицю 23.
Таблиця 23 Результати потенціометричного кислотно-основного титрування
Питання та вправи для самоконтролю 1. Які електроди називають електродами порівняння і індикаторними електродами? Поясніть будову каломельного та хлоридсрібного електродів. 2. Яку величину називають стандартним (нормальним) окисно-відновним потенціалом? 3. Який принцип потенціометричного методу аналіза? 4. Які види потенціометрії використовуються в аналізі і на чому вони основані? 5. Які індикаторні електроди застосовують в потенціометричному кислотно-основному, окисно-відновному титруванні? 6. Обчисліть потенціал алюмінієвого електроду у розчині, який містить 13,35 г AlCl3 у 500 мл розчину, при 30оС відносно водневого електроду. (відповідь 1,656 В). 7. При титруванні 25,0 мл розчину оцтової кислоти розчином з молярною концентрацією еквівалентів натрій гідроксиду 0,0100 моль/л отримані наступні дані:
VNaOH, мл 15,00 16,00 17,00 17,50 18,00 18,50 19,00 20,00 рН 5,40 5,60 5,85 6,10 6,50 9,70 10,30 10,70 ΔрН/ΔV 0,20 0,25 0,50 0,80 6,18 1,20 0,40
Розрахуйте молярну концентрацію еквівалентів CH3COOH. (відповідь 0,074 моль/л) Лабораторна робота №9 Потенціометричне визначення концентрації Йонів натрію у водяних розчинах
Мета роботи: навчитися практично визначати концентрацію йонів Na+ у водяних розчинах потенціометричним методом за допомогою скляного електрода з натрієвою функцією. Прилади і реактиви Йономір універсальний ЭВ-74, колби мірні об’ємом 100 мл, піпетки на 1 мл, 2 мл, 5 мл, розчин з молярною концентрацією еквівалентів NaCl 1 моль/л; розчин з молярною концентрацією еквівалентів CaCl2 0,05 моль/л. Універсальний йономір ЭВ–74 призначений для вимірювань концентрацій йонів Гідрогену (Н+) (рН) та інших йонів у водних розчинах з відповідними йонселективними електродами. Може бути застосований для вимірювання окисно-відновних потенціалів у розчинах. Діапазон вимірювання рН від –1 до 14. Межа основної похибки при вимірюванні рН складає + 0,05. Границі температурної компенсації приладу від 0 до 100 0С. Йономір складається з перетворювача і системи електродів. На передній панелі перетворювача розташовані органи оперативного управління і показувальний пристрій (рис. 23). Електродна система складається зі скляного та допоміжного хлоридсрібного електродів.
10 9 в д г 1 6 4 б а 2 5 7 8 3
Рис. 23. Універсальний йономір ЭВ–74 1 – перетворювач; 2 – показувальний пристрій: а – шкала, б – вказівна стрілка; 3 – тумблер "Сеть"; 4 – регулятор "Калибровка"; 5 – регулятор "Крутизна"; 6 – регулятор "Температура раствора"; 7 – кнопки вибору режиму роботи; 8 – кнопки вибору діапазону вимірювання ("–1 – 19"; "–1 – 4"; "4 – 9"; "9 – 14"; "14 – 19"); 9 – система електродів: в – вимірювальний електрод, г – допоміжний електрод, д – термокомпенсатор; 10 – штатив з рухомим столиком для ємності з досліджуваним розчином.
Робота з приладом: 1. Увімкнути прилад у мережу (тумблер "Включено") і прогріти протягом 15 хвилин. 2. Натиснути кнопку "tо" на передній панелі. Регулятором "Температура раствора" встановлюють температуру досліджуваного розчину по шкалі "0 – 100". 3. Натиснути кнопки "Анионы/Катионы", "рХ" і необхідного діапазону вимірювання. 4. Виконати калібрування приладу за допомогою стандартних буферних розчинів. 4.1. Занурити електроди в склянку з першим буферним розчином (0,1 моль/л розчин хлоридної кислоти) – рН 1,1. Натиснути кнопку "–1 – 4" і регулятором "Калибровка" встановити на шкалі "–1 – 4" значення 1,1. 4.2. Вимкнути режим вимірювання, натиснувши кнопку "tо". 4.3. Промити електроди в склянці з дистильованою водою, осушити фільтрувальним папером. 4.4. Занурити електроди в склянку з другим буферним розчином – рН 9,18. Натиснути кнопку "9– 14" і "рХ". Регулятором "Крутизна" встановити стрілку показувального пристрою на рН 9,18. Відлік роблять за шкалою "0 – 5", підсумовуючи її значення з цифрою "9". 4.5. Натиснути кнопку "tо". 4.6. Промити електроди в склянці з дистильованою водою, осушити фільтрувальним папером. 4.7. Операції 4.1 – 4.6 повторюють декілька разів, домагаючись стабільності показань приладу. В цьому випадку прилад готовий до вимірювань рН. 5. Провести вимірювання. Занурюють електроди у склянку з досліджуваним розчином. Натиснути кнопки "–1 – 19" і "рХ". Для точного вимірювання рН натиснути кнопку відповідного вузького діапазону і зняти показання по необхідній шкалі показувального пристрою. 6. По закінченні вимірювання натиснути кнопку "tо". Промити електроди у склянці з дистильованою водою, осушити фільтрувальним папером. Прилад готовий до наступного вимірювання. 7. По закінченні роботи вимкнути тумблер "Сеть". Електроди занурити у склянку з дистильованою водою. Методика виконання роботи 1. Включити прилад у мережу і прогріти його протягом 20 хвилин. Щоб уникнути сильного кидка стрілки прилад включати тільки при натиснутих кнопках "t° " і "-1-19". 2. У мірній колбі об’ємом 100 мл із розчину з молярною концентрацією еквівалентів NaCl 1 моль/л готують розчин з молярною концентрацією еквівалентів NaCl 0,01 моль/л, додаючи розчин з молярною концентрацією еквівалентів CaCl2 0,05 моль/л. Скляні електроди взагалі, і з натрієвою функцією зокрема, чутливі до інших йонів, у тому числі і до Са2+. Калібрування і усі виміри проводять на фоні надлишку йонів Са2+, щоб виключити їх вплив на результати виміру концентрації йонів Na+. 3. Роблять калібрування приладу. Для цього наливають у стаканчик розчином з молярною концентрацією еквівалентів NaCl 1 моль/л на фоні CaCl2 і занурюють у нього електроди і термометр. Натискають кнопку "-1-4" і ручкою "Температура раствора" по верхній шкалі "0-100" (°С) установлюють температуру досліджуваного розчину. Натискають кнопки "рХ" і "Анионы/Катионы" і через 2-3 хвилини ручкою "Калибровка" установлюють стрілку на "0" по шкалі "-1-4". Промивають електроди розчином з молярною концентрацією еквівалентів NaCl 0,01 моль/л, потім наливають у стаканчик свіжу порцію розчину і занурюють у нього електроди. Через 2-3 хвилини ручкою "Крутизна" встановлюють стрілку на "2" по шкалі "-1-4". 4. Для випробування методики готують розчини NaCl на фоні CaCl2 із молярними концентраціями еквівалентів 0,02; 0,03; 0,04; 0,05 моль/л, вимірюють їх рNa і розраховують концентрацію. Отримані значення порівнюють із дійсними концентраціями. Досліди по визначенню концентрації натрій-йонів повторюють 2-3 рази. Розраховують відносну похибку визначення. Знаходять концентрації контрольних розчинів, виданих викладачем. Дані заносять у таблицю 24, складену по такому зразку.
Таблиця 24
Після закінчення роботи електроди занурюють у розчин з молярною концентрацією еквівалентів NaCl 1 моль/л, натискають кнопки "t°" і "- 1 - 19" і вимикають прилад.
Питання та вправи для самоконтролю 1. Які електроди називають електродами порівняння і індикаторними електродами? Поясніть будову каломельного та хлоридсрібного електродів. 2. Яку величину називають стандартним (нормальним) окисно-відновним потенціалом? 3. Який принцип лежить в основі потенціометричного метода аналізу? 4. Які види потенціометрії використовуються в аналізі і на чому вони основані? 5. Які індикаторні електроди застосовують в потенціометричному кислотно-основному, окисно-відновному титруванні? 6. Поясніть, чому при вимірюванні концентрації натрій-йонів розчини готують на фоні надлишку йонів кальцію. 7. Обчисліть потенціал кадмієвого електроду у розчині з молярною концентрацією еквівалентів кадмій нітрату 0,05 моль/л відносно стандартного водневого електроду при 25 оС. (відповідь: 0,447 В). 8. Обчисліть концентрацію йонов Аргентума над осадом при 20 оC, якщо потенціал срібного електроду, який занурений у розчин, дорівнює 0,418 В по відношенню до стандартного водневого електроду. (відповідь: 2,63 · 10–7 моль/л). Кулонометричне титрування Кулонометрія об'єднує методи аналізу, засновані на вимірюванні кількості електрики, витраченої в ході електродної реакції. Остання призводить до кількісного окиснення або відновлення речовини, що титрується, або ж до одержання проміжного компонента, що стехіометрично реагує зі сполукою, яка визначається. Основою методу кулонометричного аналізу є закон Фарадея, що встановлює зв'язок між кількістю речовини, що виділяється на електродах у процесі реакції,
де Q – кількість електрики, що, якщо сила току не змінюються з часом, дорівнює добутку сили струму на час його проходження через провідник; F - стала Фарадея (F= 96485 Кл/моль) чисельно дорівнює кількості електриці, при проходженні якої через електроліт на електроді виділяється еквівалентна маса речовини, z - число електронів, що приймає участь в електрохімічній реакції. Необхідна умова використання тієї або іншої електрохімічної реакції в кулонометричному аналізі полягає в тому, що практично вся електрика, що витрачається, йде лише на перетворення речовини, що визначається. Показником того, наскільки ця умова виконується, є величина, яка зветься виходом за струмом. Вихід за струмом h чисельно дорівнює відношенню маси практично виділеної речовини (
де Найбільш сучасним є варіант визначення, який зветься кулонометричним титруванням. В цьому методі, відрізняючись від класичного, титрант не дозують із бюретки, а електрохімічно продуцюють з розчину. Розглянемо окисно-відновне титрування. Для визначення відновників найбільш зручним титрантом, який продуцюється на генераторному електроді, є йод. З усіх відомих систем йод-йодидна є найбільш зворотною. Йод легко з 100-відсотковим виходом продуцюється, а йодидний іон відновлюється на благородних металах (платина, золото). Тому, якщо можливо підібрати спосіб визначення точки еквівалентності, з’являється можливість заміни традиційного титрування на сучасну електрохімічну швидку та зручну техніку. Кулонометричний аналіз має ряд істотних переваг у порівнянні з іншими фізико-хімічними методами аналізу (наприклад, надійне визначення надзвичайно малих концентрацій, легкість автоматизації, можливість використання нестійких реагентів, виключення використання стандартних розчинів, дозволяє проводити титрування у забарвлених розчинах). У сучасному кулонометричному титруванні не менш важливим, ніж генерація титранта, є підбір умов, за якими легко та чітко виявляється точка еквівалентності. Ці умови зручно реалізувати для йод-йодидної системи, якщо у якості катода в індикаторній електрохімічній системі використати благородний матеріал та нав’язати йому маленький негативний потенціал. Звичайно це здійснюється за умови нав’язування електрохімічної напруги на індикаторну пару зовнішнім джерелом напруги (поляризація). Що до другого електроду індикаторної пари (аноду), для виготовлення можливо використати більшість індиферентні матеріали. Але найбільш вигідним і простим є використання для нього провідного металу, нормальний потенціал якого нижчий за нормальний потенціал катоду. У такому випадку відпадає необхідність використання зовнішнього джерела поляризації. Така система індикації має назву біамперометрична, тому що у даному випадку вимірюється струм цієї гальванічної пари. На лабораторному практикумі у чотирьохелектродній титрувальній комірці два електроди призначені для генерації титранта (генераторні електроди), а інші два – для індикації кінця титрування. Щоб запобігти використання коштовних матеріалів для виготовлення генераторних електродів застосована нержавіюча сталь, індикаторного катода – скловуглець, індикаторного анода – ніхромовий дріт. Випробовування та використання цих матеріалів впродовж 20 років проводилося на кафедрі загальної хімії ХНТУ. На рис. 24 показаний прилад для йод-йодидного кулонометричного титрування. Основні електрохімічні процеси: 1. Процес на генераторному аноді – утворення титранту: 2І– + КІ – 2 2. Процес на індикаторному катоді – індикація точки еквівалентності: КІ3 + 2 Допоміжні електрохімічні процеси: 3. Процес на генераторному катоді: 2Н+ + 2 4. Процес на індикаторному ніхромовому аноді: Ni – 2 Реакція в розчині при визначенні тіосульфатного іону: І2 + 2S2O32– = 2I– + S4O62–
Рис.24. Прилад для кулонометричного титрування: Г+ – основний генераторний електрод (нержавіюча сталь); Г– – допоміжний генераторний електрод (нержавіюча сталь); U– – основний індикаторний катод (скловуглець); U+ – допоміжний індикаторний електрод (ніхромовий дріт); мкА – мікроамперметр індикаторного ланцюга; мА – міліамперметр контролю генераторного струму; R – регулятор завдання генераторного струму. Лабораторна работа № 10
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-25; просмотров: 357; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.013 с.) |



 (моль) та кількістю витраченого при цьому електрики Q (Кл):
(моль) та кількістю витраченого при цьому електрики Q (Кл): ,
, , г) до маси, що повинна виділитися відповідно до закону Фарадея.
, г) до маси, що повинна виділитися відповідно до закону Фарадея.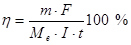
 – молярна маса еквівалентів речовини, що визначається. Ця формула є загальним виразом закону Фарадея. У кулонометричному аналізі розмір h повинен дорівнювати 1 або залишатися постійним поза залежністю від густини струму. У всіх розробках найбільша увага приділяється підбору умов, для того, щоб дотримати цих умов. Це склад електроліту, матеріали електродів, величина струму генерації та температура.
– молярна маса еквівалентів речовини, що визначається. Ця формула є загальним виразом закону Фарадея. У кулонометричному аналізі розмір h повинен дорівнювати 1 або залишатися постійним поза залежністю від густини струму. У всіх розробках найбільша увага приділяється підбору умов, для того, щоб дотримати цих умов. Це склад електроліту, матеріали електродів, величина струму генерації та температура. = КІ3
= КІ3



