
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 1. Внутрішня енергія і способи її зміниСодержание книги
Поиск на нашем сайте
Термодинаміка (ТД) вивчає теплові явища і процеси, не враховуючи молекулярну будову речовини.
1. Внутрішня (теплова) енергія U – це основне поняття ТД. Внутрішня енергія як фізична величина є кількісною мірою теплового руху частинок ТДС (речовини) і зумовлена її мікростанами. Тобто U характеризує ТДСт тіл (і їх систем) у даний момент часу і визначається швидкостями і взаємодією їхніх молекул, а отже, і сумою кінетичної енергії теплового руху частинок та потенціальної енергії їх взаємодії:
Оскільки Т і V є основними параметрами ТДСт системи, то можна сказати, що внутрішня енергія є функцією стану ТДС. [U] = Дж.
2. Внутрішня енергія ідеального газу · U одноатомного ІГ Молекули одноатомного газу рухаються тільки поступально:
Виходячи з рівняння Менделєєва
· U багатоатомного ІГ Молекули багатоатомних газів перебувають не лише у стані поступального руху, а й обертального, тому коефіцієнти пропорційності між U і Т інші: · U 2-атомного газу
· U газу, молекули якого складаються з трьох і більше атомів
З формул (64) – (67) Слід зазначити, що формули (66) і (67) для реальних газів не виконуються при високих температурах, оскільки при цьому в молекулах виникають ще коливання атомів, що веде до збільшення внутрішньої енергії газу. Фізичний зміст має не сама внутрішня енергія ТДС, а зміна внутрішньої енергії в ході того чи іншого теплового процесу, що відбувається з даною ТДС.
3. Способи зміни внутрішньої енергії ТДС
І. Тепловий – пов’язаний із зміною Т – теплопередача: ΔТ → Q. ІІ.Механічний – пов’язаний із зміною V – виконання роботи: ΔV → А. Зміну внутрішньої енергії 1-атомного ідеального газу можна визначити так
Аналогічно визначається зміна внутрішньої енергії багатоатомних газів.
Види теплопередачі 1) Теплопровідність – передача енергії від більш нагрітих тіл (або їх частин) до менш нагрітих, яка обумовлена безпосередньою взаємодією частинок тіл і веде до вирівнювання температури тіл (або їх частин) без перенесення речовини; властива тілам в усіх АСР, найкраща у твердих тіл, найгірша – в газах. Пояснення: молекули з різними швидкостями та енергією зіштовхуються Приклад: нагрівання металевих стержнів, нагрівання рук теплою водою. 2) Конвекція – передача енергії від більш нагрітих шарів рідини або газу до менш нагрітих; супроводжується перенесенням речовини. Пояснення: підвищення Т призводить до розширення газу (або рідини), що веде до зменшення його густини, а отже, і руху шару газу (або рідини) вгору внаслідок зменшення сили тяжіння, що на нього діє Приклад: нагрівання води у чайнику, нагрівання повітря у кімнаті. 3) Теплове випромінювання – передача енергії завдяки електромагнітним хвилям (інфрачервоне випромінювання, довгохвильове); здійснюється будь-якими ТДС (в т.ч. і вакуумом). Приклад: нагрівання повітря сонячним промінням. Теплову енергію випромінюють і поглинають всі тіла, оскільки всі вони мають внутрішню енергію. Випромінювання і поглинання теплової енергії залежить від стану і кольору поверхні тіла (шорсткі, темні краще поглинають енергію, ніж гладкі і блискучі). Результат теплообміну – тепловий процес: 1) зміна температури ТДС – 2) зміна агрегатного стану речовини: пароутворення: рідина → тверде тіло (ΔТ > 0); плавлення: тверде тіло → рідина ΔТ > 0; конденсація: рідина → пара (ΔТ < 0).
2. Кількість теплоти Q – частина внутрішньої енергії, поглинутої або переданої ТДС при теплопередачі. [Q] = Дж. Якщо ТДС поглинає (отримує) енергію, то Q > 0 (при плавленні, пароутворенні). Якщо ТДС виділяє (віддає) енергію, то Q < 0 (при конденсації, кристалізації). 3. Теплоізольована система (ТІС) – ТДС, яка не обмінюється внутрішньою енергією з іншими ТДС або навколишнім середовищем.
4. Закон збереження і перетворення енергії при теплопередачі для ТІС – рівняння теплового балансу:
5. Теплові процеси (ТП) і розрахункові формули теплоти, що їх описують
|
|||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 264; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.009 с.) |

 , (64)
, (64)

 .
. ,
, 


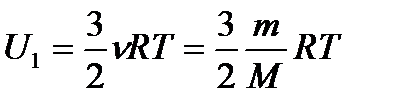 (65)
(65) , матимемо
, матимемо
 (66)
(66) (67)
(67)

 (68)
(68) Рис. 34
Рис. 34
 відбивається обмін енергією між „швидкими” і „повільними” молекулами, що і веде до вирівнювання температури тіл, які стикаються.
відбивається обмін енергією між „швидкими” і „повільними” молекулами, що і веде до вирівнювання температури тіл, які стикаються.
 (69)
(69)
 *
* 
 ,
Дж/К
,
Дж/К
 ,
Дж/кг·К
*
,
Дж/кг·К
*  ,
Дж/моль·К
,
Дж/моль·К

 ,
Дж/кг
,
Дж/кг

 ,
Дж/кг
,
Дж/кг

 ,
Дж/кг
,
Дж/кг



