
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Статистичний розподіл Максвелла
Значення розподілу Максвелла для МКТ газів – це перший приклад статистичного закону у науці; Дж. Максвелл усвідомив, що випадковий рух окремих молекул підпорядкований певному статистичному закону. Висновки з розподілу Максвелла: 1. Крива розподілу Максвелла проходить через початок координат 2. Крива має максимум, після якого асимптотично наближається до осі абсцис 3. Крива розподілу швидкостей не є симетрична – в один бік спад кривої крутіший, ніж в інший. 4. При збільшенні температури крива зміщується вправо 5. Максимум кривої вказує на існування певної швидкості руху молекул Дослід Штерна Вивчення дифузії і броунівського руху дає змогу дістати деяке уявлення про швидкість хаотичного руху молекул газу. Одним з найпростіших наочних дослідів для її визначення є дослід Штерна (1920 р.).
На горизонтальному столі розміщено жорстко зв’язані між собою циліндри А (з вузькою щілиною О вздовж твірної) і В (суцільний) різних діаметрів (рис. 6), вздовж спільної осі яких натягнуто платинова посріблена дротина радіусом r; повітря з циліндрів відкачано до високого вакууму (10-8 Па). По дротині пропускають струм
Розрахунок швидкості молекул:
Висновки з досліду Штерна: 1. Наліт молекул на поверхні циліндру у місці 2 розмивається 2. При збільшенні сили струму в дротині зростає її температура 3. Вигляд нальоту молекул на поверхні циліндру є точною копією теоретичної кривої Максвелла Значення
4. Довжина вільного пробігу λ – відстань, яку проходить молекула між двома послідовними зіткненнями. Середня довжина вільного пробігу
де
* 1. Вивід основного рівняння МКТ ідеального газу (на основі законів механіки)
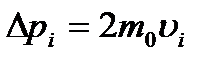 ( ( – швидкість і-тої молекули). Відповідно до ІІ закону Ньютона, середня сила дії молекули на стінку – швидкість і-тої молекули). Відповідно до ІІ закону Ньютона, середня сила дії молекули на стінку  , де , де 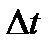 – час руху молекули від однієї стінки до другої і назад, тобто – час руху молекули від однієї стінки до другої і назад, тобто 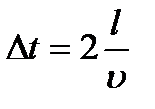 , оскільки молекула наносить стінці удари з таким проміжком часу. Отже, , оскільки молекула наносить стінці удари з таким проміжком часу. Отже,  . Сила тиску на стінку посудини = силі ударів окремих молекул об цю стінку: . Сила тиску на стінку посудини = силі ударів окремих молекул об цю стінку:
Внаслідок повної хаотичності руху молекул для кожної з них всі напрями руху рівноймовірні. Тому можна вважати, що вздовж кожного з трьох взаємно перпендикулярних напрямів рухається 1/3 загального числа молекул
Оскільки Оскільки
Наслідки ОР МКТ ІГ
*3. Вивід наслідків основного рівняння МКТ ідеального газу 1. 2. 3. ↓
5. Рівняння стану ідеального газу (РС ІГ) – пов’язує основні ТД параметри ІГ. Експериментально встановили незалежно один від одного Клапейрон і Менделєєв.
6. Ізопроцеси (ІП) – це ТДП, які відбуваються при незмінній масі ( Газові закони (ГЗ) – функціональні залежності між змінними ТДПр, які описують ізопроцеси.
|
||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 101; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.21.97.61 (0.009 с.) |
 Рис. 5
Рис. 5
 немає молекул, які б не рухались.
немає молекул, які б не рухались. дуже великі швидкості мало імовірні. Вони можливі тільки за умови, що молекула при багатьох зіткненнях з іншими молекулами діставатиме енергію, а не віддаватиме її, що малоймовірно.
дуже великі швидкості мало імовірні. Вони можливі тільки за умови, що молекула при багатьох зіткненнях з іншими молекулами діставатиме енергію, а не віддаватиме її, що малоймовірно. , поблизу якої на даний інтервал швидкостей
, поблизу якої на даний інтервал швидкостей  припадає більша кількість молекул, ніж поблизу будь-якої іншої швидкості. Ця швидкість
припадає більша кількість молекул, ніж поблизу будь-якої іншої швидкості. Ця швидкість  називається найімовірнішою швидкістю:
називається найімовірнішою швидкістю: 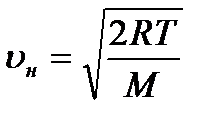 .
. Рис. 6
Рис. 6
 вона нагрівається
вона нагрівається  з її поверхні випаровуються молекули срібла, які осідають в основному на внутрішніх стінках циліндра А. Невелика їх кількість вилітає через щілину і осідає на поверхні циліндру В вузькою смужкою 1, утворюючи зображення щілини. При обертанні циліндрів навколо осі О з постійною швидкістю ω за час t, протягом якого молекули пролітають відстань R – r від щілини до циліндра В, він встигає повернутись на кут φ = ωt
з її поверхні випаровуються молекули срібла, які осідають в основному на внутрішніх стінках циліндра А. Невелика їх кількість вилітає через щілину і осідає на поверхні циліндру В вузькою смужкою 1, утворюючи зображення щілини. При обертанні циліндрів навколо осі О з постійною швидкістю ω за час t, протягом якого молекули пролітають відстань R – r від щілини до циліндра В, він встигає повернутись на кут φ = ωt  ,
, 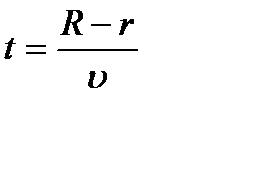




 молекул деяких газів при p0 і T0
молекул деяких газів при p0 і T0
 , (17)
, (17) – середнє число зіткнень молекули газу за 1 с, тоді сума в чисельнику цієї формули визначає шлях, пройдений молекулою за 1 с, тобто середню швидкість руху молекули. Отже,
– середнє число зіткнень молекули газу за 1 с, тоді сума в чисельнику цієї формули визначає шлях, пройдений молекулою за 1 с, тобто середню швидкість руху молекули. Отже,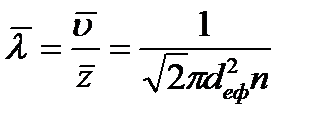 (18)
(18) і
і  )
)


 де
де  – загальна кількість молекул, які літають між двома протилежними стінками куба.
– загальна кількість молекул, які літають між двома протилежними стінками куба. для обчислення тиску можна вважати, що між двома протилежними стінками куба вздовж перпендикуляра до них рухається 1/3 загального числа молекул, тобто
для обчислення тиску можна вважати, що між двома протилежними стінками куба вздовж перпендикуляра до них рухається 1/3 загального числа молекул, тобто 

 .
.









 ↑ ↑
↑ ↑
 :
:  Для двох станів газу:
Для двох станів газу: 



 ) і одному сталому ТДПр.
) і одному сталому ТДПр.


