
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Види термодинамічних процесів
Незамкнений (відкритий) процес – це ТДП, у якого початковий і кінцевий стани не співпадають (рис. 8, а). Круговий (або: коловий; або: замкнений) процес – це ТДП, який починається і закінчується в одному стані, пройшовши низку проміжних станів (рис. 8, б, в). рр р 12 2 2 3 3 1 3 0 V 0 V 0 V а) б) в)
Рис. 8 Приклади розв’язування задач
1. Середня квадратична швидкість молекул азоту у 14 раз менша, ніж у молекул водню. Порівняти температури цих газів.
2. Визначити кількість молекул газу, що міститься у балоні об’ємом 2 л при температурі 27 ˚С, якщо його тиск 200 кПа.
3. Визначити густину кисню, який міститься в балоні об’ємом 10 л під тиском 105 Па та має температуру 17 ˚С.
4. Манометр на балоні із стиснутим газом при температурі 30 0С показав тиск 1,6 МПа, а під час зниження температури до 20 0С – тиск 1,3 МПа. Чи витікав при цих умовах газ з балона?
Газ з балона витікав, оскільки закон Шарля не виконується. Методика розв’язування графічних задач на ізопроцеси Щоб побудувати графік даного процесу в координатах, одна з яких не задана явно, необхідно: 1. Встановити, який з ТДПр у задачі задано неявно (тобто не фігурує на графіку). 2. Нанести параметри кожного стану процесу на осі координат. 3. Проаналізувати кожну ланку процесу за схемою: 1) який це ІП, який ТДПр залишається сталим при цьому ІП; 2) яке співвідношення між змінними параметрами; 3) виходячи з 2), встановити співвідношення між неявно заданими параметрами для двох послідовних станів цього ІП; 4. Встановити співвідношення між неявно заданими параметрами для всіх станів даного процесу і побудувати для них вісь координат. 5. Побудувати графік даного процесу в заданих координатах. Приклад розв’язування задачі
Дано графік ТДП в координатах рТ. Зобразити графік цього процесу у координатах рV і VТ. Розв’язання 1. У даній задачі неявно заданий об’єм, оскільки він не фігурує на графіку. 2. р 3. Аналізуємо кожну ланку процесу р2 2 1 → 2: ізохорний процес, V1 = V2; 2 → 3: ізотермічний процес, Т2 = Т3;
р1= р3 1 3 3 → 1: ізобарний процес, р3 = р1;
0 Т1Т2 = Т3 Т 4. Отже, співвідношення між об’ємами в даному процесі:
і отримуємо вісь для об’єму V1 = V2 V3 V
5. Будуємо графіки згідно аналізу задачі V p V3 3 р2 2
V1=V2 1 2 р1= р3 1 3
0 Т1 Т2 = Т3 Т 0 V1=V2 V3 V
Завдання. Побудувати графіки даних ТДП в координатах, одна з яких задана неявно. V р р 1 2 3 2 1
3 2 1 3
Т Т V
Питання для самоперевірки 1. Який газ називають ідеальним, які його властивості? 2. Назвати основні макропараметри газу. 3. Чим вимірюється тиск7 4. Пояснити фізичний зміст абсолютного нуля. 5. Які шкали є для вимірювання температури? 6. Яка і від чого залежить швидкість молекул ідеального газу? 7. * Пояснити розподіл Максвелла і висновки з нього. 8. * Пояснити дослід Штерна і висновки з нього. 9. Основне рівняння МКТ ідеального газу. 10.Які основні наслідки основного рівняння МКТ ідеального газу? 11.* Вивести основні наслідки основного рівняння МКТ ідеального газу 12. Рівняння стану у вигляді Мендєлєєва і Клапейрона. 13. Які процеси називають ізопроцесами. 14. Описати ізопроцеси. Тема 3. Властивості пари 1. Пароутворення – процес переходу рідин у газоподібний стан – пару. Види пароутворення: випаровування і кипіння 2. Випаровування – пароутворення, яке відбувається з вільної поверхні рідини. Властивості випаровування 1. Відбувається при будь-якій температурі. 2. Внаслідок вилітання найшвидших молекул рідина охолоджується (бо зменшується її внутрішня енергія), а пара нагрівається (внутрішня енергія пари збільшується). 3. Існує зворотний процес – конденсація – перехід речовини з газового стану у рідкий. 4. Процеси випаровування і конденсації відбуваються одночасно. При переважанні процесу випаровування над конденсацією рідина охолоджується, а пара нагрівається, при переважанні конденсації над випаровуванням – навпаки: рідина нагрівається, а пара охолоджується.
5. У відкритій посудині випаровування рідини відбувається доти, поки вся вона не перетвориться на пару. 6. Швидкість випаровування залежить від: 1. роду речовини; 2. температури речовини; 3. площі вільної поверхні рідини; 4. зовнішнього тиску і тиску пари над рідиною; 5. наявності вітру (швидкості віднесення утвореної пари).
|
||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 108; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.14.150.55 (0.011 с.) |
 Ма = 0,028 кг/моль
Мв = 0,002 кг/моль
Ма = 0,028 кг/моль
Мв = 0,002 кг/моль



 Тв в 14 разів більша за Та
Тв в 14 разів більша за Та

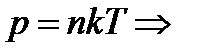






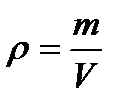

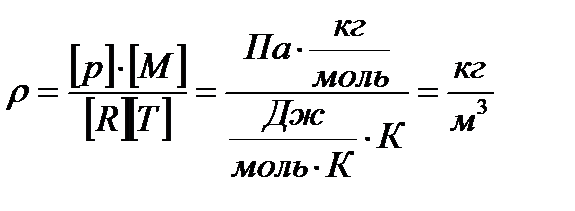


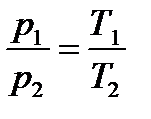 ,якщо витікав, – то цей закон не виконується.
,якщо витікав, – то цей закон не виконується.
 ;
; 


 р3 < р2
р3 < р2 



