
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Частина І. Основи молекулярно-кінетичної теоріїСодержание книги
Поиск на нашем сайте
Свириденко О.Ф Конспект лекцій з фізики
Модуль № 2 молекулярна фізика і термодинаміка
Даний навчально-методичний посібник містить теоретичний матеріал (повний конспект лекцій) по модулю № 2 «Молекулярна фізика і термодинаміка», приклади розв’язування задач та питання для самоперевірки, що дозволить студентам успішно підготуватись до заліку по даному модулю. Даний посібник призначений для студентів І курсу ХАПК ПДАА, а також може бути використаний студентами і викладачами інших навчальних закладів, в яких вивчається курс фізики. Основи молекулярної фізики 1. Предмет і задачі молекулярної фізики Молекулярна фізика (МФ) – розділ фізики, який вивчає теплові явища і процеси, які пов’язані з передаванням і перетворенням енергії.
2. МФ за методами (способами) дослідження поділяється на такі розділи: · Молекулярно-кінетична теорія (МКТ) – пояснює теплові явища і процеси особливостями руху і взаємодії структурних частинок речовини (атомів, молекул, іонів). · Термодинаміка (ТД) – пояснює природу теплових явищ і процесів, не враховуючи молекулярної будови речовини. 3. Основні поняття МФ 1. Тепловий рух – безперервний хаотичний рух структурних частинок речовини, який залежить від температури. 2. Макросистема – тіло або система тіл, які складаються з величезної кількості частинок; може перебувати в твердому, рідкому або газоподібному стані. 3. Мікросистема – одна структурна частинка системи (молекула, атом, іон); для такої системи немає поняття агрегатного стану. 4. Термодинамічна система (ТДС) – будь-яка макросистема, частинки якої перебувають у тепловому русі і взаємодіють між собою, обмінюючись енергією. 5. Термодинамічні параметри речовини (ТДПР) – фізичні величини, які характеризують теплові властивості речовини. 6. Макропараметри – ТДПр, які описують систему частинок в цілому (т, ρ, p,V, T). 7. Мікропараметри – ТДПр, що характеризують одну структурну частинку речовини ( 8. Термодинамічний стан (ТДС т ) речовини – задається макропараметрами; якщо всі вони не змінюються без дії яких-небудь зовнішніх факторів, то такий ТДС т називають рівноважним. 9. Термодинамічна рівновага (ТДР) – ТД стан ТДС, при якому її параметри не змінюються як завгодно довго. 10. Термодинамічний процес (ТДП) – явище переходу речовини з одного ТДС т в інший, зумовлене зміною його хоча б одного ТДПР. Процес, який складається з ланцюга нескінченно близьких рівноважних станів, називається рівноважним. Макропараметри ТДС речовини 1) Об’єм V визначається розмірами ТДС. [V] = м3. 1 м3 = 103 л = 103 дм3 = 106 см3 = 109 мм3; 1 л = 10-3 м3; 1 см3 = 10-6 м3; 1мм3 = 10-9 м3.
2) Тиск р. [р] = Па. 1 атм = 1,013∙105 Па = 760 мм.рт.ст.; 1 Па ≈ 133 мм.рт.ст.; 1ат = 9,8∙104 Па.
Питання для самоперевірки 1. Які явища називають тепловими? 2. Який рух називають тепловим? Чим він відрізняється від механічного руху? 3. Які об’єкти називають мікросистемами? макросистемами? 4. Який рух називають броунівським? Навести приклади. 5. Пояснити фізичний зміст дифузії? 6. Від чого і як залежить швидкість дифузії? 7. Дослід Штерна. 8. Які параметри відповідають нормальним умовам? 9. Пояснити фізичний зміст: 1. числа Авогадро; 2. числа Лошмідта; 3. температури; 4. абсолютної температури; 5. концентрації; 6. густини; 7. кількості речовини; 8. атомної маси; 9. молекулярної маси; 10. молярної маси; 11. тиску; 12. молярного об’єму. Мікропараметри газу Дослід Штерна Вивчення дифузії і броунівського руху дає змогу дістати деяке уявлення про швидкість хаотичного руху молекул газу. Одним з найпростіших наочних дослідів для її визначення є дослід Штерна (1920 р.).
На горизонтальному столі розміщено жорстко зв’язані між собою циліндри А (з вузькою щілиною О вздовж твірної) і В (суцільний) різних діаметрів (рис. 6), вздовж спільної осі яких натягнуто платинова посріблена дротина радіусом r; повітря з циліндрів відкачано до високого вакууму (10-8 Па). По дротині пропускають струм Розрахунок швидкості молекул:
Висновки з досліду Штерна: 1. Наліт молекул на поверхні циліндру у місці 2 розмивається 2. При збільшенні сили струму в дротині зростає її температура 3. Вигляд нальоту молекул на поверхні циліндру є точною копією теоретичної кривої Максвелла Значення
4. Довжина вільного пробігу λ – відстань, яку проходить молекула між двома послідовними зіткненнями. Середня довжина вільного пробігу
де
* 1. Вивід основного рівняння МКТ ідеального газу (на основі законів механіки)
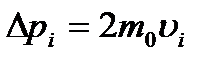 ( ( – швидкість і-тої молекули). Відповідно до ІІ закону Ньютона, середня сила дії молекули на стінку – швидкість і-тої молекули). Відповідно до ІІ закону Ньютона, середня сила дії молекули на стінку  , де , де 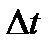 – час руху молекули від однієї стінки до другої і назад, тобто – час руху молекули від однієї стінки до другої і назад, тобто 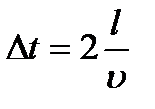 , оскільки молекула наносить стінці удари з таким проміжком часу. Отже, , оскільки молекула наносить стінці удари з таким проміжком часу. Отже,  . Сила тиску на стінку посудини = силі ударів окремих молекул об цю стінку: . Сила тиску на стінку посудини = силі ударів окремих молекул об цю стінку:
Внаслідок повної хаотичності руху молекул для кожної з них всі напрями руху рівноймовірні. Тому можна вважати, що вздовж кожного з трьох взаємно перпендикулярних напрямів рухається 1/3 загального числа молекул
Оскільки Оскільки
Наслідки ОР МКТ ІГ
*3. Вивід наслідків основного рівняння МКТ ідеального газу 1. 2. 3. ↓
5. Рівняння стану ідеального газу (РС ІГ) – пов’язує основні ТД параметри ІГ. Експериментально встановили незалежно один від одного Клапейрон і Менделєєв.
6. Ізопроцеси (ІП) – це ТДП, які відбуваються при незмінній масі ( Газові закони (ГЗ) – функціональні залежності між змінними ТДПр, які описують ізопроцеси.
Питання для самоперевірки 1. Який газ називають ідеальним, які його властивості? 2. Назвати основні макропараметри газу. 3. Чим вимірюється тиск7 4. Пояснити фізичний зміст абсолютного нуля. 5. Які шкали є для вимірювання температури? 6. Яка і від чого залежить швидкість молекул ідеального газу? 7. * Пояснити розподіл Максвелла і висновки з нього. 8. * Пояснити дослід Штерна і висновки з нього. 9. Основне рівняння МКТ ідеального газу. 10.Які основні наслідки основного рівняння МКТ ідеального газу? 11.* Вивести основні наслідки основного рівняння МКТ ідеального газу 12. Рівняння стану у вигляді Мендєлєєва і Клапейрона. 13. Які процеси називають ізопроцесами. 14. Описати ізопроцеси. Тема 3. Властивості пари 1. Пароутворення – процес переходу рідин у газоподібний стан – пару. Види пароутворення: випаровування і кипіння 2. Випаровування – пароутворення, яке відбувається з вільної поверхні рідини. Властивості випаровування 1. Відбувається при будь-якій температурі. 2. Внаслідок вилітання найшвидших молекул рідина охолоджується (бо зменшується її внутрішня енергія), а пара нагрівається (внутрішня енергія пари збільшується). 3. Існує зворотний процес – конденсація – перехід речовини з газового стану у рідкий. 4. Процеси випаровування і конденсації відбуваються одночасно. При переважанні процесу випаровування над конденсацією рідина охолоджується, а пара нагрівається, при переважанні конденсації над випаровуванням – навпаки: рідина нагрівається, а пара охолоджується. 5. У відкритій посудині випаровування рідини відбувається доти, поки вся вона не перетвориться на пару. 6. Швидкість випаровування залежить від: 1. роду речовини; 2. температури речовини; 3. площі вільної поверхні рідини; 4. зовнішнього тиску і тиску пари над рідиною; 5. наявності вітру (швидкості віднесення утвореної пари). Властивості насиченої пари 1. Тиск насиченої пари залежить від її виду (р = f (ρ)) і може бути визначений із рівняння стану
2. Згідно формули p = nkT тиск пари зростає не тільки внаслідок підвищення температури, а й внаслідок збільшення концентрації. 3. Тиск і густина насиченої пари даного виду є максимальними при даній температурі. 4. Тиск насиченої пари не залежить від її об’єму (р 5. Концентрація молекул насиченої пари у закритому об’ємі з рідиною завжди встановлюється при даній температурі одна і та сама, незалежно від об’єму, який займає пара (n 6. При ізотермічному стисканні конденсується рівно стільки насиченої пари, скільки її було у відібраному від пари об’ємі (ρн = сonst при T = const). 7. Насичену пару можна перевести у ненасичену або ізохорним нагріванням, або ізотермічним розширенням, або одночасно нагріванням і розширенням. І навпаки, ненасичену пару у насичену завжди можна перевести ізохорним охолодженням, або ізотермічним стисканням, або одночасно охолодженням і стисканням. р р,ρ р,ρ D рідина ρкр, газ ρн С В ркр ρкр, К ркр пара насичена А пара
0 V 0 Ткр Т 0 Ткр Т
Ізотермічне стискання пари: Залежність тиску Пояснення критичного АВ – газ; СD – рідина; пари від температури стану речовини ВС – насичена пара+рідина.
Рис. 10 Рис. 11 Рис. 12
4. Критичний стан речовини – такий стан речовини, в якому відсутня фізична різниця між рідиною і її парою (ρн = ρρ). Параметри, що описують цей стан, також називають критичними. Особливості параметрів критичного стану речовини: 1. Критичний тиск ркр є максимально можливим тиском насиченої пари даної речовини. 2. Критичний об’єм Vкр є найбільшим об’ємом, який може займати наявна маса речовини у рідкому стані. 3. При Т > Ткр речовина може існувати тільки у газоподібному стані. У цьому разі ніяким збільшенням тиску не можна перетворити газ на рідину. 4. При Т < Ткр стисненням газу можна викликати його конденсацію. Таким чином, визначимо два види газоподібного стану речовини: · газ – при Т > Ткр газоподібна фаза речовини, далека від насичення, у рідину її перетворити не можна. => · пара – при Т < Ткр стисненням перетворюється у рідину. ρг < ρп (п г < пп). 5. Кипіння – пароутворення, яке відбувається в об’ємі всієї рідини при сталій температурі tк, яка називається температурою кипіння. Доки не википить вся рідина, ця температура не зміниться. Пояснення процесу кипіння
2. Умова кипіння: рнас ≥ рзовн.+ ρgh (27) або (у побуті): рнас ≥ рзовн (28) Тиск насиченої пари і температура кипіння залежать від зовнішнього тиску: чим більший рзовн., тим вища tк . 3. Застосування кипіння: 1. Кипіння при високих температурах: автоклави в медицині, харчовій промисловості, хімії, будівельній індустрії; парові двигуни. 2. Кипіння при низьких температурах: цукрова промисловість (сушарні); у горах частіше смажать, ніж варять. 6. Теплота пароутворення Qп – кількість теплоти, необхідна для перетворення рідини на пару при сталій температурі Qп = rm, (29)
 (30) (30)
– питома теплота пароутворення – кількість теплоти, необхідна для перетворення 1 кг рідини на пару при температурі кипіння; залежить від роду речовини і температури (рис. 14). [r] = Дж/кг Якщо зовнішні умови однакові, то при рівних масах однакової речовини теплота пароутворення дорівнює теплоті конденсації.
7. Вологість повітря – вміст водяної пари у повітрі.
1. Параметри вологості: 1. Абсолютна вологістьρа – густина, тобто маса водяної пари, що міститься за даної температури, в 1м3 повітря 2. Парціальний тиск ра – тиск, який чинила б водяна пара, коли б не було інших газів
Але за абсолютною вологістю ρа (чи парціальним тиском ра) ще не можна встановити, наскільки повітря сухе чи вологе, бо дана кількість водяної пари може виявитися близькою до насичення (при низьких температурах) і далекою (при високих температурах). Відносна вологість Сукупність вологості, тобто характеристику наближення стану пари у повітрі до стадії насичення (при насиченні припиняється випаровування води) показує відносна вологість. Відносною вологістю повітря φ називають величину, яка вимірюється відношенням абсолютної вологості до кількості пари, необхідної для насичення 1 м3 повітря при тій самій температурі. (виражають у %)
Оскільки р ~ ρ, то відносною вологістю повітря називають виражене в % відношення парціального тиску ра водяної пари, яка є в повітрі при даній температурі, до тиску насиченої пари рн при тій самій температурі
Якщо кількість молекул пари у повітрі не змінюється, то при його нагріванні відносна вологість зменшуватиметься, а при охолодженні зростатиме, доки не досягне значення 100%. 4.
Справді, якщо пару охолоджувати від t1 (стан А) до t р при сталому тиску, то вона стане насиченою (стан В). За таблицею залежності тиску насиченої пари від температури можна визначити р р (при t р), р н (при t 1), а отже і φ.
Вимірювання вологості Виміряти абсолютну вологість, пропустивши пару через певну речовину, що її поглинає, – складно, тому вимірюють, відносну вологість гігрометрами та психрометрами. 1. У волосяному гігрометрі використовується властивість знежиреної людської волосини збільшувати довжину зі збільшенням вологості повітря. Волосина закріплена на стояку і нижнім кінцем закріплена з механізмом стрілки, яка показує на градуйованій шкалі φ. 2. Конденсаційний гігрометр, який складається з металевого резервуара Р з відполірованою передньою стінкою С і термометра Т, дає змогу виміряти точку роси, а за нею – відносну вологість. У резервуар наливають невелику кількість ефіру, через який за допомогою груші Г продувають повітря. При випаровуванні ефіру температура знижується до точки роси, і на стінці з’являється роса внаслідок конденсації пари, що є у повітрі.
3. Психрометр складається із сухого та вологого термометрів (який опущено у резервуар з водою). Температура вологого термометра t в нижча, ніж сухого t с, внаслідок його охолодження під час випаровування. Знаючи різницю температур за допомогою спеціальних таблиць визначають відноснувологість. Значення вологості для життя людини і її навколишнього середовища (здоров’я, природи, побуту, техніки) дуже велике.
Питання для самоперевірки 1. Дати визначення пари, процесів пароутворення, конденсації, випаровування, кипіння, динамічної рівноваги, насиченої, ненасиченої, перенасиченої пари, критичного стану. 2. У чому полягає відмінність між парою і газом? 3. При яких умовах пара може стати (бути) насиченою? 4. Чому тиск насиченої пари зростає при нагріванні швидше, ніж тиск газу? 5. Які властивості випаровування і конденсації. 6. Від чого залежить швидкість випаровування? 7. Коли тиск пари максимальний? 8. Якими законами описуються властивості ненасиченої пари? 9. Пояснити графік залежності тиску і густини насиченої пари від температури; 10. Яким чином можна перетворити насичену пару у ненасичену (і навпаки)? 11. Який стан речовини називають критичним? 12. Які особливості макропараметрів критичного стану речовини. 13. Як визначити теплоту пароутворення (конденсації). 14. Від чого і як залежить питома теплота пароутворення? 15. Яке найменше значення питомої теплоти пароутворення для будь-якої речовини? Чому? 16. Чи можна перетворити у рідину пару азоту, води, гелію, кисню, спирту при температурі 200С? 17. Назвати ознаки і умови кипіння. 18. Як залежить температура кипіння від зовнішнього тиску? 19. Чим відрізняються процеси випаровування і кипіння? 20. Сформулювати визначення вологості, абсолютної і відносної вологості, точки роси. 21. Назвати прилади для вимірювання відносної вологості, пояснити принцип їх будови і дії: 22. Як змінюється вологість тієї самої маси повітря при зниженні (підвищенні) температури? 23. Як змінюється вологість повітря у приміщенні, якщо різниця показів термометрів психрометрів зменшується (збільшується)? 24. Чим пояснюється утворення туману? 25. Чому необхідно підтримувати певний рівень відносної вологості у бібліотеці, на цукровому заводі, у пекарні, в аптеці, офісі? Тема 4. Властивості рідин Поверхневий шар рідини Молекулярний тиск
 , які прагнуть втягти молекули всередину рідини, оскільки кількість молекул, що її оточують з усіх сторін неоднакова. Але простір всередині рідини зайнятий іншими молекулами, тому поверхневий шар створює тиск на рідину, який називають молекулярним тиском. , які прагнуть втягти молекули всередину рідини, оскільки кількість молекул, що її оточують з усіх сторін неоднакова. Але простір всередині рідини зайнятий іншими молекулами, тому поверхневий шар створює тиск на рідину, який називають молекулярним тиском.
На практиці виміряти цей тиск майже неможливо (при внесенні тіла у рідину виникає шар молекул рідини, в якому молекулярні сили напрямлені від тіла всередину рідини, тобто стискають рідину, а на тіло не діють). Теоретичні розрахунки показують: рм ~ 108 Па. Сили поверхневого натягу
Fн = σ l (36) де σ – коефіцієнт поверхневого натягу, l– довжина лінії, що охоплює вільну поверхню рідини по периметру. В залежності від форми тіла, поміщеного у рідину довжина лінії визначається так:
Прояви та використання 1. Змочування: к леєння, паяння, фарбування, змащування тертьових поверхонь. 2. Незмочування: · воскова поверхня на листках, фруктах, соломі запобігає гниттю; · змащення жиром пір’я водоплаваючих птахів допомагає їм утримуватись на воді; ·
5. Капілярний (лапласівський) тиск Викривлена поверхня рідини у посудині називається меніском. Оскільки площа вільної поверхні рідини більша за площу перерізу посудини, то внаслідок дії молекулярних сил вона намагається випрямитись, що зумовлює появу додаткового тиску, який називають капілярним. Сили цього тиску напрямлені вгору, якщо рідина змочуюча (рис. 23, а), і вниз, – якщо рідина незмочуюча (рис. 23, б). Величину цього тиску визначив П.Лаплас, тому його часто називають лапласівським тиском. Для сферичної форми вільної поверхні рідини з радіусом R тиск Лапласа визначається за формулою
 (40) (40)
6. Капілярні явища Викривлення поверхні у тонких трубках призводять до позірного порушення закону сполучених посудин. Тонкі трубки (d < 1мм), в яких рідина внаслідок, змочування (незмочування) піднімається (опускається) (рис. 24), називаються капілярними, а саме явище піднімання (або опускання) рідини в них – капілярністю. Це явище пояснюєтьсядією тиску Лапласа. Рідина піднімається (або опускається) у капілярі до тих пір, поки гідростатичний тиск р = ρgh стовпа рідини висотою h у капілярі радіусом r не компенсує лапласівський тиск рл:
де R = r/cosΘ – радіус меніска (рис. 25). Звідки висота піднімання рідини
Явище капілярності спостерігаються й також у вузьких щілинах, наприклад, між двома близько розміщеними пластинами, поставленими паралельно або під кутом (рис. 26). Прояви і використання капілярності: Живлення рослин; процес кровообігу тварин і людини; рух води у ґрунті; будівельна практика; використання у сушінні овочів та фруктів; у побуті (використання серветок, рушників, марлі). Питання для самоперевірки 1. Які зовнішні особливості рідкого стану речовини. 2. Назвати основні властивості рідини. 3. Що таке близький порядок у розміщенні молекул? 4. Чим пояснюється текучість рідин? 5. Чим пояснюється нестисливість рідин? 6. Який тиск називають молекулярним? Яка його величина? 7. Чим різняться стани молекул на поверхні і всередині рідини? 8. Що таке вільна енергія поверхневого шару рідини. 9. Що таке поверхневий натяг рідини? Внаслідок чого він виникає? 10. Чому вільна поверхня рідини скорочується? 11. Навести приклади існування поверхневого натягу. 12. Дати визначення змочування і незмочування, крайового кута. 13. Які умови змочування і незмочування за крайовим кутом. 14. Пояснити змочування і незмочування на молекулярному рівні. 15. Що таке меніск? Який меніск утворюється у змочуючої (незмочуючої) рідини? 16. Який тиск називається лапласівським? Від чого він залежить? 17. Що таке капіляри? 18. Як веде себе у капілярі змочуючи (незмочуюча) рідина? Чому? 19. Від чого залежить висота піднімання (опускання) рідини у капілярі? 20. Коли припиняється піднімання (опускання) рідини у капілярі? 21. Що таке сили опору середовища? Від чого вони залежать? 22. Що таке в’язкість сили внутрішнього тертя? Від чого вона залежить? 23. Яка течія називається ламінарною? 24. Як змінюється швидкість ламінарної течії у залежності від відстані до осі труби? 25. Сформулювати закон Ньютона для внутрішнього тертя. 26. Як залежить в’язкість рідин від температури? 27. З якою метою під час спорудження будівель між фундаментом і стіною прокладають шар руберойду? 28. У посудину з гарячою водою опущено капіляр. Чи змінюватиметься рівень води у трубці під час її охолодження? Чому?
Ізотропія та анізотропія Ізотропія – незалежність фізичних (механічних, електричних, оптичних) властивостей речовини від напряму у кристалі. Пов’язана з хаотичним розміщенням монокристалів у кристалі. Анізотропія – залежність фізичних властивостей речовини від напряму в кристалі. Наприклад, кристал слюди розшаровується легко тільки в одному напрямі, графіт у різних н
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 274; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.41 (0.019 с.) |


 ;
;  ).
).


 Рис. 6
Рис. 6
 вона нагрівається
вона нагрівається  з її поверхні випаровуються молекули срібла, які осідають в основному на внутрішніх стінках циліндра А. Невелика їх кількість вилітає через щілину і осідає на поверхні циліндру В вузькою смужкою 1, утворюючи зображення щілини. При обертанні циліндрів навколо осі О з постійною швидкістю ω за час t, протягом якого молекули пролітають відстань R – r від щілини до циліндра В, він встигає повернутись на кут φ = ωt
з її поверхні випаровуються молекули срібла, які осідають в основному на внутрішніх стінках циліндра А. Невелика їх кількість вилітає через щілину і осідає на поверхні циліндру В вузькою смужкою 1, утворюючи зображення щілини. При обертанні циліндрів навколо осі О з постійною швидкістю ω за час t, протягом якого молекули пролітають відстань R – r від щілини до циліндра В, він встигає повернутись на кут φ = ωt  ,
, 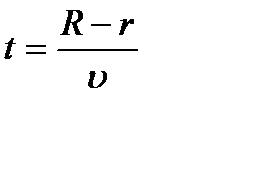




 наліт зміщується на більшу відстань
наліт зміщується на більшу відстань  молекул деяких газів при p0 і T0
молекул деяких газів при p0 і T0
 , (17)
, (17) – середнє число зіткнень молекули газу за 1 с, тоді сума в чисельнику цієї формули визначає шлях, пройдений молекулою за 1 с, тобто середню швидкість руху молекули. Отже,
– середнє число зіткнень молекули газу за 1 с, тоді сума в чисельнику цієї формули визначає шлях, пройдений молекулою за 1 с, тобто середню швидкість руху молекули. Отже,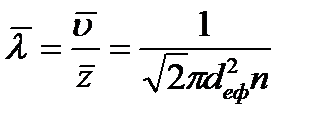 (18)
(18) і
і  )
)


 де
де  – загальна кількість молекул, які літають між двома протилежними стінками куба.
– загальна кількість молекул, які літають між двома протилежними стінками куба. для обчислення тиску можна вважати, що між двома протилежними стінками куба вздовж перпендикуляра до них рухається 1/3 загального числа молекул, тобто
для обчислення тиску можна вважати, що між двома протилежними стінками куба вздовж перпендикуляра до них рухається 1/3 загального числа молекул, тобто 

 .
.









 ↑ ↑
↑ ↑
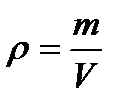
 :
:  Для двох станів газу:
Для двох станів газу: 



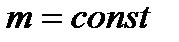 ) і одному сталому ТДПр.
) і одному сталому ТДПр.





 (26)
(26) f (V)).
f (V)). f (V) = const).
f (V) = const). Рис. 13
Рис. 13
 (31)
(31) (32)
(32) (33)
(33) (34)
(34)

 Волосяний Конденсаційний Психрометр
гігрометр гігрометр ВИТ
а б в
Рис. 16
Волосяний Конденсаційний Психрометр
гігрометр гігрометр ВИТ
а б в
Рис. 16
 Властивості поверхневого шару рідини відрізняються від властивостей інших шарів рідини, тому що молекули на поверхні рідини перебувають в інших умовах, ніж молекули всередині рідини.
Властивості поверхневого шару рідини відрізняються від властивостей інших шарів рідини, тому що молекули на поверхні рідини перебувають в інших умовах, ніж молекули всередині рідини.
 Рис. 18
Пояснення сил поверхневого натягу
Рис. 18
Пояснення сил поверхневого натягу


 Рис. 24
Рис. 24
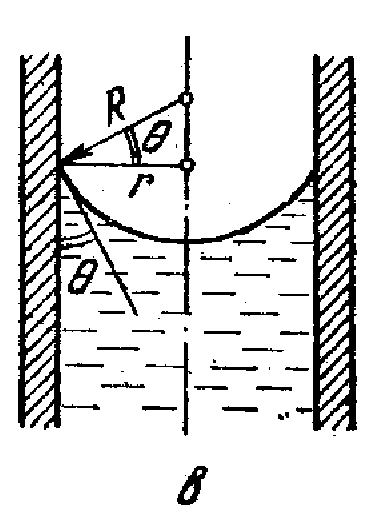 Рис. 25
Рис. 25
 Рис. 26
Рис. 26
 ,
,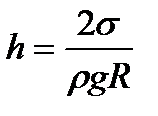 (41)
(41)


