Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основні компоненти дихального ланцюга
Мітохондрії – органели клітини, функціонування яких для будь-якої обізнаної людини чітко асоціюється з продукуван-ням енергії. Дійсно в матриксі мітохондрій локалізовані різноманітні ферменти, що необхідні для окиснення субстратів.
Крім того, внутрішня мембрана мітохондрій містить систему білків-переносників електронів, які забезпечують термінальний етап окиснення субстратів і створюють умови для синтезу АТФ. Ця система білків-переносників має декілька назв: дихальний ланцюг, електрон-транспортний ланцюг, ланцюг перенесення електронів, редокс-ланцюг (окисно-відновний ланцюг). Деякі з цих назв більш точно відображають суть процесів, які відбуваються за участі цього ланцюга, але найчастіше використовують більш просту назву – дихальний ланцюг. Частка білків дихального ланцюга істотна і становить 30-40% загального білка внутрішньої мембрани мітохондрій.
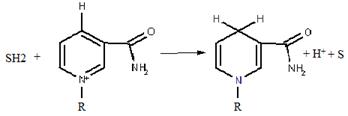
У складі дихального ланцюга знаходяться: 1) піридинзалежні дегідрогенази (містять НАД+); 2) флавінзалежні дегідрогенази (ФАД- та ФМН-вмісні); 3) цитохроми (в, с, с1, а, а3); 4) залізосірчані білки; 5) вільний кофермент – убіхінон. Піридинзалежні дегідрогенази (НАД-залежні) містять кофермент НАД+(нікотинамідаденіндинуклеотид) (рис. 5), який є похідним вітаміну РР. Ці дегідрогенази беруть участь в окисненні біосубстратів, що супроводжується відновленням НАД+ до НАДН . Н+: SH2 + НАД+ → S + НАДН . Н+.
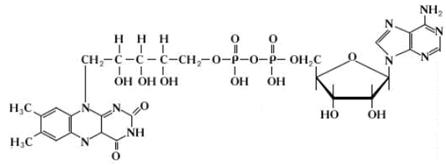
Рисунок 6 - Хімічна формула НАД+
Хімізм процесу відновлення НАД+ при окисненні субстрату показаний на рис. 6.
Рисунок 7 - Реакція відновлення НАД+ (наведений фрагмент молекули коферменту, який бере участь в окисно-відновному процесі)
Таким чином реалізується колекторна функція цього коферменту, який збирає відновні еквіваленти від субстратів окиснення для подальшої передачі їх по дихальному ланцюзі.
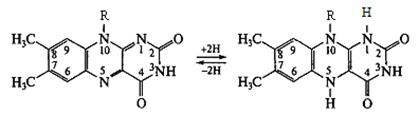
Флавінзалежні дегідрогенази – складні ферменти, які міс-тять один із двох похідних вітаміну В2 – ФАД (флавінаде-ніндинуклеотид) або ФМН (флавінмононуклеотид). Структурні формули ФАД та ФМН зображені на рис. 8.
Рисунок 8 - Структурні формули ФАД та ФМН
Саме наявність у структурі ферментів зазначених простетичних груп забезпечує окиснення субстратів під час роботи дихального ланцюга. На рис. 9 наведена схема окиснення-відновлення ізоалоксазинової групи ФАД та ФМН.
Рисунок 9 - Схема окисно-відновної реакції ізоалоксазинового кільця у складі ФАД (ФМН)
У дихальному ланцюгу мітохондрій містяться два білки-флавопротеїни: НАДН-залежна дегідрогеназа (містить ФМН) та сукцинатдегідрогеназа (містить ФАД).
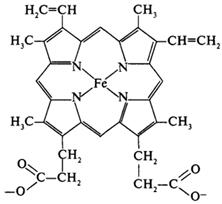
Цитохроми – складні білки, простетичною групою яких є гем. На сьогодні відомо приблизно 30 видів цитохромів. До складу гему цих білків входить метал зі змінною валентністю (переважно залізо, може бути також мідь). Цитохроми вперше були описані Мак-Манном (Шотлан-дія) у 1886 році й отримали назву «гістогематини», але їх роль залишалася невідомою. У 1925 році англійський біохімік Дейвід Кейлін почав активно вивчати ці білки. Насамперед було з’ясовано, що цитохроми знаходяться у мембранах (мітохондріальних та ЕПР) всіх еукаріотичних клітин. За типом гему виділяють 8 класів цитохромів. Залежно від спектра поглинання цитохроми поділяють на групи - а, b, с, d. Різні спектри поглинання в окисненому та відновленому станах дають змогу визначати ці білки за допомогою спектрофотометричних методів. На рис. 10 показана структура гему цитохрому b.
Рисунок 10 - Структура гему у складі цитохрому b
Деякі цитохроми позначають цифровим індексом (наприклад, b5), який може бути наданий тільки добре вивченим білкам.
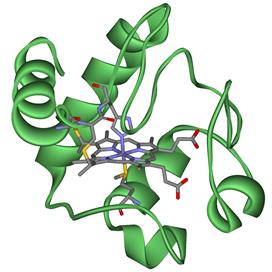
Рисунок 11 - Структура цитохрому с
У дихальному ланцюгу наявні цитохроми b, с1, с, а, а3, які, за винятком цитохрому а3, є залізовмісними білками, у складі а3 знаходиться мідь. Атом заліза у складі гемів цих цитохромів утворює зв’язки, з одного боку, від порфіринового кільця із залишком гістидину, з другого - цистеїну білкової частини. Саме тому потенційна здатність атомів заліза у складі цитохромів до зв’язування кисню пригнічена. У цитохромі с порфіринова площина, ковалентно зв’язана з білковою частиною через два залишки цистеїну (рис. 10). В цитохромах b та а гем ковалентно не зв’язаний з білком. У цитохромах аа3 замість протопорфірину міститься порфірин А, який має певні структурні особливості.
Усі цитохроми мають різні фізико-хімічні властивості та величини стандартного окисно-відновного потенціалу (редокс-потенціалу), що забезпечує напрямок руху електронів від субстратів на кисень. На рис. 10 на прикладі структури цитохрому с показаний загальний принцип будови всіх цитохромів, що беруть участь у дихальному ланцюзі.
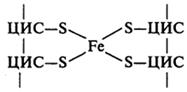
Залізосірчані білки (FeS-білки)- це білки з невеликою молекулярною масою (приблизно 10 кДа). Залізо, яке вони містять не входить до складу гему, а зв’язане з атомами сірки (рис. 12). Відомо, що вони беруть участь у транспорті електро-нів у дихальному ланцюзі, але детально механізм окиснення-відновлення атомів заліза не відомий.
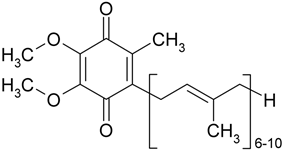
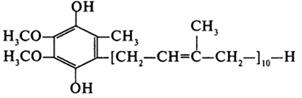
Рисунок 12 - Схема комплексу заліза і сірки в молекулі залізо-сірчаного білка дихального ланцюга Кофермент Q (убіхінон, кофермент Q10) – жиророзчинний кофермент, який знаходиться у мітохондріях еукаріотичних клітин. Ф. Крейн та К. Фолкерс у 1957-1958 встановили хімічну формулу цієї сполуки, яка наведена на рис. 12. Кількість ізопренових одиниць буває різною залежно від виду живих організмів (на рис. 12 вказана можлива кількість – 6-10). У клітинах організму людини знаходиться убіхінон тільки з 10 ізопреновими одиницями.
Рисунок 13 - Хімічна формула убіхінону В організмі людини цей кофермент синтезується з мевалонової кислоти та похідних фенілаланіну та тирозину. Вміст убіхінону в тканинах залежить від інтенсивності енергетичного обміну. Найбільша кількість коферменту Q у серцевому м’язі.
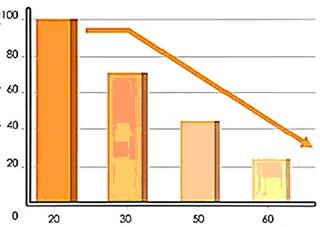
Рисунок 14 - Зміни вмісту убіхінону в організмі людини з віком
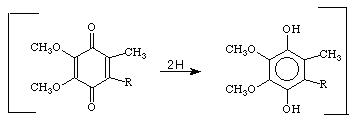
Убіхінон – це ліпофільна сполука, тому цей кофермент розчинений у ліпідній частині внутрішньої мембрани мітохондрій, і, оскільки він не зв’язаний з білком, може вільно рухатися в мембрані в різних напрямках. Цей кофермент здатний приєднувати та віддавати протони й електрони. Схема окисно-відновної реакції за участі убіхінону наведена на рис. 15.
Рисунок 15 - Реакція окиснення-відновлення убіхінону
У дихальному ланцюзі коензим Q є колектором електронів від НАД- та ФАД(ФМН)-залежних дегідрогеназ.
|
||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 278; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.139.82.23 (0.008 с.) |