Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Шляхи використання кисню в організмі
В організмі людини існує чотири типи шляхів (відповідно реакцій) використання кисню:
Оксидазний шлях Реакції цього шляху використовують 80-90% усього кисню, який споживає організм. Усі процеси, описані вище і стосуються аеробного розщеплення основних паливних молекул до води та СО2 з утворенням АТФ, належать саме до цього шляху.
Оксигеназний шлях Споживання кисню в реакціях цього шляху знаходиться в межах 8-12%. Цей тип окиснення субстратів не пов'язаний з синтезом АТФ. Ферменти, які каталізують відповідні реакції, мають назву оксигенази. Оксигенази – це ферменти класу оксидоредуктаз. Залежно від кількості атомів кисню, які входять до молекули субстрату під дією оксигеназ, виділяють монооксигенази та диоксигенази. Монооксигенази є гідроксилазами – вони вводять до складу субстрату один атом кисню (гідроксилюють субстрат), другий - відновлюється до молекули води:
SH + O2 + НАДФН ⋅ Н+ → S- O H + H2 O + НАДФ+.
Диоксигенази включають обидва атоми кисню в молекулу субстрату: S + O2 → S O2. Оксигенази є гемовмісними білками, які знаходяться у мік-росомальній фракції печінки (ендоплазматичному ретикулумі), наднирниках тощо. Найбільш поширені монооксигенази. Ці ферменти зазвичай беруть участь у синтезі, біотрансфор-мації та розпаді метаболітів. Функціонування монооксигеназ надає анаболічної функції кисню, тому що він не використовується з метою окиснення субстратів і синтезу АТФ. Кисень включається в процеси перетворення субстратів і його введення в структуру молекул змінює фізико-хімічні та біологічні властивості сполук. Основною монооксигеназою організму є цитохром Р450, який гідроксилює субстрати, такі як холестерол (при синтезі жовчних
кислот та стероїдних гормонів), лікарські сполуки (при їх інактивації в печінці), різноманітні ксенобіотики та ендогенні токсичні речовини (при їх знешкодженні в печінці) тощо. Окиснення, яке відбувається за участі цитохрому Р450, має назву мікросомальне окиснення.
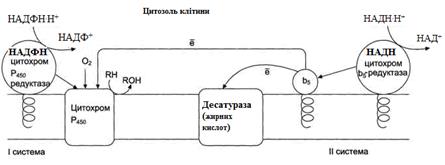
Рисунок 21 – Електрон-транспортні ланцюги мікросомального окиснення: I система – НАДФН-цитохром Р450 редуктазна; II система – НАДН-цитохром b5 редуктазна.
Мікросомальне окиснення відбувається за участі електрон-траспортних ланцюгів, які містять білки-переносники, що вбудовані в мембрани. Існують два ланцюги (на рис. 20 – системи):
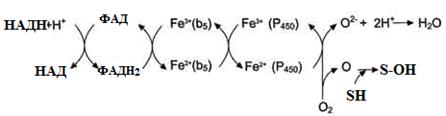
I – до складу входить два ферменти: НАДФН ⋅ Н+-цитохром Р450 редуктаза та цитохром Р450. НАДФН ⋅ Н+-цитохром Р450 редуктаза містить два коферменти ФАД та ФМН, які беруть участь у транспорті електронів з НАДФН ⋅ Н+ на цито-хром Р450 (рис. 22). Цитохром Р450 каталізує гідроксилювання субстратів. II – містить фермент НАДН-цитохром b5 редуктазу та цитохром b5. Коферментом НАДН-цитохром b5 редуктази є ФАД, який бере участь у транспорті електронів з НАДН ⋅ Н+ на цитохром b5 (рис. 23). Наступним акцептором електронів може бути десатураза (цей фермент вводить подвійний зв'язок у структуру жирних кислот) або цитохром Р450 (рис. 21).
Рисунок 22 - Схема електрон-транспортного ланцюга НАДФН-цитохром Р450 редуктазної системи
Рисунок 23 - Схема електрон-транспортного ланцюга НАДН-цитохром b5 редуктазної системи
Цитохром Р450 належить до групи гемопротеїнів, які можуть зв’язувати СО. Саме після зв’язування з монооксидом вуглецю цей цитохром має максимум поглинання світла при довжині хвилі 450 нм і тому отримав назву Р450. Печінка та нирки містять різний ізоферментний спектр цього цитохрому. На сьогодні відомо приблизно 150 генів цитохрому Р450. Група цитохромів Р450 має низьку субстратну специфічність – вони можуть каталізувати гідроксилювання різноманітних сполук і тому їх називають оксидазами мішаної функції. Синтез цитохрому Р450 може бути індукований різноманітними сполуками – індукторами. Відомо приблизно 250 хімічних речовин, які індукують синтез ферментів мікросомального окиснення (барбітурати, спирти, кетони, деякі стероїди). Пероксидазний шлях Це шлях відновлення кисню до пероксиду водню або супероксидного аніон-радикалу за допомогою флавопротеїнів, які здатні до аутоокиснення, наприклад, ксантиноксидаза, алкогольдегідрогеназа та ін. Це відбувається при аутоокисненні гемоглобіну, фередоксинів, гідрохінонів, які відновлені цитохромом b5, біогенних амінів, амінокислот. Цей шлях є побічним шляхом окиснення, зазвичай спостерігається під час виходу з ладу цитохромної системи або коли субстрат не окислюється іншим шляхом (наприклад, сечовина).
При активації цього шляху велика кількість перекису водню та супероксидного аніон-радикалу стає небезпечною для клітин і тому знешкоджується за допомогою спеціальних ферментатив-них систем антиоксидантного захисту.
Вільнорадикальне окиснення Реакції цього шляху відбуваються під дією активних форм кисню (АФК), які містятьнеспарений електрон і тому є високореакційноздатними – можуть окислювати різноманітні сполуки в організмі і тим самим пошкоджують їх структуру. АФК є агресивними молекулами по відношенню до білків, нуклеїнових кислот і, що саме головне, до ліпідів біомембран. Вони запускають ланцюговий процес перекісного окиснення ліпідів (ПОЛ), що призводить до руйнації мембранних структур. До АФК належать: - супероксид-аніон (супероксидний аніон радикал) ( - перекис водню (Н2О2); - гідроксильний радикал (ОН•); - синглетний кисень (1О2); - NO радикал (NO ∙). АФК утворюються як бічні продукти роботи дихального ланцюга при неповному відновленні кисню. Повне відновлення кисню супроводжується акцепцією 4 електронів і утворенням ендогенної води. В разі, коли кількість електронів, які транспортуються на кисень, менша, утворюються АФК:
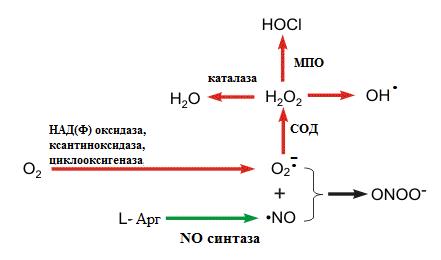
Крім того, ці форми кисню, насамперед супероксидний аніон радикал, можуть утворюватися при функціонуванні деяких ферментів (рис. 24).
Рисунок 24 – Утворення, знешкодження та використання АФК: СОД – супероксиддисмутаза; МПО – мієлопероксидаза.
Відомо, що 2-5% кисню, який поглинає організм, перетворюється саме в ці активні молекули, найбільш реакційно здатною з яких є гідроксильний радикал – він може окислити будь-яку молекулу в організмі. Утворення NO радикала (NO ∙) та подальша його взаємодія з супероксидним аніон радикалом призводять до утворення пероксинітриту (ONOO-), який у незначній кількості може виконувати функцію вазодилятатора, а при високій концентрації викликає ушкодження клітин.
Утворення АФК відбувається постійно в клітинах організму і є звичайним метаболічним процесом. Постійним джерелом АФК є макрофаги, які використовують супероксидний радикал для боротьби із чужорідними організмами (вірусами, бактеріями, злоякісними клітинами). На рис. 24 схематично показано, що супероксидний аніон радикал поступово під дією ферментів СОД та МПО перетворюється у гіпохлорну кислоту, яка є сильним оксидантом і здатна руйнувати чужорідні клітини. Далі гіпохлорна кислота під час реакції з перекисом водню може продукувати синглетний кисень та воду.
Вільнорадикальне окиснення є необхідним для утворення біорегуляторів (простагландинів, лейкотрієнів, тромбоксанів) з арахідонової кислоти.
Лише 2% АФК використовується організмом у процесах, корисних для організму. Решта (98%) АФК має руйнівну дію і може пошкоджувати різні клітинні структури. Негативний вплив АФК пов'язаний з їх здатністю стимулювати утворення органічних пероксидів (ROOH). Цей процес отримав назву перекисне окиснення. АФК найбільш активно атакують ненасичені жирні кислоти, що знаходяться у складі фосфоліпідів біомембран. Як було зазначено вище, найбільшу окислювальну здатність має гідроксильний радикал, і саме тому він ініціює ланцюг вільно-радикального окиснення. Гідроксильний радикал забирає водень у СН2-групи поліненасиченої жирної кислоти у складі фосфоліпіду і, таким чином, утворюється ліпідний радикал (L∙).
Розвиток ланцюга відбувається шляхом приєднання кисню: L • + О2 → LOO • У результаті утворюються ліпідний пероксирадикал LOO• та пероксид ліпіду LOOH (рис. 24). Радикали, що утворюються, мають високу реакційну здатність – кожний радикал здатний генерувати утворення декілька нових радикалів. Таким чином, виникає ланцюгова реакція перекисного окиснення ліпідів. Одним із кінцевих продуктів ПОЛ є малоновий діальдегід:
Визначення концентрації цієї сполуки у крові є важливим показником активності ПОЛ та служить маркером ендогенної інтоксикації при серцево-судинних захворюваннях, діабеті, атеросклерозі тощо.
Ланцюг вільнорадикального окиснення може бути обірваний як за рахунок взаємодії радикалів один з одним, так і в реакціях із компонентами антиоксидантної системи клітини (наприклад, вітаміном Е): LOO• + L• → LOOH + LH; L• + вітамін E → LH + вітамін E•; вітамін E• + L• → LH + вітамін Еокисл.
Рисунок 25 - Механізм розвитку вільнорадикальної реакції ПОЛ
Накопичення АФК та активація перекисного окиснення призводять до низки негативних наслідків у клітині: 1) порушенням рідинно-кристалічної структури ліпопроте-їнів мемебран; 2) зниження міцності та порушення структури мембран клітини, в тому числі мітохондріальної мембрани; 3) структурно-функціональні порушення ферментативних систем дихання та оксидоредуктаз; 4) порушення ферментативних систем синтезу АТФ; 5) ушкодження транспортних мембранних систем; 6) гальмування процесів синтезу білків, нуклеїнових кислот, тощо; 7) руйнація лізосом та вивільнення лізосомальних гідролітичних ферментів; 8) накопичення продуктів неповного окиснення субстратів з можливим подальшим розвитком ацидозу; 9) інактивація деяких коферментів (глутатіону, ліпоєвої кислоти).
|
|||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 268; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.190.232 (0.014 с.) |

 );
);