
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опишите механизм действия флавинзависимых дегидрогеназ (механизм действия фад и фмн в окислительно-восстановительных реакциях).Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Механизм действия ФМН и ФАД. Активной частью молекулы ФАД или ФМН служит изоаллоксазиновое кольцо рибофлавина. Два атома водорода (два протона и два электрона) присоединяются к первому и десятому атомам азота за счет внутримолекулярной перегруппировки двойных связей в кольце. Реакция восстановления ФМН имеет вид:
Окисленная форма ФМН Восстановленная форма ФМН.2Н 9. Опишите формулу коэнзима Q (убихинон) и механизм его действия в окислительно-восстановительных реакциях. Какова его роль в дыхательной цепи? Третий тип переносчиков электронов в дыхательной цепи представлен бензохиноновым соединением, носящим название кофермента Q или убихинон. Производное бензохинона имеет длинную изопреноидную цепь (для микроорганизмов n=6, для эукариот – 9). Убихинон свободно перемещается в липидной части внутренней мембраны митохондрий, и его быстрой диффузии способствует длинный неполярный хвост.
Полухинон (КоQ.Н) Гидрохинон (КоQ.2Н) Кофермент Q имеет величину окислительно-восстановительного потенциала более положительную, чем у флавопротеидов (+0,02 В). В дыхательной цепи ферментов убихинон способен принимать водород от различных флавопротеидов:
10. Цитохромная система (типы цитохромов) Химический состав и строение цитохромов. В какие комплексы входят цитохромы? Цитохромоксидаза. Функции цитохромов в дыхательной цепи.
^ Механизм действия цитохромов. В отличие от флавопротеидов, которые функционируют одновременно, перенося водород от различных субстратов на общий акцептор КоQ, цитохромы действуют последовательно, перенося электроны от КоQ на конечный акцептор - кислород. На участке дыхательной цепи между НАД и КоQ осуществляется двухэлектронный перенос, тогда как цитохромы, действующие на участке между КоQ и кислородом, переносят лишь по одному электрону. При этом происходит обратимое окисление-восстановление атома железа простетической группы, переходящего из Fе2+ в Fе3+. Следовательно, на данном участке дыхательной цепи должны действовать две молекулы цитохромов.
|
||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 1881; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.41 (0.006 с.) |



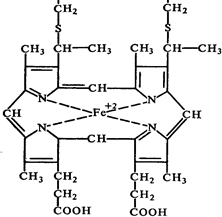 Четвертый тип переносчиков электронов в дыхательной цепи от КоО. на кислород представлен группой различных гемосодержащих белков (гемопротеидов), называемых цитохромами. Отличаясь друг от друга структурой белкового компонента, все они имеют простетическую геминовую группу, близкую по своему строению к гему гемоглобина. В центре порфиринового кольца каждого тема находится ион железа. Группы цитохромов а, b и с отличается между собой сторением апофермента, строением простетической группы, характером связи между простетической группой и апоферментом.
Четвертый тип переносчиков электронов в дыхательной цепи от КоО. на кислород представлен группой различных гемосодержащих белков (гемопротеидов), называемых цитохромами. Отличаясь друг от друга структурой белкового компонента, все они имеют простетическую геминовую группу, близкую по своему строению к гему гемоглобина. В центре порфиринового кольца каждого тема находится ион железа. Группы цитохромов а, b и с отличается между собой сторением апофермента, строением простетической группы, характером связи между простетической группой и апоферментом.


