
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Приготування вторинно- стандартного розчину (кислоти)
Найчастіше в лабораторії застосовують хлоридну, сульфатну, оцтову та нітратну кислоти. Технічні кислоти містять багато домішок, тому для аналітичних робіт застосовують тільки чисті кислоти. Потрібну кількість кислоти не відважують а відмірюють мірним циліндром. При приготуванні розчинів кислот потрібно дотримуватися наступних правил: 1. Розчини не можна готувати в товстостінних бутлях тому, що при розведенні кислот, особливо сульфатної, відбувається сильне нагрівання. Розчини кислот готують у колбах. 2. У колбу наливається розрахована кількість води, а потім тоненьким струмочком, поступово, при перемішуванні приливають потрібну кількість кислоти. Кислоту та воду відмірюють вимірювальними циліндрами. 3. Після охолодження розчину, його переливають у бутель і наклеюють етикетку (паперову етикетку парафінують); можна зробити етикетку особливою фарбою на бутлях. 4. Якщо концентрована кислота, з якої беруть готувати розбавлений розчин, зберігається тривалий час, необхідно перевірити її концентрацію. Для цього вимірюють її густину ареометром і по таблиці знаходять точний вміст кислоти в розчині. Стандартизація розчину (встановлення точної концентрації речовини у розчині титруванням)
1. Точний об’єм досліджуваного розчину(або наважку речовини взяту на аналітичних терезах) помістити у вимірювальну колбу. 2. Розчин у колбі довести водою до мітки, перемішати. 3. Взяти для аналізу точний об’єм приготовленого розчину у колбу для титрування.. 4. Протитрувати не менше 3 разів, розрахувати середній об’єм титранту. 5. Провести обчислення за формулами: СN (дослідж.) = СN (титранту) * V (титранту) / V(дослідж.) q (дослідж.) = СN (дослідж.) * Vк * Mекв / 1000 W% = q * 100 % / а контр.
1.Контрольний розчин (або наважку речовини взяту на аналітичних терезах попередньо розчинити у воді) помістити у колбу Ерленмейєра. 2.Протитрувати його робочим розчином. 3.Провести розрахунки за формулами: q (дослідж.) = СN (титранту) * V (титранту) * Mекв (досліджуваного) / 1000 W% = q (дослідж.) * 100 % / а контр Алгоритм характеристики методу об’ємного аналізу 1. Основне рівняння методу; 2. Титрант, його приготування, призначення; 3. Вихідний розчин, його приготування, призначення;
4. Стандартизація титранту, хімізм реакцій, роль індикаторів, аналітичний ефект, розрахунки титру; 5. Дослідження невідомого розчину методом піпеткування та методом окремих наважок, хімізм реакцій, розрахунки вмісту досліджуваної речовини;
6. Застосування методу у професійній діяльності. Титриметричні визначення Інструкція до навчальної практики №4 Дата__________________ Тема: Ацидиметрія. Мета: Закріпити теоретичні знання, набути практичних умінь та навичок проведення хімічного аналізу методом нейтралізації.
В.В. Болотов Аналітична хімія X.: Оригінал, 2004, с. 213-214,232-235 Д.Д. Луцевич Аналітична хімія К.: Здоров'я, 2003, с. 204-220 План. 1. Приготування вихідного розчину бури з СN = 0,1 моль екв/дм3, визначення його титру. 2. Стандартизація робочого розчину HCl по розчину бури.
Характеристику методу за алгоритмом. Методику проведення кількісного визначення
Провести кількісне визначення досліджуваної речовини у розчині даним методом Лабораторна робота 1.Приготування вихідного розчину – Na2В4O7 • 10H2O
2.Стандартизація робочого розчину HCl (за вихідним розчином Na2В4O7 • 10H2O)
2HCl+Na2В4O7+5H2O →2NaCl+4H3ВО3
T(HСІ) =
К= . Підпис викладача:___________________
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-26; просмотров: 369; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.216.34.146 (0.013 с.) |
 Література:
Література: Знати:
Знати: Уміти:
Уміти:


 =
=




 1. 2. 3.
1. 2. 3.
 Зважити (q) у бюксі на: техно-хімічних терезах(1),m =______
Зважити(q) у бюксі на аналітичних терезах (2)(mаналіт) =____
Висипати (q) у вимірювальну колбу(3),
Зважити порожній бюкс на аналітичних терезах(mб.)=______
q(практ) = m(аналіт) – m(б.); q(практ)=____________
Зважити (q) у бюксі на: техно-хімічних терезах(1),m =______
Зважити(q) у бюксі на аналітичних терезах (2)(mаналіт) =____
Висипати (q) у вимірювальну колбу(3),
Зважити порожній бюкс на аналітичних терезах(mб.)=______
q(практ) = m(аналіт) – m(б.); q(практ)=____________
 ;
;  =
=

 ;
;
 ; К=
; К=  Т=
Т=
 Na2В4O7 (10,00см3)
Метиловий оранжевий
Na2В4O7 (10,00см3)
Метиловий оранжевий



 ; Vс. =
; Vс. = ;
;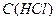 =
= – об’єм, який взято для титрування
– об’єм, який взято для титрування – середній об’єм, який затрачено на титрування
– середній об’єм, який затрачено на титрування ;
;  ;
;


