
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кафедра биологии, кормопроизводства, селекцииСодержание книги
Поиск на нашем сайте
Кафедра биологии, кормопроизводства, селекции И семеноводства
РАБОЧАЯ ТЕТРАДЬ для лабораторно-практических занятий по курсу «Микробиология» для студентов заочного обучения
Ф.И.О. студента _______ Курс________________
Группа______________
БРЯНСК 2015 УДК 581.132.08 Милехина Н.В. Рабочая тетрадь для лабораторно-практических занятий по курсу «Микробиология» для студентов агроэкологического института обучающихся по специальностям: Брянск. Издательство Брянской ГСХА, 2015г. с.52
Рабочая тетрадь предназначена для студентов агроэкологического института. В тетради представлены теоретические обоснования и методика выполнения лабораторных работ, касающиеся исследований микробных процессов и микрофлоры различных природных объектов. Приведены формы регистрации результатов исследований, контрольные вопросы и задания в тестовой форме по темам.
РЕЦЕНЗЕНТ: В. Е. Мамеева – кандидат сельскохозяйственных наук
© БГСХА, 2015 © Н.В. Милехина, 2015 Раздел 1. ОБЩАЯ МИКРОБИОЛОГИЯ
ТЕМА 3. Микробиологический анализ воздуха
Микробиологический анализ микробных сред (воздуха, почвы, воды, растительных объектов) включает в себя следующие этапы: - выделение микроорганизмов из исследуемой среды в чистую культуру. - количественный учет микроорганизмов в среде. -качественная характеристика микрофлоры исследуемой среды. - выращивание выделенных микроорганизмов в культуре.
Работа 3.1. Выделение в культуру и количественный учет микронаселения воздуха методом засева агаровой пластинки. Микробное население воздуха относительно малочисленно. Развитию микробов препятствует: отсутствие пищи, низкая влажность, губительное действие солнечной радиации. В воздух микробы попадают с поднимающейся с поверхности земли пылью, поэтому микробная загрязненность воздуха коррелирует с запыленностью. Микробная загрязненность является важным показателем санитарно-гигиенического состояния воздуха.
Ход выполнения работы
1. Приготовление питательной среды. Для выделения микробов из исследуемого воздуха в культуру готовят универсальную среду – мясопептонный агар (МПА). Мясо измельчают, заливают водой и настаивают. Полученную мясную воду кипятят – при этом получают мясной бульон. Для усиления питательности к бульону добавляют пептон (гидролизат белка) при этом образуется МПБ. В него вносят агар-агар, при этом среда становится агаризированной. Готовую среду разливают в пробирки, закрывают ватными пробками и стерилизуют в автоклаве. 2. Стерилизация посуды. Чашки Петри заворачивают в бумажные пакеты и стерилизуют в сушильном шкафу (140-1600 ) в течение 2-3 часов. 3. Приготовление агаровой пластинки. Пробирку со стерильным МПА расплавляют на кипящей водяной бане. Ее содержимое переносят в стерильную чашку Петри соблюдая правила стерильности. После остывания на дне чашки образуется агаровая пластинка, готовая к засеву. 4. Засев агаровой пластинки. Засев агаровой пластинки осуществляют методом оседания. Для этого достаточно открыть чашку со стерильной агаровой пластинкой и оставить её открытой 5 минут. При этом микробы из воздуха, оседая с пылью, засевают поверхность пластинки. После окончания засева чашку закрывают и переносят в термостат на 5-7 дней. После окончания срока инкубации в чашке обнаруживаются микробные колонии, каждая из которых заселена потомками той микробной клетки, которая попала на соответствующее место агаровой пластинки при её засеве. Следовательно, колонии – это чистые культуры выделенных из воздуха микроорганизмов. 5. Учет колоний на агаровой пластинке. Для количественного учета микробного населения воздуха подсчитывают число колоний, выросших в чашке. Далее рассчитывают микробную загрязненность воздуха. При этом учитывают тот факт, что на поверхность агаровой пластинки в чашке Петри на площади 100 см2 за 5 минут осаждается столько микробных клеток, сколько их приходиться на 10 литров воздуха (0,01 м3). Зная площадь чашки (78,5 см2), можно подсчитать количество клеток в 1м3 воздуха. Для этого число колоний, выросших в чашке Петри, относят к общей площади чашки, затем пересчитывают, сколько таких колоний поместилось бы на 100 см2 и далее – в 1 м3 воздуха.
Ход выполнения работы
1. Получение накопительной культуры возбудителей молочнокислого брожения. Мелко измельченную капусту солят, укладывают в банку и утрамбовывают для создания анаэробных условий. Полученная питательная среда содержит все необходимые микробам питательные вещества. Засевать среду не следует, так как на листьях капусты имеются в изобилии микробные клетки возбудителя. Среду помещают в термостат на 3-7 дней. После инкубации среда становится накопительной культурой. 2. Обнаружение возбудителя в культуре. Каплю культуры переносят на предметное стекло, готовят мазок и микроскопируют на большом увеличении микроскопа. На препарате обнаруживаются молочнокислые бактерии родов Streptococcus и Lactobacterium. 3. Обнаружение продуктов жизнедеятельности молочнокислых бактерий. К 1-2 мл сока прибавляют 5 мл концентрированной серной кислоты и 0,5 мл насыщенного раствора сульфата меди. Смесь перемешивают, нагревают 5 минут на кипящей водяной бане. После охлаждения к раствору добавляют несколько капель 0,2% раствора тиофена. При наличии молочной кислоты развивается вишнево-красное окрашивание раствора. Ход выполнения работы
1. Получение накопительной культуры маслянокислых бактерий. Готовят питательную среду. Для этого мелко измельченный неочищенный картофель помещают в колбу и заливают толстым слоем воды (для создания анаэробных условий). В колбу добавляют немного мела, после чего пастеризуют при 800С 10-15 минут. При этом вегетативные клетки микробов погибают, но остаются живыми споры маслянокислых бактерий, которые в изобилии имеются на кожуре картофеля. Колбы инкубируют в термостате 5-7 дней, после чего накопительная культура готова. 2. Обнаружение продуктов жизнедеятельности маслянокислых бактерий в культуре. Масляную кислоту обнаруживают в культуре цветной реакцией с хлорным железом. Для этого к 4-5мл культуры добавляют 1-2 мл 5% хлорного железа, перемешивают и нагревают до кипения. При наличии масляной кислоты развивается красно-коричневая окраска раствора. 3. Обнаружение возбудителей маслянокислого брожения в культуре. Каплю культуры (из придонных слоев) переносят на предметное стекло и готовят мазок, микроскопируют с иммерсией. На препарате обнаруживают бактерии рода Clostridium. Ход выполнения работы
1. Получение накопительной культуры аммонификаторов белка. Мясной бульон с добавлением пептона засевают небольшим количеством почвы. Засеянную среду инкубируют в термостате 3-5дней. 2. Обнаружение аммиака в культуральной среде. К 2-3мл культуральной среды добавляют несколько капель реактива Несслера. При наличии аммиака развивается желто-коричневая окраска. 3. Обнаружение возбудителей аммонификации белка в культуральной среде. Каплю, культуры переносят на предметное стекло, размазывают, готовят мазок. Полученный препарат микроскопируют с иммерсионным маслом. На препарате обнаруживают аммонифицирующие бактерии родов Bacillus, Proteus, Clostridium. Ход выполнения работы
1. Получение накопительной культуры нитрифицирующих бактерий. Готовят питательную минеральную среду, состоящую из раствора солей, содержащих необходимые микроорганизмам элементы минерального питания. В качестве энергетического материала в среду вводят соли аммония (при культивировании возбудителей первой фазы нитрификации) или соли азотистой кислоты (при культивировании возбудителей второй фазы нитрификации). Среду засевают комочком почвы и инкубируют в термостате 2-3 недели. 2. Обнаружение возбудителей процесса нитрификации В накопительной культуре возбудителей первой фазы нитрификации обнаруживают нитриты. Для этого к трем каплям реактива на нитриты (цинк-иод-крахмал) добавляют одну каплю концентрированной Н2SO4 и одну каплю исследуемой культуры. При наличии нитритов развивается желто-синяя окраска. В культуре возбудителей второй фазы нитрификации обнаруживают нитраты. Для этого к реактиву на нитраты (кристаллический дифениламин) добавляют каплю исследуемой культуры и каплю концентрированной Н2SO4. При наличии нитратов развивается темно-синяя окраска раствора. 3. Обнаружение возбудителей процесса нитрификации в культуре. Петлей подхватывают каплю, культуры и переносят на предметное стекло, готовят мазок, микроскопируют с иммерсией. При микроскопировании препарата возбудителей первой фазы нитрификации обнаруживают бактерии рода Nitrozomonas, а при микроскопировании препарата второй фазы – Nitrobacter.
Среда №1. Мясопептонный агар (МПА). Среда служит для выделения аминогетеротрофных микробов. Состав: мясной бульон, пептон, агар. Источником углерода, азота и энергетическим субстратом служат органическим соединения азота (белки, пептиды, аминокислоты). Источником минеральных элементов питания – минеральные соли, содержащиеся в мясном бульоне. Среда №2. Среда Чапека. Среда используется для выделения аминоавтотрофных микроорганизмов. Представляет собой водный раствор сахарозы (источник углерода и энергетический субстрат), в который добавляют минеральные соли, содержащие азот и все другие необходимые элементы минерального питания. Среда №3. Среда Эшби. Среда предназначена для культивирования олигонитрофильных микроорганизмов. Представляет собой водный раствор глюкозы (источник углерода и энергический субстрат) и минеральных солей, содержащих все необходимые элементы минерального питания, за исключением азота. 2. Подготовленные среды агаризируют, разливают в пробирки, закрывают ватными пробками и стерилизуют в автоклаве. 3. Стерилизация посуды: чашки Петри, колбы, пипетки заворачивают в бумагу и стерилизуют в сушильном шкафу. 4. Стерилизация воды: водопроводную воду наливают в колбы, закрывают ватной пробкой и стерилизуют в автоклаве в том же режиме, что и питательные среды. 5. Приготовление микробной суспензии из исследуемой почвы. С исследуемого участка земли отбирают специальным буром несколько (3-15) проб почвы, на глубину пахотного горизонта, по диагонали участка. Отобранные пробы смешивают, тщательно перемешивают, при этом получают средний образец почвы. Из среднего образца отбирают аналитическую пробу массой 10 г, переносят в колбу с 90 мл стерильной воды. Содержимое колбы перемешивают в течение 5 минут, дают отстояться около минуты, при этом получают суспензию первого разведения, где микробы разведены по сравнению с их концентрацией в почве в 10 раз. Затем проводят второе разведение, для чего пипеткой переносят из первой колбы 10 мл суспензии первого разведения в стерильную колбу с 90 мл стерильной воды и перемешивают; в суспензии второго разведения микробы будут разведены по сравнению с их концентрацией в почве в 100 раз. Аналогично этому проводят третье, четвертое, пятое и шестое разведение. Для засева питательной среды используют суспензии пятого и шестого разведения, где концентрация микробов по сравнению с их исходной концентрацией в почве будет меньше соответственно в 100000 и в 1000000 раз. 5. Засев питательной среды. Готовят агаровую пластику. Стерильной пипеткой отбирают 1мл микробной суспензии соответствующего разведения и переносят (соблюдая стерильность) в стерильную чашку Петри, Вращением чашки равномерно распределяют микробную суспензию и оставляют для остывания. Засеянные таким образом чашки Петри инкубируют в термостате 5-7 дней. После окончания периода инкубации подсчитывают число колоний, выросших в чашке. Количество микробных клеток соответствующей физиологической группы микроорганизмов рассчитывают по формуле: Х= n*r, где Х- число микробных клеток соответствующей физиологической группы в пересчете на 1 г почвы n – число колоний, выросших в чашке r – степень разведения микробной суспензии
Записи при выполнении работы. ------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------ ---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Работа 7.2. Оценка общей биологической активности почвы поскорости разложения целлюлозы.
Основную массу почвенной микрофлоры составляют сапрофиты, осуществляющие разложение органических остатков растений и животных. Поэтому скорость разложения органических веществ, например целлюлозы, может характеризовать микробный статус почвы, т.е. численность и активность микробов. Ход выполнения работы 1. Готовят из исследуемого образца почвенную пластинку. Для этого в чашки Петри переносят около 20 г почвы, добавляют 10 мл воды, перемешивают и выравнивают. 2. Вырезают кружок фильтровальной бумаги, взвешивают, после чего помещают его на увлажненную поверхность почвенной пластинки и плотно прижимают к ней. 3. Чашку закрывают, помещают в термостат при Т-27-300 на 2-3 недели. При этом микроорганизмы разлагают целлюлозу фильтровальной бумаги. 4. После окончания срока инкубации бумажный кружок осторожно снимают с почвенной пластинки, тщательно отмывают от почвы, высушивают и взвешивают. Общую биологическую активность почвы оценивают по количеству разложенной целлюлозы, выраженной в процентах от исходной массы кружка фильтровальной бумаги. Расчеты ведут по формуле:
Х - количество разложенной микробами целлюлозы, в % от исходной массы кружка фильтровальной бумаги; а1 – исходная масса кружка фильтровальной бумаги, мг; а2 – конечная масса кружка фильтровальной бумаги, мг. Записи при выполнении работы. -------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------- ----------------------------------------------------------------------------------- ----------------------------------------------------------------------------------- Кафедра биологии, кормопроизводства, селекции И семеноводства
РАБОЧАЯ ТЕТРАДЬ для лабораторно-практических занятий по курсу «Микробиология» для студентов заочного обучения
Ф.И.О. студента _______ Курс________________
Группа______________
БРЯНСК 2015 УДК 581.132.08 Милехина Н.В. Рабочая тетрадь для лабораторно-практических занятий по курсу «Микробиология» для студентов агроэкологического института обучающихся по специальностям: Брянск. Издательство Брянской ГСХА, 2015г. с.52
Рабочая тетрадь предназначена для студентов агроэкологического института. В тетради представлены теоретические обоснования и методика выполнения лабораторных работ, касающиеся исследований микробных процессов и микрофлоры различных природных объектов. Приведены формы регистрации результатов исследований, контрольные вопросы и задания в тестовой форме по темам.
РЕЦЕНЗЕНТ: В. Е. Мамеева – кандидат сельскохозяйственных наук
© БГСХА, 2015 © Н.В. Милехина, 2015
|
||||
|
Последнее изменение этой страницы: 2017-01-20; просмотров: 293; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.146.176.191 (0.012 с.) |

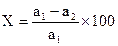 , где
, где


