
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Механизм растворения полимеров.Содержание книги Поиск на нашем сайте
Растворы полимеров Под растворением понимается взаимное диспергирование вдруг в друге молекул полимера и растворителя. Взаимодействия полимеров с растворителями имеет огромное значение и в процессах синтеза, переработки и эксплуатации полимеров [1, 3, 6…9, 12…14]. В зависимости от степени диспергирования полимера в растворителе могут образовываться истинные растворы и коллоидные системы. Основными признаками истинных растворов являются самопроизвольное образование и гомофазность. Коллоидные системы образуются принудительно и являются гетерофазными. Растворение, или самопроизвольное диспергирование, как любой самопроизвольный процесс при постоянных давлении и температуре, может происходить, если сопровождается уменьшением свободной энергии Свойства и структура коллоидных систем зависят от способа их приготовления. В коллоидных системах всегда имеют место процессы агрегирования, в результате чего системы распадаются на две фазы. Истинные растворы полимеров имеют специфические отличия от растворов низкомолекулярных соединений, а именно: образование истинных растворов полимеров протекает через стадию набухания; растворы полимеров, даже очень разбавленные, отличаются высокой вязкостью. Свойства растворов полимеров имеют существенные отклонения от свойств, описываемых классическими законами термодинамики. Механизм растворения полимеров. Механизм процесса растворения полимеров сводится к следующим явлениям: — проникновению или диффузин молекул растворителя в полимер через области с наиболее рыхлой упаковкой макромолекул по механизму капиллярного всасывания (рис.1):
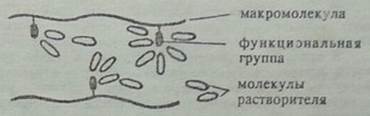
Рисунок 1. — одновременному возникновению взаимодействия между молекулами растворителя и молекулами полимера, которое называется сольватацией. Явления сольватации и образования сольватированных комплексов происходят за счет возникновения между молекулами растворителя и функциональными группами полимера водородных или донорно-акцепторных связей, π-комплексов, физического взаимодействия и др. (рис.2):
Рисунок 2. В результате сольватации ослабляется молекулярное взаимодействие в полимере, молекулы растворителя как бы обволакивают функциональные группы и раздвигают макромолекулы полимера. Полимер увеличивается в объеме, возрастает его масса за счет проникающего в фазу полимера растворителя. Говорят, что полимер набухает. Следовательно, набухание — поглощение (сорбция) растворителя полимером, сопровождающееся изменением структуры и увеличением его массы и объема; — отделению полностью от сольватированных макромолекул от остальной массы набухшего полимера и диффузии этих макромолекул в объеме растворителя, т.е. собственно растворению, образованию гомогенной системы. Обязательным условием растворения является уменьшение свободной энергии системы
С изменением свободной энергии системы вплотную связано второе условие самопроизвольного растворения полимеров — наличие термодинамического сродства между компонентами. Растворение идет лишь в том случае, если между компонентами имеется термодинамическое сродство. Термодинамическое сродство компонентов друг к другу количественно оценивают по снижению величин химического потенциала растворителя и полимера после их взаимодействия с образованием раствора. Химический потенциал компонентов системы связан с величиной свободной энергии. Под химическим потенциалом компонента μi многокомпонентной системы данного состава понимают приращение свободной энергии системы d Gi при добавлении к ней бесконечно малого количества i -го компонента при постоянных P, T и числе молей всех остальных компонентов.
Химический потенциал индивидуальных компонентов обозначается μ0. Таким образом, для самопроизвольного растворения полимера в растворителе необходимо, чтобы химический потенциал компонента в растворе (μi полимера или μi растворителя) был меньше химического потенциала данного компонента в чистом виде μ0, т.е.
Чем больше абсолютное значение отрицательной величины С точки зрения термодинамического сродства растворители подразделяют условно на «хорошие» и «плохие» соответственно с большим отрицательным значением В процессе растворения на стадии набухания различают межструктурное и внутриструктурное, неограниченное и ограниченное набухание. Если молекулы растворителя могут проникать только в участки между надмолекулярными структурами, то имеет место межструктурное набухание. Если растворитель проникает между отдельными макромолекулами, то происходит внутриструктурное набухание полимеров. Неограниченное набухание — это набухание, самопроизвольно переходящее в растворение и характерное для линейных аморфных полимеров с невысокой степенью полимеризации. Сольватированные макромолекулы таких полимеров легко переходят в раствор (рис.3, кривые 1…2). Ограниченное набухание — процесс взаимодействия полимера с растворителем, не сопровождающийся растворением. Ограниченное набухание характерно для сетчатых полимеров, полимеров с высокой молекулярной массой и в случае невысокого термодинамического сродства полимера и растворителя (рис.3, кривые 3…5). Процесс набухания характеризуется полимеров кинетическими кривыми набухания, а интенсивность набухания полимеров количественно оценивается степенью набухания Q (рис.3). Участки о-а кривых набухания отражают постепенно замедляющееся увеличение степени набухания. Для растворимых полимеров на участках а-в кривых 1 и 2 скорость набухания становится сопоставимой со скоростью растворения, а на участке в-с идет интенсивное растворение полимеров, которое сопровождается уменьшением массы образцов. Кинетика ограниченного набухания сетчатых полимеров описывается кривыми 3, 4 и 5.
Рисунок 3. Степень набухания полимеров Q выражается через увеличение их массы Qm или объема QV:
Скорость набухания оценивают по увеличению массы или объема полимера во времени:
По величине максимальной степени набухания Рисунок 4. Точка, лежащая на вершине кривой смешения, называется верхней критической точкой растворения (ВКТР), рис.4, а. Точка в нижней части кривой смешение называется нижней критической точкой растворения (НКТР), рис.4, б. При расслоении гомогенной системы на жидкую и твердую фазы диаграмма фазового состояния имеет вид рис.4, в. Точки Т1 и Т2 — температуры плавления 100%-ных компонентов 1 (растворитель) и 2 (полимер). У растворов полимеров вследствие большой разницы молекулярной массы полимера и растворителя ВКТР и НКТР всегда сдвинуты в область малых концентраций полимеров. Метод снятия диаграмм фазового состояния широко используется для выявления условий (температуры и концентрации) стабильного существования растворов полимеров, например, чтобы клеи и лаки при хранении и транспортировке не расслаивались. Рисунок 5. Рисунок 6. Структурные изменения в растворе при течении концентрированных растворов под действием напряжения сдвига στ аналогичны таковыми в расплавах полимеров. Под действием στ сначала происходит разрушение сетки ассоциатов, затем распрямление, ориентация макромолекул (т.е. смена конформаций) и в заключение возникновение новой пространственной сетки между заново сориентированными макромолекулами. На участке I все макромолекулы успевают осуществить указанные структурные изменения, а раствор переходит из одного равновесного состояния в другое. В результате наблюдается стационарное течение с максимальной вязкостью. На участке II в ответ на рост στ все меньше число макромолекул успевает сменить конформацию. Это приводит к аномалии вязкости. На участке III конформацию меняют только самые малые молекулы раствора. В итоге вязкость раствора становится снова стабильной, но малой по величине (рис.6). При росте молекулярной массы M повышается вязкость концентрированных растворов полимеров, причем в координатах lg η -lgM появляется излом в точке критической M (рис.7). При достижении критической молекулярной массы в концентрированном растворе образуется настолько устойчивая сетка из ассоциатов макромолекул, что дальнейшее повышение M веден к резкому возрастанию вязкости раствора (рис.7). Наибольшая ньютоновская вязкость концентрированных растворов с ростом температуры, как правило, уменьшается (рис.8).
Рисунок 7 и 8. Наряду с растворами, полимеры могут образовывать коллоидные системы, в которых полимер диспергирован в растворителе не в виде отдельных макромолекул, а в виде агрегатов макромолекул. Жидкая среда называется дисперсионной средой, нерастворимые в ней агрегаты макромолекул называются дисперсной фазой. Коллоидные системы неустойчивы, двухфазны, разрушаются с четким разделением дисперсионной среды и дисперсной фазы. Этот процесс называется коагуляцией. Коллоидные полимерные системы делят на эмульсии и суспензии с размерами диспертированных агрегатов 0,1 мкм…1 нм. В суспензиях дисперсная фаза – твердая, в эмульсиях – жидкая. Для придания устойчивости эмульсиям и суспензиями в них добавляют эмульгаторы с полярной и неполярной частями. Сольватируя полимер, эмульгатор не дает агрегаам макромолекул слиться и коагулировать. Коллоидные системы имеют меньшую вязкость даже при более высокой концентрации, чем концентрированные растворы, легко разрушаются при замораживании и при добавке электролитов. Типичными примерами коллоидных растворов являются карбамидоформальдегидные смолы (КФ-О, КФ-МТ-15, КФЖ), используемые в качестве связующих для производства ДСтП, древесных слоистых пластиков и фанеры. Пластификация полимеров. Введение в полимер различных жидкостей или твердых тел, улучшающих эластичность, морозостойкость полимеров, облегчающих их переработку, называется пластификацией, а вводимые вещества - пластификаторами. Механизм пластификации близок к растворению. Молекулы пластификатора проникают в фазу полимера, ослабляют межмолекулярное взаимодействие, изменяют структуру полимера, вызывают увеличение подвижности и гибкости макромолекул, снижают вязкость полимеров. В зависимости от термодинамического сродства пластификатора и полимера проникновение (диспергирование) пластификатора в полимер может быть различным. При высоком термодинамическом сродстве, т.е. сильном взаимодействии молекул пластификатора между отдельными макромолекулами. Такое явление называют внутриструктурной пластификацией. Полимер набухает в пластификаторе. При малом термодинамическом сродстве молекулы пластификатора способны проникать только в межструктурные пространства (рыхлые области между надмолекулярными структурами), вызывая межструктурную пластификацию. Ослабляя межмолекулярное взаимодействие, повышая подвижность, гибкость макромолекул, пластификаторы затрудняют стеклование и облегчают перевод полимеров в вязкотекучее состояние, т.е. снижают температуры T c и Tτ, при которых полимеры переходят в стеклообразное и вязкотекучее состояние (рис.9).
Рисунок 9. Снижение T c способствует повышению морозостойкости полимеров, что очень важно для эластомеров. Снижение Tτ облегчает процессы переработки полимеров в изделия. При введении малого количества (<20%) пластификаторов снижение значения T c ( Действие пластификаторов наиболее эффективно, если имеются их хорошая совместимость и термодинамическое сродство с полимером. Жидкие пластификаторы должны иметь высокую температуру кипения, чтобы не испаряться при эксплуатации; твердые – должны легко размягчаться. Обязательными требованиями к пластификаторам являются их нетоксичность, некоррозионно-активность и химическая инертность к полимеру. Пластификаторы не должны иметь запаха и не должны экстрагироваться (вымываться) растворителями из полимера. В качестве пластификатора широко используются: - эфиры ароматических кислот, в частности, эфиры ортофталевой кислоты, такие как дибутилфталат (ДБФ) и диоктилфталат (ДОФ) общей формулы:
где R: C4H9 или C8H17: - эфиры алифатических моно- и дикарбоновых кислот (адипинаты - эфиры гликолей (ди-, триэтиленгликоля) и монокарбоновых кислот C6…C9; - эфиры фосфорной и фосфористой кислот, придающие одновременно негорючесть полимерам - полиэфиры дикарбоновых кислот и полиолов; - олигомеры на основе фенолформальдегидных смол, олигоэфиракрилаты; - эпоксидированные растительные масла (сосвое), продукты модификации канифоли, касторовое масло; - инден-кумароновые смолы, ароматические нефтяные масла и другие соединения. Введение пластификаторов в полимер осуществляется путем растворения полимера в пластификаторе (производство полимерных пленок, искусственной кожи, лакокрасочных покрытий), путем добавления пластификатора в мономер перед полимеризацией или поликонденсацией (производство фенол- и мочевиноформальдегидных полимеров), путем механического смешения полимера с пластификатором. Молекулярная масса и полидисперсность полимеров. Для низкомолекулярных соединений молекулярная масса является постоянной величиной, характеризующей данное соединение. Полимеры вследствие особенностей синтеза и возможных реакций передачи цепи в деструкции состоят из макромолекул с различной длиной цепи, т.е. с разной молекулярной массой, поэтому под понятием молекулярной массы полимера подразумевается усредненная молекулярная масса. Разброс макромолекул полимера по молекулярной массе называется полидисперсностью. Совокупности макромолекул одинаковой химической природы, но разной молекулярной массы называются массы полимергомологами. В зависимости от способа усреднения молекулярной массы полимергомологов различают среднечисловую, среднемассовую, средневязкостную и другие виды молекулярной массы полимеров. Среднечисловую молекулярную массу находят отношением общей массы образца полимера к числу макромолекул в этом образце. В значение среднечисловой молекулярной массы вносят вклад отдельные фракции макромолекул. Если полимер содержит N 1, N 2,… Ni число макромолекул с молекулярной массой соответственно M1, M2,…,M i, то масса mi отдельных фракций такого полимера равна m 1=M1 N 1, m 2=M2 N 2,…, mi =M iNi, а числовая доля ni фракции составит:
Тогда среднечисловая молекулярная масса Mn полимера складывается из долей молекулярной массы, вносимых отдельными фракциями и соответствии с их числовой долей в полимере:
Среднечисловую молекулярную массу определяют обычно по данным измерения какого-либо свойства растворов полимеров, величина которого зависит от числа растворенных макромолекул. Такими свойствами являются осмотическое давление разбавленных растворов полимеров, температуры замерзания или кипения растворов полимеров, концентрация концевых групп макромолекул. Методы определения Mn по величинам указанных свойств соответственно называются осмометрией, криоскопией, эбулиоскопией, химическим методом концевых групп. В значение среднемассовой молекулярной массы вносят вклад отдельные фракции макромолекул в соответствии с их массовой долей в полимере. Если масса отдельных фракций в полимере m 1, m 2,…, mi, а макромолекулы в этих фракциях имеют молекулярную массу M1, M2,…, M i, то массовая доля wi фракций составляет:
а среднемассовая молекулярная масса Mn находится суммированием вкладов молекулярной массы, вносимых отдельными фракциями согласно их массовой доле в полимере:
Учитывая, что m 1=M1 N 1, m 2=M2 N 2,…, mi =M iNi, а
Методы определения Mw основаны на измерении свойств растворов полимеров, величины которых зависят от размера и массы растворенных макромолекул. Такими свойствами являются рассеивание света растворами полимеров, седиментация (оседание) макромолекул полимера в растворе под действием центробежной силы. Соответствующие методы определения Mw называются методами светорассеяния и ультрацентрифугирования. Кроме указанных Mn и Mw находят еще z – среднюю (средневзвешенную) и средневязкостную молекулярные массы (M g, M η). M g определяют методом седиментационного равновесия, а средневязкостную M η находят по данным измерения вязкости разбавленных растворов полимеров.
где α – константа для данной пары системы полимер-растворитель, зависящая от конформация макромолекул в растворе. Если полимер полидисперсен, то к значения усредненных молекулярных масс данного полимера различны. Mw и Mg чувствительны к присутствию высокомолекулярных масс, а Mm – низкомолекулярных фракций в полимере. Поэтому их значения для полидисперсного полимера обычно располагается в ряд Mg>Mw>M η >Mn, а для монодисперсного Mg=Mw=M η =Mn. Степень полидисперсности Kg: Kg=Mw/Mn, или по характеру кривых молекулярно-массового или молекулярно-числового распределений (ММР, МЧР). Кривые ММР (МЧР) могут быть представлены в интегральной (рис.10, а) и дифференциальной (рис.10, б) формах.
Рисунок 10. Интегральная кривая представляет собой зависимость кумулятивной (нарастающей) массовой доли фракции Для полной характеристики полимеров желательно определять не одну среднюю молекулярную массу, а спектр молекулярных масс, и изучить распределение макромолекул полимера по молекулярным массам. Эти данные позволяют прогнозировать физико-химические и эксплуотационные свойства полимеров. Для построения кривых ММР или МЧР необходимо знать массы отдельных фракций полимера и соответствующие этим фракциям средние молекулярные массы макромолекул. С этой целью исходный полимер делят на несколько фракций с постепенно возрастающей или уменьшающейся средней молекулярной массой. Процесс разделения называется фракционированием и осуществляется методами дробного осаждения, дробного растворения или проявительной и гель-проникающей хроматографии. В методе дробного осаждения к раствору полимера периодически добавляют порциями небольшое количество осадителя. Осадитель уменьшает растворяющую способность растворителя настолько, что фракция с наибольшей молекулярной массой становится нерастворимой и выпадает в виде геля, который удаляют. При добавлении каждой новой порции осадителя высаждается очередная фракция оставшегося полимера с наибольшей молекулярной массой. Последнюю фракцию можно получить, выпарив полимер из раствора. Существуют модификации метода дробного осаждения. Один из методов основан на приготовлении раствора полимера при повышенной температуре и медленном охлаждении данного раствора. При этом происходит последовательное высаждение фракций, начиная с самой высокомолекулярной, отбираемых при определенных температурах. Другая разновидность дробного осаждения заключается в постепенном испарении растворителя из бинарной смеси (растворитель-осадитель), в которой растворен полимер. Это приводит к обогащению раствора осадителем и выпадению фракций в осадок, начиная с высокомолекулярной. В методе дробного растворения (иначе экстракции) к порошку или твердому образцу полимера последовательно добавляют серию бинарных смесей растворитель – осадитель, приготовленных в разных пропорциях. Сначала полимер выдерживают в смеси с наименьшей растворяющей способностью. Это приводит к растворению фракций с низкой молекулярной массой, которую удаляют. К оставшейся набухшей массе полимера добавляют последующие порции бинарных смесей со все возрастающей растворяющей способностью, что позволяет выделять фракции полимера с увеличивающейся молекулярной массой. Проявительная хроматография (фракционирование элюированием) также основана на частичном растворении полимера. В этом методе полимер помещают вверху стеклянной колонки, заполненной носителем- силикагелем. Фракции полимера вымывают (элюируют) из образца, пропуская через колонку последовательно смеси растворитель-осадитель с постепенно возрастающей растворяющей способностью. В гель-проникающей хроматографии (ГПХ) колонка заполняется сферическими частицами (гранулами) диаметром 100 мкм, содержащими множество мельчайших пустот – пор размером от 50 до1000 Ǻ. До начала фракционирования в колонку вводят растворитель, который занимает межгранульное пространство и поры внутри гранул. Затем в верхнюю часть колонки вводят разбавленный раствор полимера, который начинает стекает вниз. Стремясь выровнять концентрацию полимера в межгранульном пространстве и внутри пор, макромолекулы полимера проникают (диффундируют) внутрь гранул. Однако вследствие малого радиуса пор вглубь гранул могут проникать только молекулы определенного гидродинамического размера. Большие по размеру макромолекулы остаются в межгранульном пространстве. После пропускания через колонку первой порции растворителя эта фракция полимера с наибольшей молекулярной массой вымывается (элюируется) первой. После промывки колонки следующей порцией растворителя, вследствие обратной диффузии молекул полимера из пор в растворитель, в элюате окажутся макромолекулы средних размеров, занимавших часть объема пор. Последними будут вымываться из гранул молекулы полимера наименьшей молекулярной массы, та как она наиболее глубоко проникают в поры, занимают наибольший объем пор и удерживаются в них дольше всего. ГПХ – быстрый и эффективный метод фракционирования полимеров, позволяющий одновременно со значениями молекулярных масс фракций получать функцию ММР. Методы определения молекулярных масс полимеров. Все методы определения молекулярных масс полимеров подразделяются на четыре группы: химические, термодинамические, молекулярно-кинетические, оптические. Химический метод. Химический метод – метод концевых групп полимеров, основанный на определении и анализе концентраций концевых функциональных групп
Концентрацию концевых функциональных групп c в образце полимера чаще всего определяют титриметрически и выражают через аминное число (Ам. ч.), кислотное число (К. ч.), гидроксильное число (Г. ч.), эпоксидное число (Эп. ч.) и т.д. Аминное число свидетельствует о концентрации концевых аминогрупп
Ам. ч. = где a, b – объемы 0,1 н KOH, израсходованные на титрование соответственно исходного количества 0,1 н HCl и остаточного количества 0,1 н HCl после реакции с NH2-группами, мл; T – титр раствора KOH по HCl, г/мл; g – навеска полимера, г. Кислотное число отражает концентрацию концевых карбоксильных групп
К. ч. где a – объем 0,1 н KOH, израсходованный на титрование COOH-групп, мл; T – титр раствора KOH, г/мл; g – навеска полимера, г. Гидроксильное число указывает на концентрацию концевых гидроксильных групп
Эпоксидное число отражает концентрацию концевых эпокси С использованием найденных значений Ам.ч., К.ч., Г.ч. среднечисловая молекулярная масса может быть рассчитана как:
где 36,5 и 56,1 – соответственно массы миллимоля HCK и KOH, мг. Если на концах макромолекул полимера присутствуют две разнотипные функциональные группы, то
В этом случае аминное число должно быть выраженно в миллиграммах KOH, а не HCl. Химический метод концевых групп недостаточно точен и позволяет определять Термодинамические методы. Совокупность термодинамических методов основана на законах термодинамики разбавленных растворов. Четкие закономерности изменения термодинамических свойств, присущие идеальным растворам, в случае полимеров проявлятся только в растворах с малой концентрацией, поэтому измерение этих свойств осуществляется на разбавленных растворах полимеров и результаты измерений, как правило, еще экстраполируются к бесконечному разбавлению. В основе термодинамических методов лежит пропорциональная зависимость определенных свойств (температур замерзания, кипения, осмотического давления) растворов полимеров от числа растворенных макромолекул. Термодинамическое методы позволяют определять Мембранная осмометрия. В основе лежит явление осмоса – переноса растворителя через полупроницаемую мембрану. Если растворитель отделить от раствора полимера мембраной (рис.11), то в начале химические потенциалы чистого растворителя μ 0 и растворителя в растворе μ 1 будут различны (μ 0 > μ 1).
Рисунок 11. Стремясь выровнять химические потенциалы, молекулы растворителя будут диффундировать в ячейку с раствором полимера. В результате в ней повысится уровень жидкости
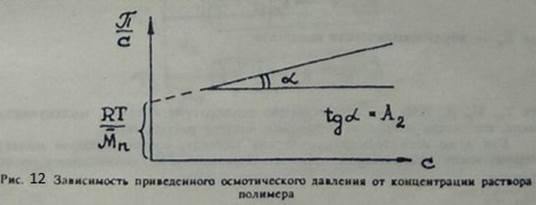
Указанная зависимость π/ c от c линейная. С ее помощью можно определять среднечисловую молекулярную массу по отрезку RT /Mm, отсекаемому прямой на оси ординат (рис.12). Коэффициент A 2 при c носит название второго вириального коэффициента и определяется характером взаимодействия полимера с растворителем.
Рисунок 12. Величину осмотического давления в мембранных осмометрах можно измерять в статическом и динамическом режимах. Устройство и принцип действия статического осмометра показаны на рис. 11. Недостатком статического метода является длительность измерения, так как диффузия через мембрану с достижением постоянной величины Метод криоскопии. Для определения молекулярной массы криоскопическим методом используется эффект снижения температуры замерзания жидкости при растворении в ней полимера. Величина
Исходя из прямолинейной зависимости приведенной величины от концентрации раствора c, молекулярную массу находят по отрезку K c /Mn, отсекаемому указанной прямой на оси ординат. Константа K c называется криоскопической константой, которая зависит от свойств чистого растворителя:
где T 3, M3, ρ 3, H 3 – соответственно температура замерзания, молекулярная масса, плотность и теплота плавления растворителя. Криоскопией возможно определение Mn до Метод эбулиоскопии. Эбулиоскопический метод основан на различии температур кипения раствора полимера и чистого растворителя. Растворы полимеров кипят при более высоких температурах, чем чистые растворители. Величина повышения температуры кипения
где Кк – эбулиоскопическая константа:
где | ||
|
| Поделиться: |

 системы. В истинных растворах при заданных температурах и давлениях концентрация раствора, его свойства и структура будут одними и теми же независимо от способа его получения.
системы. В истинных растворах при заданных температурах и давлениях концентрация раствора, его свойства и структура будут одними и теми же независимо от способа его получения.
 .
. ;
; .
.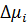 , тем больше сродство между компонентами, тем легче идет растворение.
, тем больше сродство между компонентами, тем легче идет растворение.
 ;
; 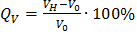 , где
, где  и
и  — соответственно масса и объем исходного полимера;
— соответственно масса и объем исходного полимера;  и
и 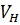 — масса и объем набухшего полимера.
— масса и объем набухшего полимера. ;
; 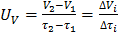 , где m 1, V 1 — соответственно масса и объем полимера в момент времени
, где m 1, V 1 — соответственно масса и объем полимера в момент времени 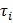 ;
;  ,
, 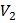 — масса и объем полимера в момент времени
— масса и объем полимера в момент времени  .
. можно судить о термодинамическом сродстве полимеров и растворителей. Для полимергомологов, испытанных в одинаковых условиях, по кривым набухания можно дать качественную оценку молекулярной массе, судить о наличии пространственной сшитой структуры и т.д.
можно судить о термодинамическом сродстве полимеров и растворителей. Для полимергомологов, испытанных в одинаковых условиях, по кривым набухания можно дать качественную оценку молекулярной массе, судить о наличии пространственной сшитой структуры и т.д.

 T c) превышает падение значения Tτ (
T c) превышает падение значения Tτ (
 , себацинаты
, себацинаты  , стеараты
, стеараты  и др.);
и др.); ,
, 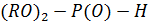 ;
; ,
,  ,…,
,…,  .
. .
. ,
,  ,…,
,…, 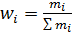 ,
,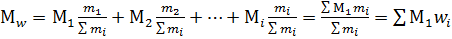 .
. , получаем:
, получаем: .
. ;
;  ,
,
 в общей массе полимера m o от величины молекулярной массы макромолекул М. Дифференциальная кривая получается диффиринцированием интегральной и строится в координатах (d mi / m 0 dM)-M. Абсциссы центров тяжести (0, 0') площадей, ограниченных кривыми ММР, дают значение Mw (рис.10, б), а ограниченных кривыми МЧР – значение Mn. По формам кривых 2 и 2' видно, что два полимера с одинаковой Mw могут быть разными по полидисперсности. Полимер, ММР которого описывается кривой 2', более полидисперсен. Полимер, описываемый кривой 2, имеет более узкое ММР и менее полидисперсен. Степень полидисперсности зависит от способа получения полимеров. Коэффициент полидисперсности Kд колеблется от 1,2 до 20. Полимеры, полученные радикальной полимеризацией, имеют больший Kд (2…5), чем полученные ионной полимеризацией (2,1…2,5).
в общей массе полимера m o от величины молекулярной массы макромолекул М. Дифференциальная кривая получается диффиринцированием интегральной и строится в координатах (d mi / m 0 dM)-M. Абсциссы центров тяжести (0, 0') площадей, ограниченных кривыми ММР, дают значение Mw (рис.10, б), а ограниченных кривыми МЧР – значение Mn. По формам кривых 2 и 2' видно, что два полимера с одинаковой Mw могут быть разными по полидисперсности. Полимер, ММР которого описывается кривой 2', более полидисперсен. Полимер, описываемый кривой 2, имеет более узкое ММР и менее полидисперсен. Степень полидисперсности зависит от способа получения полимеров. Коэффициент полидисперсности Kд колеблется от 1,2 до 20. Полимеры, полученные радикальной полимеризацией, имеют больший Kд (2…5), чем полученные ионной полимеризацией (2,1…2,5). и др.) или меченых атомов в макромолекулах. Теоритически каждая макромолекула поликонденсационного полимера может иметь одну или две концевые функциональные группы в образце полимера приходится одна макромолекула. Определяя общее содержание функциональных концевых групп c в единице массы, можно находить общее количество макромолекул в исследуемом образце полимера. Тогда среднечисловая молекулярная масса полимера Mn в общем виде может быть найдена как величина, обратная числу макромолекул:
и др.) или меченых атомов в макромолекулах. Теоритически каждая макромолекула поликонденсационного полимера может иметь одну или две концевые функциональные группы в образце полимера приходится одна макромолекула. Определяя общее содержание функциональных концевых групп c в единице массы, можно находить общее количество макромолекул в исследуемом образце полимера. Тогда среднечисловая молекулярная масса полимера Mn в общем виде может быть найдена как величина, обратная числу макромолекул: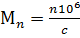 .
. NH2 в 1 г полимера и выражается через количество миллиграммов HCl, вступившей в реакцию с 1 г полимера с – NH2 – группами:
NH2 в 1 г полимера и выражается через количество миллиграммов HCl, вступившей в реакцию с 1 г полимера с – NH2 – группами: ;
; ,
, в 1 г полимера и находятся по количеству миллиграммов KOH, прореагировавшего с COOH-группами:
в 1 г полимера и находятся по количеству миллиграммов KOH, прореагировавшего с COOH-группами: ;
; ,
, в 1 г полимера и определяется по количеству миллиграммов KOH, пошедшего на титрование уксусной кислоты, выделившейся в результате реакции уксусного ангидрида с концевыми гидроксильными группами:
в 1 г полимера и определяется по количеству миллиграммов KOH, пошедшего на титрование уксусной кислоты, выделившейся в результате реакции уксусного ангидрида с концевыми гидроксильными группами:
 групп в 1 г полимера и находится по количеству галогеноводородной кислоты HHal, необходимой для гидрогалогенирования эпоксидных групп.
групп в 1 г полимера и находится по количеству галогеноводородной кислоты HHal, необходимой для гидрогалогенирования эпоксидных групп. ;
;  ;
;  ,
, рассчитывают с учетом концентрации обеих концевых групп, например, для полиамидов:
рассчитывают с учетом концентрации обеих концевых групп, например, для полиамидов: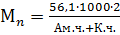 .
. . Этот метод преимущественно используют для нахождения среднечисловой молекулярной массы поликонденсационных линейных полимеров.
. Этот метод преимущественно используют для нахождения среднечисловой молекулярной массы поликонденсационных линейных полимеров.
 (рис.11). Разность давлений по обе стороны мембраны, вызывающая явление переноса (осмоса) и выравнивания химических потенциалов системы, называется осмотическим давлением π. С увеличением концентрации раствора полимера возрастает разность между химическими потенциалами растворителя и раствора. Чем больше становится разность химических потенциалов растворителя и раствора
(рис.11). Разность давлений по обе стороны мембраны, вызывающая явление переноса (осмоса) и выравнивания химических потенциалов системы, называется осмотическим давлением π. С увеличением концентрации раствора полимера возрастает разность между химическими потенциалами растворителя и раствора. Чем больше становится разность химических потенциалов растворителя и раствора  , тем больше π и тем больше
, тем больше π и тем больше  . Следовательно, осмотическое давление π является функцией концентрации c, т.е. числа растворенных макромолекул полимера. Зависимость осмотического давления от концентрации полимера в растворе выражается уравнением:
. Следовательно, осмотическое давление π является функцией концентрации c, т.е. числа растворенных макромолекул полимера. Зависимость осмотического давления от концентрации полимера в растворе выражается уравнением: .
.
 .
. , на которую понижается температура замерзания растворителя, зависит от числа молекул растворенного вещества – полимера. Это позволяет определять среднечисловую молекулярную массу Mn. Связь
, на которую понижается температура замерзания растворителя, зависит от числа молекул растворенного вещества – полимера. Это позволяет определять среднечисловую молекулярную массу Mn. Связь 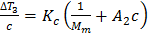 .
.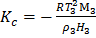 ,
,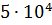 .
. ,
, ,
, ,
, 


