Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лекція № 4. Автолітичні зміни в тушах тварин після забоюСодержание книги
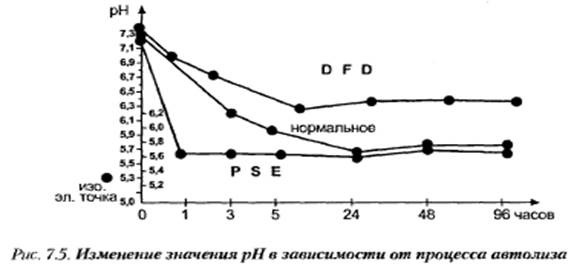
Поиск на нашем сайте 1. Автолітичні зміни у тканинах туш тварин після забою. 2. Кулінарно-технологічні характеристики м’яса у різних стадіях автолізу. 3. М’ясо NOR, DFD, PSE Зміна вологозв’язуючої здатності м'яса в процесі дозрівання. Найбільшою влагоємкістю і здатністю утримувати воду володіє м'ясо в парному стані. рН нативного м'яса 7,2. На початку автолізу рН парного м'яса відносно високий і близький до до нативного (6,6—7,0). Таке незначне зниження рН у перші години після забою зумовлене повільним нагромадженням молочної кислоти і протидією буферних систем тканин зміні рН. Інтервал між рН середовища і ізоелектричною точкою білків м'яса досить великий. Білки м'яса знаходяться в іонізованому стані і володіють високою вологозв’язуючою здатністю. У початковій стадії автолізу, коли кількість АТФ ще залишається на постійному рівні, актин не зв'язаний з міозином. Число вільних гідрофільних груп у білках досить велика і гідратація білків висока. В міру розвитку задубіння вологозв’язуюча здатність м'яса зменшується, досягаючи свого мінімуму до моменту найбільш повного розвитку задубіння. У результаті нагромадження кислих продуктів (молочної, ортофосфорної кислоти), руйнування дикарбонатного буфера і зменшення буферної здатності білків рН м'яса різко зрушується в кислий бік до 5,6—5,2. Інтервал між рН середовища і ізоєлектричної точкою білків м'яса зменшується, внаслідок чого зменшується число іонізованих груп і вологозв’язуюча здатність білків. Велика частина білків взагалі переходить у ізоелектричний стан, що сприяє агрегації білків і зменшенню вологозв’язуючої здатності м'яса. Утворення актоміозина з актину і міозину в процесі розвитку посмертного задубіння супроводжується різким зменшенням гідратації білків міофібрил. Внаслідок стиску актоміозина вичавлюється частина води з м'язів. М’язи стають більш сухими та пружніми, а у вищій крапці посмертного задубіння починає виділятися максимальна кількість води. З початком дозволу задубіння поступово підвищується вологозв’язуюча здатність м'яса. Як наслідок ферментативних гідролітичних перетворень і як результат фізико-хімічних і колоїдно-хімічних змін білків руйнуються структурні елементи м'язового волокна. «Розпушення» білкових структур і збільшення числа вільних гідрофільних груп викликають підвищення вологозв’язуючої здатності м'яса. Інтенсивність наростання її найбільша в першу добу після максимуму задубіння. Надалі вона наростає повільніше. Речовини, які обумовлюють аромат та смак м’яса. Аромат і смак стають ясно відчутними через 2—4 доби після забою при низьких позитивних температурах. Після 5 діб вони виражені добре. Найбільшої інтенсивності аромат і смак досягають на 10—14 добу. При температурах вище 20 °С оптимальні органолептичні характеристики спостерігаються вже через 2—3 доби. Попередниками аромату і смаку є амінокислоти і їхні аміди: гістидин, глутамінова й аспарагінова кислоти, глутамін, гліцин, треонін, фенілаланін, лейцин, а також інші амінокислоти, хоча й у меншому ступені. Ці речовини утворюються і накопичуються в процесі автолізу при розпаді білків і пептидів, зокрема таких природних пептидів, як глютатіон, карнозин, ансерин і ін. Засмага м’яса. Засмага — це своєрідне псування м'яса, що виникає при неправильному збереженні протягом першої доби з моменту забою. Вона виражається в тім, що в глибині товстих частин жирних напівтуш м'ясо здобуває неприємний кислуватий запах, сірувато-червоний чи коричнево-червоний колір. Причиною засмаги є порушення нормального протікання автолітичних процесів внаслідок уповільненого тепло- і газообміну з зовнішнім середовищем. Після забою протягом перших 20— 30 хв спостерігається підвищення температури тіла тварини в межах 0,9—2 °С за рахунок розпаду багатих енергією зв'язків АТФ, КРФ і інших фосфорних сполук. Вивільнювана енергія виділяється у вигляді тепла. У цих умовах автоліз протікає з відносно великою швидкістю. Реакції гліколітичного розпаду йдуть іншим шляхом з утворенням таких продуктів реакції, як сірководень, масляна кислота й інші речовини. Міоглобін має значні перетворення з утворенням пігментів, що змінюють нормальний колір м'яса. Засмага спостерігається при повільному охолодженні жирних туш в умовах поганої циркуляції повітря, коли туші чи частини їх, що зберегли тепло, вкладають щільно, а також якщо з тварин шкіра була знята не відразу; при повільному заморожуванні парного м'яса. Дуже піддано засмазі м'ясо птахів. Особливо легко виникає засмага в тушках качок і гусей внаслідок великого вмісту жиру. При цьому внутрішній жир часто здобуває зелений колір, а тушка (волога) має здебільшого зеленувато-сіру м'яку шкіру. Процес засмаги бесповоротний, але якщо при неглибокій засмазі м'ясо розрізати на шматки і провітрити, ознаки засмаги можуть зникнути.
Питання для самоконтролю 1. Вологоз’язуюча здатність м’яса. 2. Речовини, які обумовлюють аромат і смак. 3. Засмага м’яса.
|
||
|
Последнее изменение этой страницы: 2016-12-15; просмотров: 309; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.220 (0.01 с.) |