
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Отримання гаплоїдів на базі клітин чоловічого гаметофіту.Содержание книги
Поиск на нашем сайте
Отримання гаплоїдів на базі клітин чоловічого гаметофіту. Гаплоидные растения имеют важное значение для селекции, т.к. открывают возможности для ускоренного получения гомозиготных генетически стабильных линий. Для увеличения эффективности индуцирования гаплоидов используют следующие методы: 1. Андрогенез в культуре пыльника и пыльцы 2. Элиминация хромосом в гибридном зародыше 3. Псевдогамия – развитие гаплоидного зародыша после оплодотворения инородной пыльцой без оплодотворения яйцеклетки, или же гиногенез развитие изолированного семязачатка. В основе метода культуры изолированных пыльников лежит феномен андрогенеза in vitro – процесса образования гаплоидного растения-регенеранта из спорогенной клетки пыльника. Достоверно установлено, что спорогенные клетки пыльника способны в условиях in vitro переключать программу своего развития обычного гаметофитного пути на принципиально иной – спорофитный путь. Таким образом, спорогенные клетки в полной мере проявляют свой морфогенетический потенциал, вплоть до развития целого растения-регенеранта, при чем контролируемые условия позволяют управлять этим процессом. Процесс культивирования пыльников связан с реализацией двух путей спорофитного морфогенеза in vitro - калуссогена и соматического эмброгенеза. Получение гаплоидных растений из изолированных пыльников может идти по двум направлениям: прямая регенерация соматических зародышей и косвенная – через каллусогенез. В первом случае внутри пыльников из отдельных пыльцевых зерен формируются проэмбриональные структуры, которые при определенных условиях культивирования развиваются в эмриоиды, дающие начало гаплоидным растениям. Во втором – пыльца делится, но клетки, возникающие в результате деления, быстро увеличиваются в размерах и, разрывая оболочку пыльцевого зерна, образуют каллус. В результате дальнейшего морфогенеза из этих каллусных клеток регенерируют растения. При этом растения могут иметь разную степень плоидности – ди-, поли-, анеуплоидные.
Біотехнологічні методи, які дозволяють зберегти зникаючі породи сільськогосподарських тварин. В животноводстве комплекс методов биотехнологии предусматривает как использование существующих, так и конструирование желаемых генотипов с заданными признаками, которые обеспечивают высокую продуктивность животных и ускоренные темпы их воспроизводства. Ярчайшим примером использования в практике разработанных наукой методов биотехнологии является искусственное осеменение сельскохозяйственных животных, которое за рубежом назвали «открытием века» в сельском хозяйстве. Этот метод, разработанный выпускником Харьковского университета И.И. Ивановым, обеспечивает быстрое и качественное улучшение всего массива поголовья, позволяет использовать в сотни раз меньшее количество производителей, в свою очередь значительно уменьшает затраты на их содержание. Метод искусственного осеменения сейчас широко применяются во всех странах с интенсивным ведением отрасли, но, к сожалению, необходимо констатировать, что в нашей стране значительно ослабла внимание к этому прогрессивного метода, в результате чего уменьшилось применение искусственного осеменения животных не только в овцеводстве и свиноводстве, а в скотоводстве. Метод трансплантации эмбрионов сельскохозяйственных животных. Этот метод не заменяет искусственного осеменения животных, а дополняет его. Сейчас трансплантации эмбрионов включена в многих программ по разведению и селекции животных в разных странах мира, потому что она позволяет интенсивно использовать генетический потенциал выдающихся самок-рекордисток, ускоряет создание высокопроизводительных селекционных стад и семей, упрощает распространение ценных генотипов, в том числе экспорт и импорт животных, способствует улучшению ветеринарно-профилактической работы. Эффективнее практическое применение метода трансплантации эмбрионов оказалось в скотоводстве.
Система формування селекційного матеріалу птахофабрик в Україні. Современные тенденции роста отрасли птицеводства в Украине свидетельствуют о стабильном и динамичном развитии. Современное птицеводство объединяет в себе высочайший уровень механизации и автоматизации производства, являясь при этом наиболее эффективной и наукоемкой отраслью сельского хозяйства Украины, способной в ближайшие годы коренным образом улучшить обеспечение населения высококачественными диетическими продуктами питания и укрепить продовольственную безопасность государства. При этом следует отметить ряд процессов, протекающих в птицеводстве. Наблюдается мировое перераспределение не только рынка производства товарной продукции (пищевое яйцо, мясо цыплят-бройлеров, уток, гусей, страусов и т.д.), но и прежде всего его наукоемкой части (племенная продукция). К ней относятся генетические и племенные ресурсы, в производстве которых наблюдаются тенденции монополизации. Так всемирный рынок производства генетического материала яичной птицы распределен между двумя ведущими фирмами – «Эрик Весйоханн групп», более известной как «Ломанн Тирцухт» и «Хендрикс Генетикс». В мясном птицеводстве подобную тенденцию можно проследить на примере селекционной компании “Aвиаген”, которая объединяет целый ряд торговых марок “Росс”, “Арбор Ейкерс” и “Ломанн Индиан Ривер”. К большому сожалению, отсутствие целенаправленной государственной политики в области поддержки и развития племенных ресурсов ставит отечественного производителя в прямую зависимость от зарубежных фирм. Что касается технологического аспекта, то в последнее время в Украине развивается отечественное конкурентоспособное машино- и оборудостроение (фирмы «Техна», «Нежинсельмаш»), кормопроизводство (фирмы «Кремикс», «Инвек» и др.) и производство ветеринарных препаратов (Национальный научный центр „Институт экспериментальной и клинической ветеринарной медицины” и „Институт птицеводства УААН”). Таким образом, уже сейчас на душу население произведено около 130 шт. яиц и около 15,0 кг мяса птицы в живом весе, которое в перерасчете на мясо в убойном весе составляет около 9,0 кг, из них 7,5 кг составляет мясо бройлеров.
ОЦЕНКА СПЕРМЫ. На племпредприятиях (станциях) и пунктах искусственного осеменения сельскохозяйственных животных прежде всего проводят глазомерную оценку спермы под микроскопом. Для этого на чистое предметное стекло наносят каплю спермы, накрывают ее покровным стеклом и кладут на предметный столик микроскопа. Предметные и покровные стекла заблаговременно моют и просушивают. Исследуемая капля спермы должна быть достаточно большой, чтобы все пространство между покровным и предметным стеклами было заполнено спермой, Глазомерная оценка спермы заключается в приблизительном определении под микроскопом густоты (насыщенности спермиями) и процента живых спермиев с прямолинейным поступательным движением (подвижности). Редкая сперма —в поле зрения микроскопа спермии разбросаны, промежутки между ними допускают свободное их передвижение. Редкую сперму условно обозначают буквой Р. Различают также сперму с оценкой А (азооспермия), когда в поле зрения микроскопа совсем нет или очень мало спермнев. Для достижения разной степени увеличения к микроскопу приложено несколько (2—3) окуляров. Сперму исследуют при температуре 38—40°, для чего используют термостаты или обогревательные столики. В зависимости от количества спермиев, которое наблюдается в поле зрения микроскопа, различают густую, среднюю и редкую сперму. Густая сперма — все поле зрения микроскопа сплошь заполнено спермиями с самыми незначительными промежутками между ними. Густую сперму условно обозначают буквой Г. Сперма средней густоты—в поле зрения микроскопа между отдельными спермиями наблюдаются промежутки, приблизительно равные длине одного спермия. Среднюю сперму условно обозначают буквой С. Кроме густоты спермы, под микроскопом определяют количество живых спермиев, имеющих прямолинейное поступательное движение.
8. Конечная цель экстракорпорального оплодотворения созревших in vitro ооцитов - получение эмбрионов, пригодных для трансплантации. При культивировании ранних эмбрионов крупного рогатого скота в большинстве случаев эмбриональное развитие блокируется на стадии 8-16 клеток, т.е. когда в естественных условиях эмбрионы переходят из яйцевода в матку. Лишь единичные эмбрионы развиваются до стадий поздней морулы или бластоцисты, пригодных для трансплантации. В то же время установлено, что если культивировать in vitro ранние морулы, то можно получить высокий % бластоцист (60-80%) и даже выход эмбрионов из зоны пеллюцида. Инкубацию эмбрионов проводят двумя способами: в яйцеводе кролика, овцы или коровы и культуральных средах. В 1983 г. во ВНИИ генетики и разведения сельскохозяйственных животных был получен живой теленок из созревшего in vitro и экстракорпорально оплодотворенного ооцита. В эксперименте хирургическим методом трансплантировали ранних (2-4-клеточных) эмбрионов в яйцевод коровы. Более совершенен метод, когда используют промежуточного хозяина или временного реципиента — овцу, кролика или корову. Это позволяет получить морулы или бластоцисты для нехирургической пересадки коровам —реципиентам. При этом с помощью перекрестного культивирования можно дважды проводить селекцию эмбрионов на жизнеспособность: первый раз перед пересадкой временному реципиенту и второй раз перед трансплантацией постоянному реципиенту. В зависимости от вида временного реципиента выход морул и бластоцист составляет 23-73%. Более перспективным направлением исследований является получение эмбрионов in vitro на стадии поздней морулы или бластоцисты, пригодных для трансплантации эмбрионов нехирургическим методом в матку коровы -реципиента. Для культивирования эмбрионов in vitro разработаны культу-ральные среды. Установлено, что ранние эмбрионы очень чувствительны к изменениям осмотического давления среды и рН, поэтому для культивирования эмбрионов in vitro применяют хорошо сбалансированные питательные среды: ТС-199, ХЭМ-Ф-10, МРМ, солевые растворы Дюльбекко, Брингстера с различными биологическими и синтетическими добавками. Среду меняют через сутки. Первый контроль за развитием зародыша проводят через 24 ч после оплодотворения. Если оплодотворение прошло нормально, то можно обнаружить второе полярное тельце и борозду дробления. При питогенетическом и гистологическом анализе выявляют анафазу П, сформированные мужской и женской пронуклеусы, синкарион, первое деление дробления. Сингамия, т.е. вступление в тесный контакт пронук-леусов, в результате чего происходит окончательное слияние мужской и женской гамет, наблюдается через 19 ч после экстракорпорального опло- дотворения, первый митоз через 21 ч и образование двухклсточного эмбриона через 22 ч. В стандартных синтетических средах культивирования у большинства эмбрионов на стадиях 8-16 бластомеров наступает блокирование развития, что связано с несовершенством синтетических сред. Предполагают, что этот блок развития ранних эмбрионов можно преодолеть через культивирование эмбрионов на однослойных клеточных популяциях - монослоях. В качестве таких однослойных клеточных популяций используют монослой яйцевода, гранулезные клетки и клетки трофобласта эмбриона или амниона. В указанных клеточных популяциях предполагается наличие ростстимулирующего фактора, природа и синтез которого изучаются.
9. Первые работы в области развития метода культуры изолированных тканей растений относятся к концу XIX и началу XX вв. и связаны с именами таких выдающихся немецких ученых, как H. Vöchting (1892), K. Rechinger (1893) и H. Haberlandt (1902). H. Vöchting (1892) в своих исследованиях сделал попытку установить минимальный размер экспланта. Он выращивал тонкие срезы корня свеклы и одуванчика, сегменты стебля тополя на песке с применением водопроводной воды без стерильных условий. Эти исследования показали, что каллус образуется при толщине среза не менее 1,5 мм. Еще в XIX в. H. Vöchting провел ряд экспериментов, убедительно доказывающих полярность как органов, так и клеток. H. Haberlandt (1902), в свою очередь, впервые высказал идею о возможности культивирования in vitro изолированных клеток растений. Он наблюдал сохранение живыми клеток мезофилла листа в течение нескольких дней. Но для культивирования он выбрал ассимилирующие зеленые клетки – зрелые и высокодифференцированные, утратившие способность к меристематической деятельности. Поэтому результаты его экспериментов оказались отрицательными. Не достигнув экспериментальных успехов, эти исследователи высказали ряд идей и гипотез, подтвержденных значительно позже. Так, H. Vöchting при изучении полярности пришел к выводу, что она свойственна не только органам растения, но и отдельной клетке. H. Haberlandt выдвинул гипотезу о тотипотентности любой живой клетки. Длительный период (1902-1922 гг.) исследователи пытались создать подходящую среду и благоприятные условия для выращивания изолированных органов, тканей и клеток. Своей работой они внесли значительный вклад в развитие метода культуры клеток и тканей высших растений (Lamprecht, 1918; Knudson, 1919; Molliard, 1921; и многие другие; цит. по: Бутенко, 1964). Наиболее успешный период в развитии этого метода начался с работ R. Gautheret (1932) и F. White (1931), которые показали способность каллусов и тканей растительных опухолей к неограниченному росту при переносе на свежие питательные среды. В настоящее время клеточная биотехнология имеет в своем распоряжении ряд методов, основными из которых, помимо культивирования клеток и тканей отдельных растений, являются: 1) методы клонального микроразмножения, включающие индукцию органогенеза и соматического эмбриогенеза; 2) методы изолирования протопластов и получения соматических гибридов; 3) методы получения гаплоидных растений и производных от них дигаплоидов; 4) методы генетической трансформации с последующей регенерацией модифицированных растений. Основой методов культуры изолированных клеток и тканей растений является уникальное свойство растительных клеток – тотипотентность. Под ним подразумевается способность растительной клетки при определенных условиях вторично дифференцироваться и под влиянием внешних условий выбирать тот или иной путь морфогенеза (Батыгина и др., 1978; Бутенко, 1984; Беккер и др., 1990). Морфогенез является сложным процессом, регуляция которого осуществляется на клеточном, тканевом и организменном уровнях. В этом процессе участвуют взаимозависимые факторы, определяющие190 процессы деления, растяжения, дифференциации, старения и гибели клеток. В ходе морфогенеза возникают сформированные заново ткани и органы, и соответствующие этому процессы носят названия, отражающие существо морфогенеза - гистогенез, ризогенез, геммогенез (образование листьев или побегов), флоральный геммогенез (образование цветков и (или) отдельных элементов цветка) и соматический эмбриогенез. Полученное в результате морфогенеза in vitro растение носит название растения-регенеранта. В настоящее время при использовании современных методических подходов растение любого вида может быть теоретически регенерировано из каллусной ткани, хотя определилось представление о трудных для регенерации видах и генотипах. Для многих видов растений разработаны несколько методов регенерации. Методы генной иммунизации Новый подход, позволяющий индуцировать у организма иммунный ответ без введения антигена, основан на включении в клетки животного-мишени гена, кодирующего белок-антиген. В первых экспериментах такого рода Е. соli-плазмиду, конъюгировали с микрочастицами золота и бомбардировали ими клетки уха мыши. Впоследствии выяснилось, что клонированную кДНК можно вводить в клетки и с помощью внутримышечной инъекции раствора с большим количеством плазмиды, несущей соответствующую ДНК. Этот подход позволяет избежать очистки антигена, что требует много времени и средств, или использования для создания вакцины технологии рекомбинантных ДНК. Кроме того, получаемые с его помощью белки с большей вероятностью подвергаются правильной посттрансляционной модификации, чем белки, синтезируемые организмами-хозяевами. Этот метод, получивший название генной иммунизации, можно использовать для вакцинации домашних животных. Перспективы генной иммунизации были тщательно изучены. ДНК-иммунизация позволяет не только избежать очистки белковых антигенов, но и индуцировать иммунный ответ, направленный именно на кодируемый плазмидой белок, а не на саму плазмиду. Поэтому один и тот же вектор можно использовать для доставки разных белков или для многократного введения одного и того же гена. Судьба введенной в клетку ДНК точно неизвестна. В принципе она может интегрировать в геном хозяина с весьма серьезными последствиями, если при этом затрагивается какой-то важный ген или происходит злокачественная трансформация клетки. Такая ДНК какое-то время просуществует в клетке в виде нереплицирую-щегося внехромосомного элемента, а затем разрушится. Генную иммунизацию пока используют для выработки иммунитета к некоторым патогенным микроорганизмам (вирусу гриппа А, вирусу иммунодефицита человека типа I, вирусу бычьего герпеса, вирусу бешенства) у животных, но не у человека. Для облегчения доставки ДНК в клетки животных при проведении генной иммунизации был создан модифицированный штамм Shigella flexneri. Эта бактерия проникает в эпителиальные клетки животных путем фагоцитоза, и присутствующая в ней плазмидная ДНК попадает в цитоплазму клетки-хозяина, где и происходят транскрипция и трансляция переносимого ею гена, находящегося под контролем эукариотического промотора. Эксперименты, в которых в качестве вектора для доставки ДНК в клетки использовалась Shigella, были проведены на морских свинках, и хотя они оказались успешными, судить о безопасности данной системы можно будет лишь после проведения клинических испытаний. Огромным преимуществом этого подхода является возможность перорального введения вакцин. Среда Мурасиге — Скуга, Макросоли: Микросоли: Суспензійні культури рослин Суспензионные культуры - отдельные клетки или группы клеток, выращиваемые во взвешенном состоянии в жидкой среде. Представляют собой относительно гомогенную популяцию клеток, которую легко подвергнуть воздействию химических веществ. Суспензионные культуры широко используются в качестве модельных систем для изучения путей вторичного метаболизма, индукции ферментов и экспрессии генов, деградации чужеродных соединений, цитологических исследований и др. Признаком "хорошей" линии служит способность клеток к перестройке метаболизма и и высокая скорость размножения в конкретных условиях культивирования. Морфологические характеристики такой линии:
Клеточную суспензию получают, помещая каллусную ткань в колбу с жидкой питательной средой. Суспензия перемешивается в колбе на качалке, имеющей скорость перемешивания 100 - 120 об/мин. При первом переносе на свежую среду удаляют крупные кусочки исходного каллуса и крупные агрегаты, фильтруя через 1 - 2 слоя марли, нейлоновые сита, шприц с соответствующим отверстием. Для инициализации суспензионной культуры необходимо 2 - 3 г свежей массы каллусной культуры на 60 - 100 мл жидкой питательной среды. Однако для каждой линии культуры клеток существует минимальный объем инокулята, при меньшем размере которого культура не растет Для культивирования суспензий в производственных масштабах применяется аппаратура, разработанная для микробиологической промышленности, однако исследования последних лет показали, что растительные клетки в силу своих специфических особенностей требуют особых сосудов для культивирования. Клетки растений в десятки, сотни раз крупнее клеток бактерий и грибов, кроме того, их размеры меняются в процессе онтогенеза. Если в начале экспоненциальной фазы роста они мелкие и плотные, то в стационарной фазе роста они сильно увеличиваются в размерах и вакуолизируются. Чем крупнее становится клетка, тем больше возрастает опасность ее механического повреждения в процессе перемешивания. В то же время клетки растений, крупные и тяжелые, требуют эффективного перемешивания. Оседание их приводит к появлению «мертвых» зон в сосудах, в которых происходит быстрое накопление и старение клеток. Для культуры клеток женьшеня отрицательное влияние механического стресса при выращивании в ферментере с турбинными мешалками сказывалось на жизнеспособности клеток уже при скоростях мешалок свыше 100—350 об/мин, это отрицательно влияло на синтез ими антрахинонов. Устойчивость штамма к механическому стрессу является важным требованием к культуре и трудной задачей для исследователей.
31 вопрос Для проверки качества спермы необходимо использовать подогретые предметные и покровные стекла, находящиеся во время работы на обогреваемом столике микроскопа. Для взятия пробы на исследование вращательными движениями сперму смешивают, приоткрывают пробку флакона и берут стерильной стеклянной палочкой или пастеровской пипеткой каплю спермы и помещают на предметное стекло. Флакон со спермой немедленно закрывают пробкой и помещают обратно в термос. Дают сперме нагреться до 38°С на обогревательном столике микроскопа. После чего при увеличении микроскопа в 100-180 раз отыскивают поле зрения с наибольшей подвижностью спермиев.
Аттенуированная вакцина Аттенуированная вакцина - препарат для создания иммунитета к различным инфекционным заболеваниям у человека и животных. Вакцины получают либо из ослабленных живых или мертвых инфекционных агентов, из продуктов жизнедеятельности микроорганизмов, их антигенов синтезированных генноинженерным или химическим путем. Аттенуированная вакцина - значит ослабленная т.е. та, которая изготавливается из живых ослабленных микроорганизмов. При введении в организм такой вакцины начинается вакцинальная инфекция без выраженных клинических признаков, в результате которой развивается стойкий длительный иммунитет. Примером таких вакцин могут быть вакцины против кори, краснухи, а также комбинированные вакцины для животных. ВАКЦИНЫ готовят из микроOрганизмов, обладающих максимально выраженной иммуногенностью. Их выращивают (на биопредприятиях), затем инактивируют t°С (55-60° в течение 1часа), УльтраФиолетом или химическими веществами (формалин, фенол, спирт и др) в условиях, исключающих денатурацию антигенов. Для профилактики – брюшного тифа, паратифов А и В, коклюша, бруцеллёза, лептоспироза… Для лечения – при вялотекущих и хронических инфекциях: бруцеллёз, туляремия, дизентерия, гоноррея, коклюш.
Клеточная селекция Одно из направлений клеточных технологий — это использование их в селекции, которое облегчает и ускоряет традиционный селекционный процесс в создании новых форм и сортов растений. Существующие методы культивирования изолированных клеток и тканей in vitro условно можно разделить на две группы. Первая группа — это вспомогательные технологии, которые не подменяют обычную селекцию, а служат ей. К ним можно отнести: оплодотворение in vitro (преодоление прогамной несовместимости), культивирование семяпочек и незрелых гибридных зародышей (преодоление постгамной несовместимости), получение гаплоидов путем культивирования пыльников и микроспор, криосохранение изолированных клеток, тканей и органов, клональное микроразмножение отдаленных гибридов. Вторая группа методов ведет к самостоятельному, независимому от традиционных методов селекции, получению новых форм и сортов растений: клеточная селекция с использованием каллусной ткани, соматическая гибридизация (слияние изолированных протопластов и получение неполовых гибридов), применение методов генной инженерии. В отдаленной гибридизации находят применение такие методы культуры изолированных тканей, как оплодотворение in vitro, эмбриокультура (выращивание изолированных зародышей на искусственных питательных средах), клональное микроразмножение ценных гибридов, а также получение гаплоидов in vitro и криосохранение. Оплодотворение in vitro (преодоление прогамной несовместимости) проводится в том случае, когда невозможно осуществить оплодотворение между выбранными парами в естественных условиях. Это вызвано несколькими причинами: 1) физиологические (несоответствие во времени созревания пыльцы и т. д.); 2) морфологические (короткая пыльцевая трубка или блокирование роста ее на разных этапах развития и т. д.). Оплодотворение in vitro можно осуществить двумя способами: а) культивирование на искусственной агаризованной питательной среде завязи с нанесенной на нее готовой пыльцой; б) завязь вскрывается и на питательную среду переносятся кусочки плаценты с семяпочками, вблизи которых или непосредственно на ткани плаценты культивируется готовая пыльца. Визуально определить, прошло оплодотворение in vitro или нет, можно по быстро увеличивающимся в размерах семяпочкам. Постгамная несовместимость при отдаленной гибридизации возникает после оплодотворения. Часто при этом образуются щуплые невсхожие семена. Причиной может быть расхождение во времени развития зародыша и эндосперма. Применение эмбриокультуры в селекции приобретает в последнее время большое значение для получения отдаленных гибридов зерновых, злаковых и других сельскохозяйственных культур. Показана возможность увеличения выхода пшенично-ржаных гибридов путем доращивания незрелых зародышей, а также использования эмбриокультуры для преодоления постгамной несовместимости при гибридизации пшеницы с колосняком.
Отримання гаплоїдів на базі клітин чоловічого гаметофіту. Гаплоидные растения имеют важное значение для селекции, т.к. открывают возможности для ускоренного получения гомозиготных генетически стабильных линий. Для увеличения эффективности индуцирования гаплоидов используют следующие методы: 1. Андрогенез в культуре пыльника и пыльцы 2. Элиминация хромосом в гибридном зародыше 3. Псевдогамия – развитие гаплоидного зародыша после оплодотворения инородной пыльцой без оплодотворения яйцеклетки, или же гиногенез развитие изолированного семязачатка. В основе метода культуры изолированных пыльников лежит феномен андрогенеза in vitro – процесса образования гаплоидного растения-регенеранта из спорогенной клетки пыльника. Достоверно установлено, что спорогенные клетки пыльника способны в условиях in vitro переключать программу своего развития обычного гаметофитного пути на принципиально иной – спорофитный путь. Таким образом, спорогенные клетки в полной мере проявляют свой морфогенетический потенциал, вплоть до развития целого растения-регенеранта, при чем контролируемые условия позволяют управлять этим процессом. Процесс культивирования пыльников связан с реализацией двух путей спорофитного морфогенеза in vitro - калуссогена и соматического эмброгенеза. Получение гаплоидных растений из изолированных пыльников может идти по двум направлениям: прямая регенерация соматических зародышей и косвенная – через каллусогенез. В первом случае внутри пыльников из отдельных пыльцевых зерен формируются проэмбриональные структуры, которые при определенных условиях культивирования развиваются в эмриоиды, дающие начало гаплоидным растениям. Во втором – пыльца делится, но клетки, возникающие в результате деления, быстро увеличиваются в размерах и, разрывая оболочку пыльцевого зерна, образуют каллус. В результате дальнейшего морфогенеза из этих каллусных клеток регенерируют растения. При этом растения могут иметь разную степень плоидности – ди-, поли-, анеуплоидные.
|
||||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 198; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.225.56.79 (0.016 с.) |

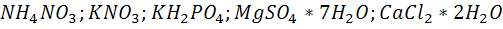 . Эти соли дают восстановленный азот
. Эти соли дают восстановленный азот 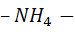 ,который входит в белок,нуклеотиды. Дает фосфор,калий,магний и т.д.
,который входит в белок,нуклеотиды. Дает фосфор,калий,магний и т.д.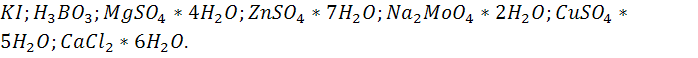 Даёт I,B,Mo.
Даёт I,B,Mo.


