
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Критерії перебігу довільних процесівСодержание книги
Поиск на нашем сайте
Отже, за зміною величин ∆А та ∆G можна робити висновок про напрямок довільних процесів при const=T Та V, T та P. (на Противагу зміні енергії при U=const і V=const В ізольованій системі… А при використанні Т/д потенціалів такі критерії
dA ≤ 0 dG ≤ 0
Т/д потенціали – довільніші критерії напрямленості процесів в закритих система. Отже, якщо розрахувати зміну Т/д потенціалу процесу, то за знаком ∆G або ∆А можна зробити висновок про можливість і напрямок йоно перебігу.
Хімічний потенціал У багатокомпонентних відкритих системах склад і маса кожного компоненту змінюються, що впливає на енергетичний стан кожного учасника і всієї системи загалок. Тому Т/д – потенціали (А та G) для відкритих систем залежить не тільки від зовнішніх умов, але й від кількості кожного з учасників: А= f (T,V,n1,n2,……ni) де n1,n2,…..,ni. кількість молей.. G== f (T,p,n1,n2,……ni) компонентів…? Нагадаймо G=H-TS. (як і: А = U- TS) Звідси: dA = dU – TdS - SdT Оскільки TdS ≥ dU + pdV (об’єднаний вираз І та ІІ начал термодинаміки) dU – TdS ≤ - pdV dA ≤ - pdV - SdT
Неважко показати dG ≤ Vdp - SdT Якщо диференціювати ці фунції за кількістю молей усіх учасників отримуємо
Часткова похідна Г або А усієї усієї системи при зміні вмісту ііншого учасника на 1 моль за умови сталої концентрації усіх інших учасників і зовнішніх параметрів називається парціальним молярним потенціалом ( Отже:
Можна дійти висновку, що Т/д потенціали (вільна енергія характеризують енергетичний стан речовини в багатокомпонентній системі. Для індивідуальної речовини поняття молярного Т/д і хімічного потенціалів є ідентичні, т.т.
Пригадаймо: dG ≤ Vdp - SdT При T=const dG ≤ Vdp Для ідеального газу:
Тому і-го компоненту ідеального газу.
Інтегрування при Т= const Призводить до: μ=RTln
За стандартних умов Р= 1атм = 1.033·105 Па const = μi = Р* - тиск індивідуального газу,
Для реального газу: μi =
f =γp Фугітивність має розмірність тиску і пропорційне йому. Коефіцієнт пропорційності має назву коефіцієнту фугітивності. Для розчинів замість ффугітивності застосовують величину активності а a=γ1·C γ- коефіцієнт активності. Хімічний потенціал реального розчину має вираз μi =
Коефіцієнт активності дозволяє враховувати відхилення властивостей реального розчину від властивостей цього розчину в ідеальному стані. Зміна вільної енергії Гіббса при утворенні ідеального розчину.
∆G = nRT (XAlnXA+XBlnXB) XA, XB - мольні частинки, менші за 1 Тому lnXA, lnXB, ∆G - від’ємні величини. 3.7. Теплота випаровування рідини. Зв'язок між при хованою молярною теплотою випаровування та температурою. Леткість. Температура кипіння розчинників. Розчинення речовин відбувається з виділенням або поглинанням тепла, а іноді із зміною об’єму. Ці явища свідчать про хімічну взаємодію між розчиненою речовиною і розчинником. Експериментально встановлено, що у водному розчині відбувається утворення гідратів (для неводних розчинів – сольватів), які є порівняно нестійкими сполуками розчинених частинок з розчинником. Тепловий ефект, що супроводжує процес розчинення, відносять до одного молю розчиненої речовини і називають молярною теплотою розчинення, відповідно можно говорити про молекулярну теплоту випаровування.
Щоб дана рідина закипіла, тиск її парів повинен бути однаковим із зовнішнім тиском. При барометричному тиску 760мм.рт.ст. (101,3 кПа) для води це буде температура 1000 С. Здебільшого з розчину під час кипіння видаляється тільки розчинник, внаслідок чого концентрація розчину підвищення температури кипіння. Отже розчин кипить не при певній температурі, а в деякому температурою кипіння. Різниця між температурою кипіння розчину і чистого розчиника називається підвищенням температури кипіння розчину (∆t кип). ∆t кип = Де Всяка рідина починає кипіти при тій температурі, при яких тиск її насиченої пари досягає величини зовнішнього тиску. Наприклад, вода під тиском 101,3 кПа кипить при 1000 С тому, що при цій температурі тиск водяної пари якраз дорівнює 101,3 кПа. Якщо ж розчинити у воді яку-небудь нелетку речовину до 101,3 кПа треба нагріти його вище 1000 С. Звідси виходить, що температура кипіння розчину завжди вища за температуру кипіння чистого розчинника.
Вивчаючи кипіння розчинів, Рауль установив, що для розбавлених розчинів неелектролітів підвищення температури кипіння: ∆t кип = Em m – мольно – масова концентрація (молярність); E- ебуліоскопічна сталь, що залежить тільки від природи розчинника, але не залежить від природи розчиненої речовини. Для води ебуліоскопічна стала E дорівнює 0,52,для бензолу E = 2,6. Леткість – це властивість розчину або рідини до випаровування, або перетворення в газоподібний стан.
|
||||
|
Последнее изменение этой страницы: 2016-09-19; просмотров: 280; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.41 (0.006 с.) |


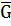 i,
i,  i) даного іншого учасника, або хімічним потенціалом.
i) даного іншого учасника, або хімічним потенціалом.

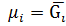 i
i 
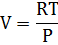
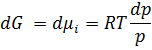
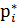 + const
+ const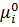


 футивність (замічть тиску). Фугітивніть – це величина тиску реального газу, при підстановці якої у рівняння можна застосувати для описання поведінки реальних газів.
футивність (замічть тиску). Фугітивніть – це величина тиску реального газу, при підстановці якої у рівняння можна застосувати для описання поведінки реальних газів.
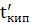 - t кип
- t кип 


