
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Диспергаційні методи одержання колоїдних систем.Содержание книги
Поиск на нашем сайте
Вони полягають у подрібненні великих частинок до колоїдного стану. Диспергування потребує роботи на утворення нової поверхні. Це супроводжується збільшенням вільної поверхневої енергії системи. Залежно від типу витраченої енергії дисперргаційні методи поділяють на: 1)механічні. 2) електричні 3)акустичні.
Механісне диспергування проводять звичайно у спеціальних промислових і лабороторних пристроях – млинах (англ. Mill). Наупоширеніші є кульові (рос. ”шарові” нім. Kugel) та планетарні млини, а також ат ритори і фарботерки. В них звичайно подрібнюють речовину до частинок діаметром (10-4 -10-5 м). Тонкий помел проводять у вібромлинах та колоїдних млинах. У них диспергування проводять у рідкому середовищі з одержанням суспензій тп емульсій. Звичайно це роблять у присутності речовини, що стабілізують дисперсію: ПАР, електролитів, ВМС. Роль цих речовин полягає не тільки у стабілізації дисперсій, але ц у сприянні фізико-хімічним процесам руйнування твердих тіл. Ефект ребіндера. Працями академіка П,А. Ребіндера показано, що молекули поверхнево-активних речовин адсорбуються у місцях дефектів кристалічної гратки твердих тіл, зокрема у мікротріщенах, т.т. в тиї місцях, де величина поверхневого натягу більша порівняно з іншими ділянками поверхні твердого тіла. Адсорбція ПАР спричинює виділення вільної поверхневої енергії, внаслідок чого диспергування полегшується. Адсорбція. Адсорбція електролитів сприяє виникненню сил взаємного електростатичного відштовхування адсорбційних шарів, розташованих на протилежних боках мікротріщин. Виникає своєрідний розклинювальний ефект, який сприяє руйнуванню твердого тіла (рис.5.5.) Рис.5.5.
Це явище називають ефектом Ребіндера. Він є дуже поширеним у природі, і його намагаються використовувати в технологіях, зокрема в технологіях, зокрема диспергування. Як показано на рис.5.5., рідина, що добре змочує поверхню твердого тіла, потрапляючи у мікротріщину, утворює рідинний клин. Він викликає адсорбційне пониження міцності і створює розклинювальний тиск (Рр), який діє протилежно до дії стягування увігнутого меніску – так званого лапласового тиску (Рл). Тиск Рр значно перевищює Рл. Поєднання цих сил сприяє розщепленню твердого тіла у напрямку площин мікротріщини. Універсальність і фундаментальність цього явища пов’язані зі зменшенням поверхневої енергії. Майже для усіх твердих тіл є і можуть бути знайдені такі середовища, які забезпечують компенсацію поверхневої енергії та зменшення поверхневого натягу. В технології виготовлення друкарських фарб при диспергуванні пігментів слід підбирати складові композиції зв’язуючих сполук і добавок, аби використовувати ефект Ребіндера. 5.3.2.3. Електричні методи диспергування. Вони засновані на випаровуванні металу в електричній дузі, коли електроди занурені у рідину. При конденсації пари металу з якого виготовлено електроди, утворюється колоїдна система. Для отримання стабільних золів у рідину (найчастіше – це вода) вводять добавки полімерів або (і) ПАР. Метод має обмежене застосування: так одержують гідро золі тільки з благородних металів. 5.3.2.4. Акустичні методи диспергування. Вони засновані на використанні енергії напрямленого ультразвукового поля. Диспергування відбування відбувається внаслідок кавітаційного руйнування. Кавітація – утворення та розкладання порожнин і пустот при чергуванні стиснень і розряджень у рідині. Таке явище викликає значні руйнівні сили. Приклади: руйнація поверхні грібних гвинтів, корпусів суден. Кавітаційні руйнівні сили спроможні диспергувати рідини з утворенням суспензій. На основі кавітаційних методів були запропонованні технології виготовлення друкарських фарб. Якщо порівнювати конденсаційні та диспергаційні методи, то для одержання дисперсійних систем з максимальним ступенем дисперсності (1·10-7-1·10-9м) придатні тільки методи конденсації, які майже не потребують енергетичних втрат. Але на сьогодні важливіше практичне значення мають методи диспергування. В.Ш.: ОТТ: запропонувати конденсат. Методи у поєднанні з диспергаційними -???? Методи для полімер. матер. В.Ш.: УВЧ – ультразвук – в медицині лікування нежиті. - утворення емульсії і оксидація мікробів. - використання медичного обладнання для технологій малих об’ємів (обсягів). 5.4. Методи очищення колоїдних розчинів. При одержанні колоїдних розчинів, надто за допомогою хімічних реакцій, практично неможливо наперед визначити потрібне кількісне співвідношення реагентів. Через це в утворених золях може бути надто очищати від електролітів, як і від різноманітних низькомолекулярних домішок. Очищення колоїдних розчинів здійснюють або методом діалізу (електродіалізу) або ультрафільтруванням. Діаліз це вилучення із золів низькомолекулярних речовин чистим розчинником через напівпрозору мембрану, через яку не проходить колоїдні частинки. Приклад для діалізу – діалізатор. Змінюючи періодично або безперервно розчинник у діалізаторі можна видалити з колоїдного розчину низькомолекулярних речовин. Рис.5.6.(а). Недоліком цього методу є надзвичайна повільність процесу очищення, який може тривати тижні та місяці.
Електродіаліз Суттєво прискорити (до годин і навіть хвилин) процес очищення дозволяє діаліз із застосування електричного струму – електродіаліз. Найпростіший електродіалізатор являє собою посудину, розділену двома мембранами на три камери (рис.5.6.(б)). В середню камеру наливають очищуваний колоїдний розчин. У бічні камери ставлять електроди від джерела постійного струму і забезпечують приплив і стік розчинника. Під дією електричного поля відбувається перенесення катіонів до анодної камери, а аніонів – до катодної камери. Ультрафільтрування Це фільтрування кол. Розчину через напівпроникну мембрану, що пропускає дисперсійне середовище з низькомолекулярними домішками і затримує частинки дисперсійної фази. Для прискорення процесу ультрафільтрації проводять з перепадом тиску з двох боків мембран: або під вакуумом, або під тиском. Можна говорити про вакуумне фільтрування або про друк-фільтрування. Аби мембрана не руйнувалась при перепаді тиску її розміщують на твердій пористій пластині. Рис.5.7.
Ультрафільтрування дозволяє швидше очистити кол. розчин. ніж методом діалізу. Ультрафільтрування може бути поєднане з електродіалізом – електроультрафільтрування. Шляхом відсовування дисперсійного середовища через ультрамікропоруваті мембрани можна концентрувати колоїдний розчин. Як мембрани використовують спеціальні фільтри (целофан, пергамент, азбест, керамічні фільтри, тощо). Застосування мембран з певним розміром пор дозволяє розділити колоїдні частинки на фракції за розміром і оцінити ці розміри. Тобто цей метод є не тільки методом очищення, але і методом дисперсійного аналізу, а також методом препаративного розділення дисперсійних систем. Оптичні властивості дисперсних систем. На відміну від істинних розчинів колоїдні розчини мають оптичні властивості, зумовленні їхніми головними ознаками: дисперсністю та гетерогенністю. Проходження світла крізь дисперсійну систему супроводжується явищами заломлення, поглинання, відбиття і розсіювання світла. В залежності від співвідношення між довжиною хвилі світла і розміром частинок (λ)D(d) (завислих), переважає якесь з цих явищ. У грубо дисперсних системах розмір частинок (d) перевищує довжину хвилі (λ) видимого світла. Це сприяє відбиттю світла від поверхні частинок. У високодисперсних долях розмір частинок співмірний з довжиною хвилі (λ), в результаті чого переважає світлорозсіювання. Особливо інтенсивно світло розсіювається у клоїдно-дисперсних та ультрамікрогетерогенних системах з розміром частинок (10-7·10-9м). Коли лінійні розміри частинок менші за λ падаючого світла, спостерігається дифракція: світлові хвилі огинають частинки і змінюють свій покатковий напрямок. Це є причиною опалесценції – матового світіння, найчастіше блакитного. З опалесценцією пов’язаний ефект Тиндаля, або явище конусу Тиндаля: Якщо освітлювати золь збоку, а світлорозсіювання спостерігати на темному фоні (звичайно, під кутом 900), то спостерігач бачить каламутний конус, що світиться. За таких же умов чисті рідини та молекулярні (істинні) розчини подібного ефекту не дають. Отож, за допомогою дуже простого експерименту можна встановити природу розчину: колоїдній чи молекулярний або йонний. Теорія опалесценції (світлорозсіювання) для сферичних частинок, що не поглинають світло, була розвинута Дж. Релеєм (1871 р.). Загальна інтенсивність світла, що розсіюється одиницею об’єму дисперсної системи
Де n1 і n0 - показники заломлення дисперсної фази (n1) та дисперсійного середовища (n0); v – кількість частинок в одиниці об’єму; <v > - об’єм однієї частинки (середній);
Якщо вираз
Отже: 1) розсіювання світла тим значніше, чим більше величина показника заломлення дисперсної фази n1 відрізняється від n0 дисперсного середовища. Якщо n0=n1, то свытло не розсыюэться. 2) Оскільки 3) Чим більша кількість частинок і їхній об’єм, тим розсіювання більше. Рівняння Релея дає змогу визначити розміри частинок (об’єм v і радіс r, якщо відома кількість частинок v). На рівнянні релея засновані оптичні методи аналізу дисперсних систем, т.т. вивчення складу та структури дисперсій. Оптичними методами визначають: -- дисперсність системі; --форму і будову частинок дисперсної фази; --поруватість; --товщину і склад адсорбційних шарів і плівок, тощо. Одним з поширених оптичних методів дослідження дисперсних систем є нефелометрія та турбідиметрія. В основу метода нефелометрії покладений ефект опалесценції. Турбідіметрія має аналогом звичайний метод поглинання світла за законом Бугерп-Ламберта-Бера, т.т. ослаблення світлового потоку
Цими методами визначають композицію дисперсних частинок (і їхню середню величину). У виразі (с=νvp), де (р) – густина (питома, специфічна вага). Звідси випливає: νv= Отже Методи оптичної ультрамікроскопії та електронної мікроскопії Принцип методу ультрамікроскопії полягає в тому, що, використовуючи звичайний оптимічний мікроскоп з високою роздільною здатністю, об’єкт розглядають при бічному освітленні. За допомогою інтенсивного джерела світла і системи лінз створюється яскравий пучок світла, який проходить через колоїдний розчин, не потрапляючи в око спостерігача, безпосередньо на фотоприймач. Завдяки світлорозсіюванню видимі окремі колоїдні частинки, як окремі світлі точки (що світяться) на тесному фоні. Для того, аби в полі зору Мікроскопа можна було розрізнити окремі частинки, їхня концентрація повинна бути незначною. Ультрамікроскоп дозволяє бачити частинки у вигляді світлих точок з лінійними розмірами в межах 10-300нм. За його допомогою можна встановити швидкість руху окремих частинок (у розчині), концентрацію частинок в об’ємі, спостерігати коагуляцію (укрупнення, злипання) окремих частинок у вигляді злиття двох світлих точок, оцінювати форми частинок. Якщо прийняти для частинок сферичну або кубічну форму, то можна розрахувати розміри частинок – радіус r або довжину ребра l. Звичайно треба знати масову концентрацію дисперсної фази: C=pνV (як і вище для нефелометрії). Оскільки V = r3,a Електронна мікроскопія – це один із сучасних методів визначення розмірів і форми частинок. Роль світла в електронній мікроскопії відіграє потік електронів, а роль оптичних лінз – електромагнітні лінзи. Цікаво, що в площі досліджень з метою вдосконалення електронних мікроскопів Денісом Габором було винайдено голографію. За допомогою електронного мікроскопа можна побачити форму та будову колоїдних частинок і точно визначити їхні розміри. Електронний мікроскоп дає збільшення у сотні тисяч разів, тобто на 5-6 порядків. Суттєві недоліки електронної мікроскопії – неможливість спостерігати зразок у динамічних умовах. Зразок препарується або у вигляді тонкого зрізу або відбитку на вторинному матеріалі, наприклад напиленому вуглецю.
Електричні властивості колоїдно-дисперсних систем Ми вже розглядали питання утворення ПЕШ (при аналізі міцел). Теорія ПЕШ має велике значення, що виходить далеко за межі курсу колоїдної хімії і навіть електрохімії. Електричні міжфазові явища визначають іонообмінну адсорбцію, електрокінетичні явища, ефекти стабілізації та коагуляції дисперсних систем. Вони ж визначають електродні, мембранні, біологічні та інші процеси. Причини електрокінетичних явищ полягає в тому, що на межі поділу фаз через надлишок поверхневої енергії на між фазових поверхнях виникає ПЕШ, який,як і адсорбція, є результатом взаємодії фаз, що стинаються. Механізм утворення подвійного електричного шару. Поставимо питання:Які ж причини зумовлюють виникнення зарядів на поверхні? Яка будова шарів електричних зарядів? Які явища мають місце при дії зовнішнього електричного поля на заряджені поверхні? Систему просторового розділення зарядів на межі поділу фаз називають подвійним електричним шаром (ПЕШ).
|
||||
|
Последнее изменение этой страницы: 2016-09-19; просмотров: 762; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.254.177 (0.008 с.) |

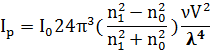
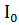 - інтенсивність світла, що падає на поверхню (передню стінку посудини);
- інтенсивність світла, що падає на поверхню (передню стінку посудини); – довжина хвилі світла, що падає.
– довжина хвилі світла, що падає. то
то 
 , то розсіюється повинно сильно залежати від спектрального складу світла: для синього світла (
, то розсіюється повинно сильно залежати від спектрального складу світла: для синього світла ( -400 нс) воно має бути більшим, ніж для черного (
-400 нс) воно має бути більшим, ніж для черного ( .
. і отже
і отже  При використанні певного постійного джерела світла та при даних дисперсній фазі і дисперсійному середовищі величини (
При використанні певного постійного джерела світла та при даних дисперсній фазі і дисперсійному середовищі величини ( ) зберігають стале значення.
) зберігають стале значення. Це рівняння є основою для розрахунків при нефелометричних (спостереження перпендикулярно (нормально) до напрямку освітлення) та турбідиметричних (напрямок освітлення і спостереження або реєстрації світла фотоелементом співпадають) вимірюваннях. Методи світлорозсіювання можна досліджувати папір, друкарські фарби, плівки, фарбовідбитки.
Це рівняння є основою для розрахунків при нефелометричних (спостереження перпендикулярно (нормально) до напрямку освітлення) та турбідиметричних (напрямок освітлення і спостереження або реєстрації світла фотоелементом співпадають) вимірюваннях. Методи світлорозсіювання можна досліджувати папір, друкарські фарби, плівки, фарбовідбитки.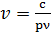 ,то
,то  ,або
,або 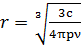 Електронна мікроскопія
Електронна мікроскопія


