
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Атом водорода, собственное значение и собственная ф-я радиальной части ур-я ШредингераСодержание книги
Поиск на нашем сайте
Рассмотрим потенциальную энергию частицы:
1)Р/м сначала асимптотическое решение при p→∞. Тогда(1) преобр к виду: 2)Теперь рассмотрим ассимптотику при p→0: Решение для радиальной составляющей волновой функции мы будем искать в виде:
22. Собственные значения энергии щелочных металлов Щелочные металлы в периодической системе Менделеева следуют за благородными газами: литий следует за гелием, натрий-на неоном.Щелочные металлы одновалентны и их сравнительно легко ионизировать.Щелочные атомы являются водородоподобными атомами, однако не полностью. Дело в том, что внешний электрон несколько деформирует оболочку первых Z — I электронов и несколько искажает их поле. Поэтому потенциальную энергию валентного электрона можно представить в виде Eп(r)=
где -
Переписав это уравнение следующим образом:
если положить
причем во все последующие вычисления вместо величины l войдет величина l', определяемая формулой (33.4). Решение квадратного уравнения (33.4):
Отрицательные значения l' должны быть отброшены, поскольку они приводят к бесконечности волновой функции в нуле. Окончательно выражение (33.5) для l' может быть представлено в виде
Если Тогда
Из формулы (33.1) видно, что имеет размерность длины. Чтобы второй член был малым по сравнению с первым, надо, чтобы (C1/ r0)«1, где г0- расстояние от ядра до ближайшего электрона. Учитывая, что в формуле (33.8) те2/(4пг0 ћ2) = = 1 /а0, где а0~ радиус первой боров- ской орбиты, мы убеждаемся, что поправочный член в (33.8) действительно мал. Главное квантовое число заменяется числом n' = l' + k+1 = l + k+1- где σ(l)= - С1 те2/ [ а формула для уровней энергии
в которой для Е введено два индекса, поскольку теперь энергия зависит не только от главного квантового числа и, но и от орбитального квантового числа /. Зависимость энергии от орбитального квантового числа составляет принципиальное отличие уровней энергии атомов щелочных металлов от уровней энергии атома водорода.
23. спектральные серии щелочных атомов, правила отбора. Спектры испускания атомов щелочных металлов, подобно спектру водорода, состоят из нескольких серий линий. Наиболее интенсивные из них получили названия: главная, резкая, диффузная и основная (или серия Бергмана). Эти названия имеют следующее происхождение. Главная серия названа так потому, что наблюдается и при поглощении. Следовательно, она соответствует переходам атома в основное состояние. Ее частоты условно обозначены в виде w = 2S — тр (m = 2, 3, 4,...), (33.13) т. е. частота со излучается в результате переходов электрона из состояний тр (т = 2, 3, 4,...) в состояние 2s. В спектре атома лития имеются кроме главной и другие серии. Важнейшие из них следующие. Первая побочная (или диффузная) серия. Частоты этой серии w = 2p-md (m = 3,4,5,...). (33.14) Серия называется диффузной потому, что ее линии несколько размыты, не очень резки. Причина такой диффуз- ности линий объяснена ниже. Вторая побочная (или резкая) серия. Частоты этой серии w = 2 p-ms (m = 3,4,5,...). (33.15) Резкая и диффузная серии состоят соответственно из резких и размытых (диффузных) линий. Серия Бергмана была названа основной (фундаментальной) за свое сходство с сериями водорода. Следующая серия, получающаяся в результате переходов электрона из f-состояний в 3 d-состояние, лежит в инфракрасной части спектра.
Правила отбора. Излучение происходит в результате перехода оптического электрона с одного энергетического уровня на другой. Однако не все переходы возможны. Возможными являются лишь переходы, разрешенные правилами отбора, которые совпадают с правилами отбора для одноэлектронного атома
главное квантовое число может изменяться на любое значение, а орбитальное квантовое число-лишь на единицу. Это означает, что возможны переходы лишь между соседними по L уровнями, т.е. между s- и p-состоя- ниями, между р- и d-состояниями, между d- и f-состояниями и т. д. (см. рис. 65).
|
||||
|
Последнее изменение этой страницы: 2016-09-19; просмотров: 349; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.88.104 (0.007 с.) |

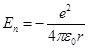 . Решим уравн Шредингера для потенциальной составляющей:
. Решим уравн Шредингера для потенциальной составляющей: 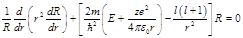 . Введём следующие обозначения:
. Введём следующие обозначения:  ;
; 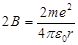 . Замена переменных:
. Замена переменных: 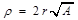 ,
, 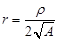 ;
; 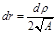 . Тогда уравнение примет вид:
. Тогда уравнение примет вид: 
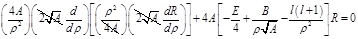
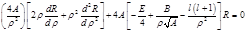

 (1).
(1).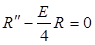 . Решением его будет
. Решением его будет 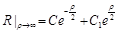 . Чтобы решен было ограничено на бесконечности, необходимо положить
. Чтобы решен было ограничено на бесконечности, необходимо положить 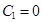 ;
; 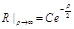 .
.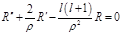 . Решение будем искать ввиде:
. Решение будем искать ввиде: 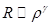 :
: 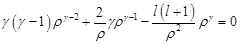 ,
, 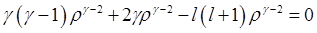 ,
,  ;
; 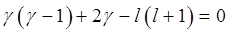 . Мы получили уравнение относительно
. Мы получили уравнение относительно 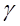 :
: 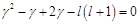 ,
, 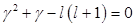 .
.  . Если
. Если 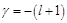 , то
, то 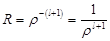 . При p→∞, p→0. Поэтому данное
. При p→∞, p→0. Поэтому данное 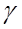 придётся отбросить. Т.о, остаётся решение:
придётся отбросить. Т.о, остаётся решение: 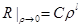 .
.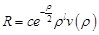 . Здесь ν(p) – некот функция, которая определяет поведение R в промежутке от 0 до бескон. Подставляем данный вид реш-я в (1):
. Здесь ν(p) – некот функция, которая определяет поведение R в промежутке от 0 до бескон. Подставляем данный вид реш-я в (1): 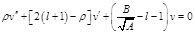 (2). Введём ограничен на функцию
(2). Введём ограничен на функцию 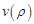 : она не должна на бескон расти быстрее, чем
: она не должна на бескон расти быстрее, чем 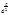 , а в 0 должна либо обращаться в 0, либо быть const,
, а в 0 должна либо обращаться в 0, либо быть const, 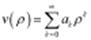 . Подставим в (2):
. Подставим в (2): 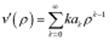
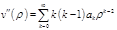
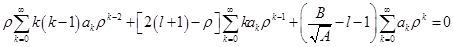

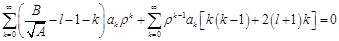 .
. Данный многочлен будет равен нулю только в том случае, когда коэффициенты при каждой степени p будут равны нулю:
Данный многочлен будет равен нулю только в том случае, когда коэффициенты при каждой степени p будут равны нулю:  . Данное соотношение даёт рекуррентную формулу
. Данное соотношение даёт рекуррентную формулу 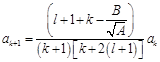 . Оценим коэффициенты ak при k→∞:
. Оценим коэффициенты ak при k→∞: 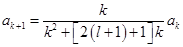 ,
, 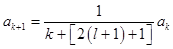
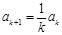 . Т.о,
. Т.о, 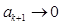 и
и 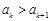 . Тогда при каком-нибудь малом значении
. Тогда при каком-нибудь малом значении 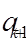 многочлен можно оборвать:
многочлен можно оборвать: 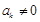 , а
, а 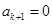 . Данное услов будет выполнено, если коэффициент при
. Данное услов будет выполнено, если коэффициент при 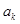 будет равен нулю:
будет равен нулю:  ,
,  ;.
;.  ,
, 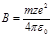 .
. 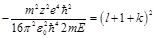 .
. 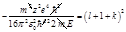 ,
,  . Из этой формулы следует, что энергия зависит от l и k. Введём следующее обозначение: l+k+1=n. Тогда à, где n=1,2,... Таким образом, решая уравнение Шредингера, мы нашли энергии водородоподобного атома, то есть нашли собственные значения оператора Гамильтона.
. Из этой формулы следует, что энергия зависит от l и k. Введём следующее обозначение: l+k+1=n. Тогда à, где n=1,2,... Таким образом, решая уравнение Шредингера, мы нашли энергии водородоподобного атома, то есть нашли собственные значения оператора Гамильтона.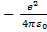 (
( ) (33.1)
) (33.1)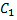 е2/(
е2/(  r2), - С2 е2/(
r2), - С2 е2/(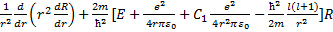 = 0. (33.2)
= 0. (33.2)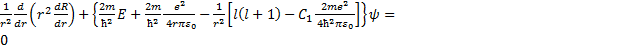 (33.3)
(33.3)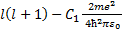 = l'(l' + 1), (33.4)
= l'(l' + 1), (33.4)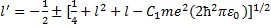 (33.5)
(33.5)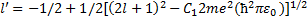 (33.6)
(33.6)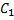 = 0, то
= 0, то 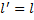 . Член, содержащий
. Член, содержащий 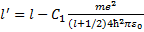 (33.8)
(33.8) [
[ 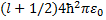 ] -1 = п + σ(l), (33.9а)
] -1 = п + σ(l), (33.9а)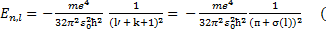 33 10)
33 10)
 -любое число,
-любое число, 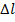 =
= 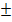 1, (33.11) т. е.
1, (33.11) т. е.



