Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Физиологические типы гемоглобина.Содержание книги
Поиск на нашем сайте
1. Примитивный – HbP (относятся гемоглобины, называемые Говер 1 и Говер 2) 2. Фетальный гемоглобин HbF (гемоглобин плода). 3. Гемоглобин взрослых: HbА1, HbА2, HbА3. HbР появляется на ранних стадиях развития эмбриона. Примитивные гемоглобины заменяются на HbF. На поздних стадиях развития плода появляются гемоглобины взрослых – HbА1, HbА2. В крови взрослого человека примерно 95-96% HbА1, 2-3% HbА3, 0,1-0,2% HbF. Гемоглобин А1 содержит по 2 Аномальные типы гемоглобина В крови человека открыто около 150 типов мутантных гемоглобинов. Аномальные гемоглобины различаются по форме, химическому составу, величине заряда. Выделены аномальные гемоглобины при помощи методов электрофореза и хроматографии. Передающиеся по наследству изменения – результат мутации единственного триплета, который приводит к замене одной аминокислоты на другую (с резко отличающимися свойствами – пример серповидноклеточная анемия – глу заменен на вал). Синтез гема. Исходными веществами для синтеза гема служат глицин сукцинил-КоА. На первой стадии из глицина и сукцинил-КоА при участии СООН СН2-NH2 HSKoA COOH
| СН2 натсинтаза CH2 | | COSKoA C=O | CH2-NH2 Затем из 2 молекул Источником Fe2+ в синтезе гема является ферритин, который считается резервом гемопротеидом и откладывается в клетках костного мозга, печени и селезенки. Установлено, что источником всех 4 атомов азота и 8 атомов углерода тетрапиррольного кольца является глицин. Источником остальных 26 из 34 атомов углерода служит сукцинил-КоА. Патология обмена гемоглобина. Болезни гемоглобинов (их около 200) называют гемоглобинозами.
Гемоглобинозы делят на: 1. Гемоглобинопатии – в основе лежат наследственные изменения структуры какой-либо цепи нормального гемоглобина («молекулярные болезни»). 2. Талассемии – нарушение синтеза какой-либо цепи гемоглобина. 3. Железодефицитные анемии. Классическим примером наследственной гемоглобинпатии является серповидноклеточная анемия. Глу в 6-м положении в Талассемии – генетически обусловленной нарушение синтеза одной из нормальных цепей гемоглобина. Угнетение синтеза
Порфирии. Порфирии – группа заболеваний с наследственной предрасположенностью, возникающих в результате блокирования начальных стадий синтеза гема и сопровождающихся увеличением содержащихся порфиринов в организме.
порфобилиноген
уропорфириноген
копропорфириноген
протопорфирин IX
Гем Блок – 1 – острая перемеживающая порфирия. Накапливается Блок – 2 – приводит к накоплению всех предшествующих продуктов. Молекулярный механизм неизвестен. Болк – 3 – эритропоэтическая протопорфирия связана с отсутствием фермента феррохелатазы, каторая присоединяет к молекуле протопорфирина IX Fe2+. Распад гема За сутки в организме распадается около 9 г гемопротеидов. Период жизни эритроцитов 120 дней, разрушаются они в кровеносном русле или в селезенке. Гемоглобин связывается с гаптоглобином и в виде комплекса гаптоглобин-гемоглобин поступает в клетки ретикулоэндотелиальной системы селезенки. Комплекс гаптоглобин-гемоглобин распадается и гаптоглобин переходит в кровь, а гемоглобин окисляется в метгемоглобин (Fe3+).
В РЭС селезенки гемоглобин под действием гемоксигеназы превращается в вердоглобин. Вердоглобин теряет Fe, которое связывается трансферином и доставляется кровью в костный мозг. Вердоглобин отдает белок глобин и превращается в биливердин. При восстановлении биливердина НАДФ Н2 образуется билирубин. Билирубин – плохо растворимое соединение и в крови связывается с альбумином. В виде комплекса альбумин-билирубин идет транспорт билирубина кровью в клетки печени. В печени билирубин соединяется с глюкуроновой кислотой с образованием моно (20%) и диклюкуронидов (80%), они хорошо растворимы в воде. Этот вид билирубина называется конъюгированным билирубином (связан с глюкуроновой кислотой), а также называется связанным прямым, т.к. может быть прямо обнаружен с помощью реактива Эрлиха. Билирубинглюкурониды в незначительных количествах диффундируют в кровеносный капилляр. В плазме крови присутствуют 2 формы билирубина: неконъюгированный (непрямой, свободный) и конъюгированный (прямой, связанный) – 25% от общего билирубина. Билирубинглюкурониды с желчью поступают в кишечник, где от них отщепляется глюкуроновая кислота и вновь образуется неконъюгированный билирубин. В тонком кишечнике небольшая часть билирубина может всосаться и через портальную вену вновь поступать в печень. Остальной билирубин подвергается действию кишечных бактерий и в тонком кишечнике билирубин превращается в уробилиноген. Уробилиноген всасывается в тонком кишечнике и через воротную вену поступает в печень, где уробилиноген разрушается до моно- дипирролов. Не разрушенный уробилиноген вновь с желчью поступает в кишечник и восстанавливается до стеркобилиногена (бесцветен). Стеркобилиноген окисляется до стеркобилина и выделяется с фекалиями. Небольшое количество стеркобилиногена поступает в почки, затем окисляется до стеркобилина и выделяется с мочой. В норме содержание общего билирубина в сыворотке крови составляется 8-20 мкмоль/л.
|
||||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 287; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.143.0.200 (0.009 с.) |

 и
и  цепи. Гемоглобин А2 – по 2
цепи. Гемоглобин А2 – по 2  -цепи. Гемоглобин F – по 2
-цепи. Гемоглобин F – по 2  -цепи. Гемоглобин Говер 1 содержит 4
-цепи. Гемоглобин Говер 1 содержит 4 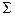 цепи, Говер 2 – 2
цепи, Говер 2 – 2 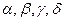 -цепями.
-цепями. | | ПФ |
| | ПФ | СН2 + COOH CH2 + CO2
СН2 + COOH CH2 + CO2 Глицин Сукцинил-КоА
Глицин Сукцинил-КоА