
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кислотно-основное равновесие.Содержание книги Поиск на нашем сайте
Кислотно-основное равновесие. Кислотно-основное равновесие – это соотношение концентрации водородных (Н+) и гидроксильных (ОН-) ионов в жидкостях организма. Постоянство рН внутренней среды организма обусловлено совместным действием буферных систем и ряда физиологических механизмов. 1. Буферные системы крови и тканей: Бикарбонатная: NaHCO3 + Н2СО3 Фосфатная: NaHРO4с + NaHРO4к Белковая: протеин-Na+ + протеин-Н+ Гемоглобиновая: HbK+HbH+ 2. Физиологический контроль: Дыхательная функция легких Выделительная функция почек КЩР отражает клеточный метаболизм, газотранспортную функцию крови, внешнее дыхание и водно-солевой обмен. В норме рН крови колеблется от 7,37 до 7,44, среднее значение рН=7,4. Буферные системы поддерживают постоянство рН при поступлении кислых и основных (ОН-) продуктов. Буферное действие объясняется связыванием свободных Н+ и ОН- ионов компонентами буфера и переводом их в недиссоциированную форму слабой кислоты или воды. Буферные системы организма состоят из слабых кислот и их солей с сильными основаниями. Для устранения сдвига рН необходимо различное время: Буферные системы – 30 сек Дыхательный контроль – 1 – 3 мин Выделительная функция почек – 10 – 20 час. Буферные системы устраняют только сдвиги рН. Физиологические механизмы восстанавливают и буферную емкость. Бикарбонатная буферная система. На долю бикарбонатного буфера приходится около 10% всей буферной емкости крови. Бикарбонатный буфер состоит из угольной кислоты, выполняющей роль донора протона, и бикарбонат-иона Н2СО3 – слабая кислота, трудно диссоциирует Н2СО3 NaНСО3 – соль слабой кислоты и сильного основания диссоциирует полностью: NaНСО3 Механизм действия буфера 1. При поступлении в кровь кислых продуктов водородные ионы взаимодействуют с ионами бикарбоната Н+ + NaНСО3 Восстанавливается соотношение Н2СО3/ NaНСО3, рН не изменяется (концентрация NaНСО3 незначительно понижается). Легкие обеспечивают выведение углекислого газа. 2. При поступлении в кровь оснований из тканей, ионы ОН- взаимодействуют со слабой угольной кислотой (ионы ОН- взаимодействуют с Н+ из буфера, образуя Н2О) Н2СО3 + ОН- рН сохраняется, [ При нормальном значении рН крови концентрация ионов бикарбоната
Фосфатная буферная система Компоненты буфера: Na2НРО4с – соль – двузамещенный фосфат NaН2РО4к – слабая кислота – однозамещенный фосфат Соотношение На долю фосфатной буферной системы приходится 1% буферной емкости крови. Механизм действия буфера. 1. При поступлении в кровь кислых продуктов обмена веществ происходит связывание ионов Н+ с двузамещенным фосфатным ионом Н+ + Na2НРО4 2. При поступлении в кровь ионов ОН- происходит связывание избытка ОН- при взаимодействии с однозамещенным фосфатом (кислота) Na2НРО4. Избыток ОН- связывается с водородом (Н+) из ОН- + Na2НРО4 Понижение концентрации [NaН2РО4] сдвигает диссоциацию NaН2РО4. NaН2РО4 Действие фосфатного буфера контролируется выделительной функцией почек. При ее нарушении происходит задержка кислых фосфатов. Фосфатный буфер действует при изменении рН в интервале от 6,1 до 7,7. В крови максимальная емкость фосфатного буфера проявляется при 7,2. Белковая буферная система. Буферное действие белков обусловлено из амфотерностью. При увеличение концентрации ОН--ионов увеличивается диссоциация карбоксилов, ионы Н+ связывают избыток ОН- и рН сохраняется, белок заражается отрицательно, выступая как кислота:
ОН- + Н+ При увеличении [Н+] подавляется диссоциация СООН, группы NН2 связывают избыток Н+, рН сохраняется, белок заряжается положительно, выступая, как основание:
В плазме крови буферное действие выполняют альбумины и глобулины. Роль почек в регуляции КЩР. В клетках эпителия почечных канальцев из СО2 и Н2О под действием карбоангидразы образуется угольная кислота, которая диссоциирует на ионы Н+ и Судьба ионов Н+, попавших в мочу. 1. Н+ + 2. Н+ + 3. Н+ + Ионы
По механизму 1. Метаболический 2. Респираторный (газовый) Метаболический ацидоз – много кислых продуктов (кетоновые тела, лактат, пируват). Наблюдается при голодании, диабете, лихорадке, нарушении кровообращения, поражении почек. Респираторный (газовый) ацидоз наблюдается при заболеваниях легких (бронхиты, пневмонии), недостаток кровообращения. По компенсации: 1. Компенсаторный, рН в N, но меняются другие показатели КЩР. 2. Декомпенсированный – ацидотическая кома. Алкалоз – состояние дефицита ионов водорода в крови. Метаболический алкалоз – дефицит ионов Н+ в крови, сочетается со снижением содержания ионов К+ в крови. Компенсация метаболического алкалоза осуществляется дыхательным и почечным путем (снижение вентиляции с повышением СО2 и увеличением экскреции бикарбоната почками). Причины: дефицит калия, понос, рвота, инфекции ЖКТ, длительное введение стероидных гормонов. Бывает компенсированный и реже декомпенсированный. Дыхательный алкалоз – избыточное выведение Н2СО3. возникает при быстром удалении СО2 и сопровождается развитием гипокапнии (понижение парциального давления СО2 в артериальной крови – менее 35 мм рт. столба).дыхательный алкалоз наблюдается при вдыхании чистого кислорода, при подъеме на высоту, при компенсаторной одышке. Бывает компенсированный.
Причины гипопротеинемий Задержка воды в организме при отеках на почве цирроза печени, потеря белков с мочой при нефритах, угнетение синтеза белков (при длительных инфекционных заболеваниях, при раковой кахексии, при голодании). Причины гиперпротеинемий Потеря больших количеств воды при диарее, неукротимой рвоте, тяжелых травмах ожогах. Это относительная гиперпротеинемия. Абсолютная гиперпротеинемия обусловлена резким нарастанием иммуноглобулинов и патологических белков. (миеломная болезнь).
Строение молекулы Ig. Молекула Ig состоит из 4 полипептидных цепей: 2 тяжелых – Н-цепи и 2 легких – L-цепи. Легкие и тяжелые цепи соединены дисульфидными мостиками. Легкие цепи Ig бывают 2 видов: каппа и лямбда. Тяжелые цепи определяют специфичность Ig и различаются по аминокислотному составу. Различают 5 типов тяжелых цепей: IgG – Для связывания АГ на молекуле Ig имеются активные центры. А.ц. образован V-участками легкой и тяжелой цепи. Разрыв S-S между цепями приводит к исчезновению активных центров. На молекуле Ig два активных центра, т.е. Ig бивалентны. А.ц. – щель, которая комплементарна молекуле АГ. Комплементарность стереоспецифическая и электрохимическая. В молекуле Ig имеется шарнирный участок – это середина Н-цепей. Шарнирный участок не имеет вторичной структуры, здесь находится пролин и молекула Ig делает изгиб, что обеспечивает приспособление Ig к взаимодействию с АГ. Вторичная структура Ig представлена Ig расщепляются протеолитическими ферментами: папаином и пепсином. Папаин расщепляет молекулу Ig в шарнирной области на 3 фрагмента: 2 Fab и Fc-фрагмент. Fab-фрагмент имеет активный центр и это обеспечивает его связывание с АГ, происходит образование комплекса АГ-АТ. Fc-фрагмент выполняет эффекторную функцию: обеспечивает прохождение через плаценту, прохождение через мембрану клеток, обеспечивает фиксацию иммуноглобулинов на поверхности собственных клеток, связывает комплемент, который способен лизировать клетку. IgG составляет 70-75% общего количества иммуноглобулинов. Концентрация IgG в сыворотке достигает нормы к 7-летнему возрасту. Повышенная концентрация IgG наблюдается при инфекциях, при болезнях печени. Пониженная концентрация IgG наблюдается у новорожденных, при недостаточности гуморального иммунитета. IgG – единственный иммуноглобулин, проникающий через плаценту; благодаря этому плод получает материнские антитела. IgM представляет собой пентамер молекулы IgG. Пять молекул, аналогичных IgG, соединены между собой полипептидной цепью J. IgM лучше, чем другие связывает комплемент. IgM синтезируется в ответ на большинство антигенов у детей первого года жизни. Обнаружение у плода антител класса М указывает на внутриматочную инфекцию. IgA сывороточный иммуноглобулин А бывает в разных формах: обычной, димерной и трехмерной. IgA, которые выходят из кровяного русла через слизистые оболочки в просвет дыхательных путей, помимо J-цепи, имеют секреторный компонент – SC. SC-структура защищает IgA от разрушающего действия ферментов, находящихся в скретах слизистых оболочек. Содержание IgA достигает нормы к 10 годам. IgA – типичный иммуноглобулин слизистых оболочек. Функция IgA – защита слизистых оболочек от инфекций. IgE – содержится в крови в низких концентрациях. IgE обладает высокой цитофильностью, т.е. способностью присоединяться к тучным клеткам и базофилам. Присоединение антигена к IgE, находящаяся на этих клетках, приводит к выделению гистамина и это вызывает развитие реакций гиперчувствительности немедленного типа (аллергических реакций). IgD – не связывает комплемент, не проходит через плаценту, не связывается с тканями. Биологическая функция не ясна; вероятно, он служит рецептором В-лимфоцитов. Динамика выработки антител. IgM являются антителами первичного иммунного ответа. Через несколько дней происходит переключение синтеза IgM на IgG. При вторичном ответе сразу синтезируются IgG. Материнские IgG с периодом полураспада 25 дней проникающие в кровь плода через плаценту, обеспечивают пассивный иммунитет новорожденных, к 3 месяцу из содержание уменьшается вдвое. Синтез собственных IgM осуществляется плодом с 5 недели внутриутробного развития. Катаболизм Ig Период полураспада антител зависит от интенсивности обменных процессов и возраста, у новорожденных это 30-35 дней, затем этот срок сокращается. Ig разрушаются под влиянием тканевых катепсинов на Fc и 2 Fab-фрагмента, небольшое количество около 10% IgG выводится в свободном виде, активный центр сохраняется и по мере выведения продукты катаболизма оказывает защитное действие, связывая АГ. Патология обмена Ig 1. Гипогаммаглобулинемия – снижение уровня всех классов Ig. Бывает 3 видов: 1. Транзитная – у детей. 2. Врожденная. 3. Приобретенная (инфекция, интоксикация, нарушение синтеза Ig, ускоренное разрушение, потеря с мочой). 2. Дисгаммаглобулинемия – снижение (изменение) соотношения между классами Ig. Виды: 1. Врожденная. 2. Приобретенная. I тип – нет G, A, > M II тип – нет M, A, >A III тип – N G,M < A
Белки плазмы крови. Кровь состоит из плазмы и взвешенных в ней форменных элементов. Плазма составляет около 55% от объема крови. Эритроциты составляют основную массу форменных элементов – 44%. Из 9-10% сухого остатка плазмы крови на болю белков приходится 6,5-8,5%. Общее содержание белков составляет 60 – 80 г/л. Для разделения белков плазмы крови используют следующие методы:
Разделение белков проводят с использованием солей щелочных и щелочноземельных металлов. Наиболее часто используют сульфат аммония. Различные белки высаливаются из растворов при разных концентрациях растворов сульфата аммония: альбумины выпадают при 100% насыщении, глобулины при 50%. При действии сульфата аммония, ацетона, спирта белки теряют гидратную оболочку, утрачивают устойчивость и выпадают в осадок. В результате высаливания получают 2 фракции:
На долю фибриногена приходится – 2 – 4 г/л. Плазма, лишенная фибриногена, называется сывороткой. В условиях клинических лабораторий для разделения белков сыворотки крови применяют метод электрофореза. Сыворотка – плазма, не содержащая фибриноген и др. факторы свертывания (т.е. жидкость, которая остается после формирования сгустка крови). Высаливание. Для высаливания применяют соли в разных концентрациях. При малой концентрации солей осаждаются наиболее крупные, тяжелые и обладающие наименьшим зарядом частицы. При повышенной концентрации солей выпадают все более мелкие частицы и устойчивые белковые фракции. При использовании 33%-ного раствора (NH4)2SO4 выпадают белки сыворотки крови, имеющие наибольший молекулярный вес – эйглобулины, при 50%-ной концентрации – псевдоглобулины, при 100%-ной – самые «легкие» альбумины. Белки, осажденные сульфатом аммония, почти не денатурируются; после удаления соли из белкового осадка (диализом через целлофановую мембрану) ее растворяют и используют для различных целей. Чтобы лишить высокомолекулярные частицы устойчивости, необходимо удалить их водные оболочки и снять электрический заряд. При электрофорезе в поддерживающих средах имеет значение размер пор геля (молекулярно-ситовой эффект геля) и размеры молекул белка. Электрофорез на бумаге. Сыворотку крови наносят на бумажную полоску, смоченную буфером. Концы бумажной полосы опущены в раствор электролита, где находятся электроды источника постоянного тока. При замыкании электрической цепи белковые молекулы движутся со скоростью. Пропорциональной величине заряда. За единицу времени проходят разные расстояния, т.е. оказываются на разных участках бумажной полосы. 2. Электорфорез основан на передвижении заряженной частицы в электрическом поле. Белки сыворотки крови различаются по молекулярной массе, заряду и изоэлектрической точке. На основании этих различий белки разделяются в электрическом поле. В зависимости от условий проведения разделения различают электрофорез на бумаге, в растворе и в геле: крахмала, целлюлозы и полиакриламидном геле. а) Электрофорез на бумаге позволяет получить 5 белковых фракций: 1. Альбумины. 2. б) Электрофорез в крахмальном геле позволяет получить 10 фракций. в) Электрофорез в полиакриламидном геле позволяет получить до 18 фракций. При электрофорезе в полиакриламидном геле используют пары буферных растворов с различными значениями рН и различной степени пористости гель. 3. Изоэлектрофокусировние – проведение электрофореза в поддерживающих средах с градиентом рН. Нахождение белка определяется его изоэлектрической точкой. 4. Иммунофорез представляет собой комбинацию электрического и иммунологического методов. Происходит электрофорез и реакция преципитации в одной среде. Иммуноэлектрофорез – сочетание электрофореза в агаровом геле и иммунодиффузии. После электрофоретического разделения белков в канавку, идущую параллельно пути движения антигенов, вносят перциптирующую иммунную сыворотку. Антигены и антитела диффундируют на месте встречи дугообразные полосы преципитации.
Электрофорез основан на способности белков перемещаться в электрическом поле. Для функционирования белков сыворотки крови чаще всего используют веронал-мединаловый буфер с рН 8,6. При этом значении рН белки заряжаются отрицательно и движутся к аноду. В связи с различием в размерах молекул и в величине заряда скорость движения белков самые малые и имеющие наибольший заряд альбумины, затем Скорость передвижения белка в электрическом поле зависит от его электрофоретической подвижности.
Альбумины. На долю альбуминов приходится 55 – 60% белков плазмы крови. Молекулярная масса 70 тыс Да. Содержание альбуминов в крови – 40 – 50 г/л. Период полураспада 7 дней. Альбумины поддерживают коллоидно-осмотическое давление и регулируют обмен жидкостей между кровью и тканями. Снижение концентрации альбумина в сыворотке крови ниже 30 г/л сопровождается уменьшением онкотичекого давления крови и возникновением онкотического давления крови и возникновением отеков. Функции альбуминов: транспорт неэстерифицированных жирных кислот, желчных кислот, желчных пигментов (билирубин), стероидные гормоны, ионы Са2+, многие лекарства – сульфаниламиды, пенициллин, дикумарин, аспирин. Глобулины. Глобулины делят на Фракция
Функция – неспецифический транспорт гормонов. Концентрация возрастает при воспалении, травле, ревматоидном артрите, некоторых опухолях. Ретинолсвязывающий белок – транспорт витамина А. М.М. 21 кД, концентрация 3 – 6 мг/100 мл. синтезируется в гепатоцитах, [конц.]
Концентрация 200 – 400 мг/ 100 мл = 2 – 4 г/л. Врожденная недостаточность сопровождается легочной эмфиземой, циррозом печени у детей. Альфа - Увеличение концентрации Тироксинсвязывающий белок – связывает и транспортирует гормон щитовидной железы – тироксин. М.М. 58 кД, концентрация 1 – 2 мг/100 л. Транскортин – связывает и транспортирует кортикостероиды. М.М. 52 кД, концентрация 3 – 3,5 мг/100 мл.
Гаптоглобин составляет 25% от всех Разновидности Нр 1-1 (азиаты) 2-1 2-2 отличаются по набору полипептидных цепей и последовательности аминокислот. Функция – гаптоглобин образует стабильный комплекс с гемоглобином, появляющимся в плазме крови в результате внутрисосудистого гемолиза эритроцитов. Гаптоглобин – гемоглобиновый комплекс поглощается клетками РЭС, где глобин и гем подвергаются распаду, а освободившееся железо используется для синтеза гема. Такой механизм предотвращает повреждение почек гемоглобином и потерю железа с мочой. Ингибитор протеаз, транспорт В12. Низкий уровень гаптоглобина приводит к гемолитической анемии. Концентрация увеличивается при воспалении, инфекции, ревматической лихорадке, метастазирующем раке. Церулоплазмин – белок голубого цвета из-за содержания меди. М.М. 150 кД, концентрация 2 – 3 г/л, синтезируется гепатоцитами. Церулоплазмин участвует в обмене меди, регулирует уровень меди в печени, участвует в обмене витамина С, адреналина, диоксифенилаланина, серотонина, мелатонина. Уменьшение содержания цероплазмина при гепатоцеребральной дистрофии (болезнь Вильсона-Коновалова) сопровождается накоплением меди в нервной ткани и печени (врожденное нарушение). Увеличение содержания церулоплазмина специфично для меланомы и шизофрении.
Три белка:
Трансферрин – связывает и транспортирует железо в различные ткани, регулирует концентрацию. М.М. 90 кД, концентрация – 2 – 3 г/л, синтезируется в печени и в макрофагальной системе. Имеет 2 активных центра, связывает 2 атома железа. Связывает и переносит Zn, Cu и витамин D. Трансферрин предотвращает избыточное накопление Fe3+ в тканях и потерю его с мочой. Уменьшение содержания трансферрина отмечается при гепатитах, опухолях, нефротическом синдроме. Повышение содержания связано с усиленным распадом эритроцитов. Гемопексин – связавает гем и предотвращает его выведение почками. Комплекс гем-гемопексин улавливается из крови печенью, где железо освобождается и используется для образования гема. М.М. 57 кД, концентрация 50 – 100 мг/100мл. Концентрация уменьшается при гемолизе, болезнях печени и почек. Концентрация увеличивается при воспалении. Ферменты крови. Ферменты крови делят на 3 группы: 1. Секреторные, плазмоспецифические или собственно сывороточные или собственные ферменты крови. Синтезируются где-то, чаще в печени, но поступают в кровоток и там выполняют функцию. Относятся белки – ферменты свертывающей, антисвертывающей, кининовой, ренинангиотензиновой систем. К этой группе относятся лецитин-холестеринацилтрансфераза (ЛХАТ), липопротеидлипаза, холинэстераза. Диагностическое значение определения активности ферментов этой группы невелико. Снижение их активности указывает на повреждение продуцирующего эти ферменты органа – чаще всего печени. 2. Экскреторные К этой группе относятся ферменты поджелудочной железы, желудка. Относятся трипсин, химотрипсин. 3. Тканевые (клеточные), индикаторные ферменты. Попадают в кровь из тканей, где они выполняют определенные внутриклеточные функции. Активность этих ферментов определяют с целью выявления поврежденного органа. При поражении тех или иных тканей ферменты из клеток «вымываются» в кровь и их активность в сыворотке резко возрастает, что является индикатором степени и глубины повреждения тканей. Начальные стадии повреждений, на которых целостность клеток еще не нарушена, но проницаемость клеточных мембран уже увеличелась, сопровождается выходом в кровь растворимых ферментов цитозоля (альдолаза, аланинаминотрансфераза, лактатдегидрогеназа, гексокиназа, пируваткиназа). При более глубоких повреждениях, когда происходит разрушение клеток вплоть до некроза, в плазме крови появляются ферменты, связанные с клеточными органеллами – митохондриями, лизосомами. Активность ферментов определяют с целью энзимодиагностики. Ферментные тесты обладают определенной информативностью: 1. Показывают наличие патологии. 2. Показывают на локализацию процесса. 3. Определяют глубину повреждения клеток. 4. Позволяют решить вопрос о лечении, его эффективности. Необходимо сочетание с другими методами диагностики. В клинике с целью диагностики определяют: 1. Креатинкиназу (фосфокреатинкиназу). Отностися к фосфотрансферазам, катализирует реакцию переноса остатка фосфорной кислоты на креатин с образованием креатин-фосфата. Играет важную роль в поддержании соотношения АТФ/АДФ в клетке. Специфична для мышечной ткани. Среди различных типов мышц активность креатинкиназы распределяется следующим образом: поперечнополосатые мышцы > сердечные мышцы > мышцы беременной матки > мышцы матки > гладкие мышцы. Креатинкиназа представлена несколькими изоферментами, обладающими тканевой специфичностью. Молекула фермента состоит из 2 типов полипептидных цепей: М и В. Образует 3 изофермента: I тип (ВВ) – мозг, II тип (МВ) – сердце, III тип (ММ) – скелетная мускулатура. У больных инфарктом миокарда активность креатинкиназы в сыворотке возрастает уже через 3-4 часа после начала заболевания, максимальная активность фермента отмечается к концу первых суток, в 5 0 20 раз (возможно до 100 раз). У больных прогрессирующей мышечной дистрофией активность креатинкиназы возрастает в 50 раз, в мышцах появляются МВ и ВВ изоформы, отсутствующие у здоровых людей. Различные заболевания центральной нервной системы – шизофрения, маниакально-депрессивный синдром, синдромы, вызываемые психотропными средствами сопровождаются возрастанием в крови активности креатинкиназы. Повышение активности кратковременное, что обусловлено высокой активностью фермента и вызывает выработку антител и выведение из организма. Для диагностики повреждения миокарда определяют активность аспартатаминотрансферазы. Активность фермента повышается у 98% больных. Повышение активности коррелирует с величиной очага поражения: повышение в 25-30 раз – крупный инфаркт, в 50-60 раз – трансмуральный инфаркт. Повышение активности фермента отмечается через 5 – 6 часов, максимум – через 15 – 20 часов. Для диагностики инфаркта определяют изоверменты лактатдегидрогеназы: ЛДГ1 и ЛДГ2. Активность ферментов повышается через 1 – 2 суток после возникновения инфаркта. Повышение в 25 – 30 раз. Активность снижается в период исчезновения ресорбционекротического синдрома. Повышение активности фермента позволяет дифференцировать стенокардию и инфаркт. При стенокардии активность фермента повышается редко и незначительно. Повторный инфаркт приводит к повышению активности фермента. При первичном инфаркте выбрасываются белки, на которые образуются АТ, которые могут стать причиной болевых синдромов (синдром Дреслера) и этим отличаются от вторичного инфаркта. При синдроме Дреслера активность фермента не повышена. С целью диагностики заболеваний печени определяют активность аланинаминотрансферазы. Активность повышается за 1 – 1,5 недели до появления желтухи. Выявляют гепатит любой этимологии. Через 1 – 3 дня после появления желтухи активность АлТ увеличивается в 10 – 20 раз, четкой корреляции между повышением активности и величиной очага поражения нет. Нормализация АлТ – признак клинического выздоровления. При заболеваниях печени незначительно повышается активность АсТ, возвращение к норме идет постепенно, но активность фермента может расти и на фоне лечения, т.е. в кровоток может проникать митохондриальный фермент, т.е. лечение неэффективно. Активность фермента характеризует выраженность цитолитического синдрома, т.е. повышение проницаемости мембран гепатоцитов. Щелочная фосфотаза – катализирует гидролиз сложноэфирных связей в моноэфирах фосфорной кислоты и органических соединений. Активность фермента повышается у больных с механической желтухой, циррозе. Щелочная фосфотаза характеризует развитие внутрипеченочного холестаза – нарушение оттока по печеночным капиллярам. Активность щелочной фосфатазы повышается у больных саркоидозом, туберкулезом, амилоидозом, лимфогрануломатозом. При заболевании печени определяют изоферменты лактатдегидрогеназы, о заболевании судят по ЛДГ5, где есть связь между активностью фермента и величиной очага поражения, активность повышается одновременно с появлением желтухи. Альдолаза – первый определенный в клинике фермент. Фермент гликолиза, активируется при злокачесвенных новообразованиях в печени. Сорбитолдегидрогеназа – органоспецифичен для печени. В норме в крови не определяется, наличие свидетельствует о патологии. Алкагольдегидрогеназа – окисляет этиловый спирт. С помощью этого фермента пытались дифференцировать алкогольный гепатит от других видов гепатита. Уровень АДГ не соответствует выраженности процесса.
Белки острой фазы Под этим термином объединяют белки содержание, которых увеличивается или белки обнаруживаются при воспалительных процессах. К белкам острой фазы относятся: С-реактивный белок, Для белков острой фазы характерны 2 общих признака: 1. Белки острой фазы являются гликопротеидами. 2. Синтезируются в печени. Важное клиническое значение имеет определение содержания в сыворотке крови – С-реактивного белка. Название С-реактивный белок получил за способность вступать в реакцию преципитации с С-полисахаридом пневмококов. С-реактивный белок синтезируется в печени, М.М.138 кД, 6 субъединиц по 23 кД. С-реактивный белок способствует фагоцитозу, активирует иммунные реакции, связывание комплемента. Содержание белков острой фазы изменяется при остром течении заболевания, а также при обострении хронических процессов и понижается при выздоровлении. Белки острой фазы естественные ингибиторы иммунной системы, не дают развиться иммунопатологической реакции. Плазменные липопротеины. Основная функция липопротеинов – транспорт липидов в организме. Различают следующие классы липопротеинов:
|
|||||||||||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 515; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.1.23 (0.012 с.) |

 , выполняющего роль акцептора протона.
, выполняющего роль акцептора протона. Н+ +
Н+ + 
 Na+ + Н2СО3
Na+ + Н2СО3 


 , образуется кислый однозамещенный ион
, образуется кислый однозамещенный ион 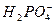 , избыток которого удаляется почками с мочой:
, избыток которого удаляется почками с мочой: + Н2О
+ Н2О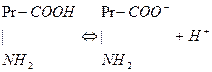
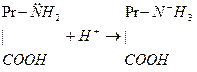


 - выводится
- выводится
 + Сl + Na
+ Сl + Na  ).
). Нарушения КЩР
Нарушения КЩР


 Нарушения обмена белков плазмы крови
Нарушения обмена белков плазмы крови


 Уменьшение общего содержания белков в сыворотке крови
Уменьшение общего содержания белков в сыворотке крови
 , IgA –
, IgA –  , IgM –
, IgM –  , IgD –
, IgD –  . На легких и тяжелых цепях выделяют вариабельные и константные участки. Вариабельные участки у иммуноглобулинов, направленных против различных АГ различны.
. На легких и тяжелых цепях выделяют вариабельные и константные участки. Вариабельные участки у иммуноглобулинов, направленных против различных АГ различны. -структуры или «клубки». «Клубки» называются доменами, которые возникают при образовании дисульфидных связей между аминокислотными остатками внутри одной цепи.
-структуры или «клубки». «Клубки» называются доменами, которые возникают при образовании дисульфидных связей между аминокислотными остатками внутри одной цепи.




