
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение констант устойчивости комплекса с учетом конкурирующих процессовСодержание книги
Поиск на нашем сайте
Реагенты: 1. Цинка сульфат, 0.0670 М раствор. 2. Цинка сульфат, 0.0067 М раствор. 3. Фоновый раствор Выполнение работы. В три мерные колбы емкостью 25 мл соответственно наливают 0,16 мл, 0,25 мл и 0,35 мл 0.0067 М раствора соли цинка и доводят объем до метки дистиллированной водой. В мерную колбу емкостью 25 мл приливают 5,2 мл 0,067 М раствора соли цинка, 7 мл 0,05 М раствора комплексона III и доводят объем до метки дистиллированной водой. Записывают полярограммы, определяют для каждой величину тока (мкА). Рассчитывают концентрацию цинка в М для растворов 1 – 3. По данным полярограмм 1 – 3 строят градуировочный график I = f(CZn), а значение тока для раствора 4 используют для нахождения концентрации несвязанных в комплекс ионов цинка. На основании полученных данных определяют условную константу устойчивости в соответствии с уравнением реакции Zn2+ + H2Y2- ® ZnY2- + 2H+ ZnY2- «Zn2+ + Y4-
Концентрацию несвязанных в комплекс ионов цинка
Влияние концентрации ионов водорода и образование комплексов с вспомогательным лигандом (NH3) можно количественно оценить с помощью соответствующих величин a – молярной доли незакомплексованных ионов Y4- иZn2+, которые предварительно рассчитывают для реальных условий эксперимента. Истинное значение константы устойчивости ZnY2- находят по уравнению:
Полученное значение сравнивают с табличным и рассчитывают ошибку. Оценивают точность и правильность полученных значений. 7.7.Определение констант образования комплексов при ступенчатом комплексообразовании по методу Де Форда и Юма
Если в растворе существует один комплекс, восстановление которого протекает обратимо, то зависимость Е1/2 – СL является прямой. Если комплексообразование протекает ступенчато и константы образования комплексов близки – зависимость является криволинейной. Определение ступенчатых констант в этом случае можно проводить по методу Де Форда и Юма. C этой целью вводится серия функций F(х) и методом уменьшения показателя этой функции относительно х сводят к получению прямой, параллельной оси Х (рис. 17).
Рис. 17. Зависимость Fi(x) для Сd2+ в растворах тиоцианата.
Для получения значения F0(х) необходимо получить значения Е1/2 серии растворов с различной концентрацией лиганда при постоянной концентрации металла.
Значение F1(x) равно:
Для предпоследнего комплекса F(х) – прямая (типа у = ax + b), а для последнего – прямая, параллельная оси Х (типа у = а). Значения констант находят графически по величине отрезка на оси F(х).
Рис.18. Зависимость молярных долей отдельных форм комплекса от lg[SCN-]
Определив константы ступенчатого комплексообразования, рассчитывают долю концентрации каждого иона от общей концентрации для различных концентраций лиганда и строят график зависимости (a от lg[L]) распределения комплексов от концентрации лиганда (рис. 18).
Реагенты: 1. Кадмий сернокислый, стандартный раствор СCd2+ = 2 мг/мл. 2. Калий азотнокислый, 2 М раствор. 3. Калий тиоционат, 2 М раствор. 4. Фоновый раствор
Выполнение работы. В мерных колбах емкостью 25 мл готовят серию растворов с различной концентрацией лиганда (SCN-) при постоянной концентрации иона кадмия (1 мл). В каждую колбу вводят рассчитанный объем KNO3 так, чтобы ионная сила раствора оставалась неизменной (равной 2), раствор доводят до метки дистиллированной водой. Записывают полярограммы, рассчитывают величину тока и потенциал полуволны (точно!) для каждой полярограммы. Полученные данные заносят в таблицу. Данные для расчета ступенчатых констант образования.
По полученным данным определяют константы ступенчатого комплексообразования. Затем рассчитывают долю концентрации каждого иона от общей концентрации при различной концентрации лиганда и строят график зависимости (a от [Lig]) распределения комплексов от концентрации лиганда (рис. 9). Полученные результаты сравнивают со справочными данными. 7.8.Полярографический метод определения состава комплекса (металл – комплексон III) Если скорость комплексообразования относительно мала по сравнению со скоростью восстановления ионов металла, то в присутствии лиганда на полярограмме образуются две волны – одна соответствует свободному иону, вторая – комплексу. Для серии растворов с постоянной концентрацией металла и возрастающей (начиная с нуля) концентрацией лиганда график зависимости концентрации свободного металла, определенной по высоте первой волны от соотношения СL / CM, представляет собой кривую, представленную на рисунке. Экстраполируя зависимость до пересечения с осью абсцисс, находим состав комплекса. Этот метод применим лишь в случае образования одного комплекса, например, комплексон III с ионами металлов (цинк, медь, свинец и др).
Реагенты: 1. Цинк сернокислый, 0.067 М раствор; 2. Комплексона III, 0,05 М раствор; 3. Фоновый раствор
Выполнение работы. В 3 мерные колбы емкостью 25,0 мл приливают по 5 мл стандартного раствора цинка и соответственно 3, 4 и 5 мл 0,05 М раствора комплексона II и доводят объем водой до метки. Записывают полярограммы, определяют для каждой из них высоту волны (h, мм). Рассчитывают отношение молярных концентраций CЭДТА / СZn для каждого анализируемого раствора, строят график зависимости h – CЭДТА / СZn. Определяют состав комплекса, экстраполируя полученный отрезок на ось абцисс.
Литература 1. Дорохова Е.Н., Прохорова Г.В. Аналитическая химия. Физико-химические методы анализа. –М.: Высшая школа, 1997. 2. Юинг Г. Инструментальные методы химического анализа. –М.: Мир, 1989. 3. Плэмбек Дж. Электрохимические методы анализа. Основы теории и применение. –М.: Мир, 1985. 4. Васильев В. П. Аналитическая химия. Физико-химические методы анализа: - М.:Дрофа, 2002. - 384 с., ил. - С. 202-207 5. Кнорре Д. Г., Крылова Л. Ф., Музыкантов В. С. Физическая химия: Учеб. пособие для вузов. - М.: Высш. школа, 1981. - 328 с., ил., с. 263-264. 6. Коростелев П. П. Лабораторная техника химического анализа. - Под ред. докт. хим. наук А. И. Бусеева, - М.: Химия, 1981. - 312 с., ил., с. 226-232. 7. Руководство по химическому анализу поверхностных вод суши. Под ред. д. х. н. проф. А. Д. Семенова. Л.: Гидрометеоиздат, 1977., с. 31-36. 8. Фомин Г. С. Вода. Контроль химической, бактериальной и радиационной безопасности по международным стандартам. Энциклопедический справочник. - 2-е изд. перераб. и доп. - М:. Издательство "Протектор", 1995. - 624 с., ил., с. 95-96. 9. Мухина Е.А. Физико-химические методы анализа: Учебник для техикумов – М.: Химия, 1995.-416 с.: ил. 10. Гейровский Я., Кута Я. Основы полярографии. –М.: Мир, 1965. 11. Бонд А.М. Полярографические методы в аналитической химии. –М.: Химия, 1983. 12. Майрановский С.Г., Страдынь Я.П., Безуглый В.Д. Полярография в органической химии. –М.: Химия, 1975. 13. Коваленко П.Н., Багдасаров К.Н. Физико–химические методы анализа. – Ростов.: РГУ, 1966. 14. Алесковский В.Б., Бардин В.В. и др. Физико–химические методы анализа. Практическое руководство. – Л.: Химия, 1983. 15. Виноградова Е.Н., Галлай З.А., Финогенова З.М. Методы полярографического и амперометрического анализа. – М.: МГУ, 1963. 16. Лурье Ю.Ю. Справочник по аналитичекой химии. –М.: Химия, 1989. 17. Садименко Л.П. Методическое руководство к рактическим занятиям по аналитической химии Количественный анализ. Часть 2. (Полярографический метод анализа). Ростовский гос.унив-т. 2004 - 11 стр. Приложение Электрохимические датчики используемые в зонде (свойства, подготовка к работе, калибровка)
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 305; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.99.39 (0.009 с.) |


 ' находят из градуировочного графика, а концентрация
' находят из градуировочного графика, а концентрация 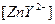 соответственно равна:
соответственно равна:


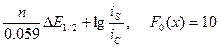


 рис.19.
рис.19. 


