
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основные принципы классификации химических элементов.Содержание книги
Поиск на нашем сайте
Стабильность химического состава организма является одним из важнейших и обязательных условий его нормального функционирования. Отклонения в содержании химических элементов, вызванных различными причинами, приводят к широкому спектру нарушений в состоянии здоровья человека. Все живые организмы на 99% состоят из 12 наиболее распространенных элементов, среди которых С, О, Н, N, Са и др., называемые макроэлементами. Это «структурные» элементы, присутствие которых в живой материи связано в первую очередь с их значительным содержанием в биосфере. Кроме того, во всех организмах находится небольшое количество (менее 0,3 %) более тяжелых элементов, которые условно подразделяются на микро- и ультрамикроэлементы: 81 элемент обнаружен в организме человека. При этом 15 из них (железо (Fe), йод (I), медь (Сu), цинк (Zn), кобальт (Со), хром (Сг), молибден (Мо), никель (Ni), ванадий (V), селен (Se), марганец (Мn), мышьяк (As), фтор (F), кремний (Si), литий (Li)) признаны эссенциальными, т.е. жизненно необходимыми (биогенными). Железо, медь, марганец, йод, цинк, хром, селен, молибден, кобальт выполняют каталитическую и регуляторную функции и участвуют во всех видах обмена веществ. Условно микроэлементы разделяют на три группы: 1) Катионные элементы, находящиеся в организме в виде положительно заряженных ионов электролитов - это цинк, железо, марганец и медь. 2) Анионные элементы, находящиеся в организме в виде отрицательно заряженных ионов электролитов - это хром, селен, молибден, йод. 3) Элементы, существующие в виде органических комплексов, в которых они выполняют роль комплексообразователя. Элементы из одной группы могут переходить в другую в ходе химических процессов, протекающих в организме, при этом происходит изменение их валентности (степени окисления) и взаимодействие с возможными лигандами. Большинство микроэлементов представляют собой d-металлы, которые образуют комплексные соединения с аминокислотами, карбоновыми кислотами, нуклеиновыми кислотами, нуклеотидами, пептидами, белками, жирными кислотами и т. д. Устойчивость данных комплексов зависит от ряда факторов: природы растворителя и лигандов, кинетической природой комплексообразования, принципами геометрического построения.
Комплексные соединения характеризуются образованием ковалентных связей, образованных по донорно-акцепторному механизму за счет электронной пары одного атома и вакантной электронной орбитали другого. Такая ковалентная связь называется координационной связью. Самым простым координационным соединением, известным из школьного курса химии, является хлорид аммония.
Комплексообразователем может быть любой элемент периодической системы, но чаще комплексообразователями являются d – элементы (Fe, Co, Cu и др.), s- и p- элементы реже. В качестве примера образования комплексного соединения рассмотрим реакцию: FeCl3 + 6KCN → K3[Fe(CN)6] + 3 KCl
K3[Fe(CN)6] – гексацианофаррат калия. K + 3[Fe +3 (CN¯)6] 3- - электронейтральная структура. Комплексообразователь - ион Fe+3, координирующий вокруг себя 6 лигандов CN¯, т.е. координационное число комплексообразователя равно 6. Квадратными скобками выделен комплексный ион [Fe(CN)6]3-, внешняя сфера этого комплекса образована ионами К+.
Темы для рефератов: 1. Комплексные соединения. Классификация по принципу химического строения. 2. Номенклатура комплексных соединений. 3. Основные принципы образования. 4. Биологическая роль комплексных соединений. 5. Химия элементов S-блока. 6. Химия элементов р-блока. 7. Химия элементов d-блока.
Литература
1. Общая химия. Биофизическая химия. Химия биогенных элементов. Учебник для медицинских вузов. (Ю.А.Ершов, В.А.Попков, А.С.Берлянд и др. Ред.Ю.А.Ершов), 8 изд., 560 с.- М,: Высш.шк., 2010 г. 2. Практикум по общей химии. Биофизическая химия. Химия биогенных элементов. Учебное пособие для студентов медицинских вузов (Ред. В.А.Попков).- М., Высшая школа, 4 изд., 239 с., 2008 г. 3. Сборник задач и упражнений по общей химии. Учебное пособие. (С.А. Пузаков, В.А. Попков, А.А. Филиппова). М.: Высшая школа, 4 изд., 255 с., 2010г. 4. Общая химия. Учебник для медицинских вузов. (В.А. Попков, С.А. Пузаков), 976 с. - М, ГЭОТАР Медиа, 2007 г. 5. Физическая и коллоидная химия: Курс лекций (Н.Н.Мушкамбаров), – 2-е изд., исправл. – М.: ГЭОТАР – МЕД, 2001. – 384 с.
Занятие №17 Итоговое занятие «ФИЗИКО-ХИМИЯ ДИСПЕРСНЫХ СИСТЕМ И ПОВЕРХНОСТНЫХ ЯВЛЕНИЙ СВОЙСТВА РАСТВОРОВ ВМС КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ»
Цель занятия: Систематизировать и закрепить знания по свойствам дисперсных систем, растворов ВМС и комплексных соединений.
Вопросы для собеседования: 1. Классификациядисперсных систем. 2. Электрокинетические и электрические свойства коллоидных растворов 3. Вязкость растворов ВМС. Удельная вязкость. Уравнение Штаудингера. 4. Методы определения изоэлектрической точки ВМС. 5. Уравнение Фрейндлиха для количественного определения адсорбции на границе Т-Ж и Т-Г. 6. Классификация коллоидных растворов. 7. Кинетическая устойчивостьколлоидных растворов. Факторы, влияющие:на нее. Явление седиментации. 8. Вязкость растворов ВМС. Относительная вязкость. Факторы, влияющие на относительную вязкость. 9. Денатурация ВМС. Факторы, влияющие на денатурацию. 10. Уравнение Лэнгмюра для количественного определенияадсорбция на границе Т-Ж; Т-Г. Его анализ. 11. Понятие мицеллы, гранулы, адсорбционного и диффузного слоев. Пример. 12. Агрегативная устойчивость коллоидных растворов. Факторы, влияющие на нее. Изоэлектрическое состояние коллоидной частицы. 13. Определение молекулярной массы ВМС с помощью уравнения Галлера. 14. Высаливание ВМС. Факторы, влияющие на высаливание. 15. Адсорбция из растворов. 16. Конденсационные (химические) методы получения коллоидных растворов. Примеры. 17. Понятие коагуляции коллоидных растворов. Стадии коагуляции. Кинетика коагуляции. 18. Осмотическое давление в растворах ВМС. Уравнение Галлера. Онкотическое давление 19. Факторы устойчивости ВМС 20. Уравнение Гиббса и его анализ. 21. Дисперсионные методы получения коллоидных растворов. Примеры. 22. Теория устойчивости и коагуляции Ландау - Дерягина. 23. Понятие ВМС. Значение ВМС для медицины. 24. Понятие набухания макромолекул. Степень набухания. Факторы, влияющие на набухание. 25. Поверхностная энергия и поверхностное натяжение. 26. Молекулярно-кинетические и оптические свойства коллоидных растворов. 27. Правила Коагуляции, порог коагуляции, коагулирующая сила, правило Шульца – Гарди. 28. Зависимость свойств ВМС от их структуры. 29. Желатинирование (гелеобразование). Механизм; факторы, влияющие на желатинирование. 30. Изотермы поверхностного натяжения и адсорбции. 31. Определение поверхностной активности графическим путем. 32. Расчет заряда комплексообразователя и комплексного иона. 33. Определение порога коагуляции золя. Литература
1. Общая химия. Биофизическая химия. Химия биогенных элементов. Учебник для медицинских вузов. (Ю.А.Ершов, В.А.Попков, А.С.Берлянд и др. Ред.Ю.А.Ершов), 8 изд., 560 с.- М,: Высш.шк., 2010 г. 2. Практикум по общей химии. Биофизическая химия. Химия биогенных элементов. Учебное пособие для студентов медицинских вузов (Ред. В.А.Попков).- М., Высшая школа, 4 изд., 239 с., 2008 г. 3. Сборник задач и упражнений по общей химии. Учебное пособие. (С.А. Пузаков, В.А. Попков, А.А. Филиппова). М.: Высшая школа, 4 изд., 255 с., 2010г. 4. Общая химия. Учебник для медицинских вузов. (В.А. Попков, С.А. Пузаков), 976 с. - М, ГЭОТАР Медиа, 2007 г. 5. Физическая и коллоидная химия: Курс лекций (Н.Н.Мушкамбаров), – 2-е изд., исправл. – М.: ГЭОТАР – МЕД, 2001. – 384 с. Занятие №18
|
||||
|
Последнее изменение этой страницы: 2016-08-06; просмотров: 758; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.218.63.176 (0.006 с.) |

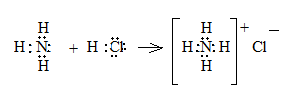 Согласно ныне принятой теории строения комплексных соединений (А. Вернер, 1893 г) в центре комплексного соединения находится комплексообразователь – атом или ион, присоединяющий к себе молекулы или противоположно заряженные ионы. Эти ионы или молекулы координируются вокруг комплексообразователя и называются лигандами. Лиганды вместе с комплексообразователем образуют комплексный ион или внутреннюю (координационную) сферу, которая изображается в квадратных скобках. Число лигандов называется координационным числом. Ионы, имеющие противоположный комплексному иону заряд, образуют внешнюю сферу координационного соединения. Например, для хлорида аммония: N (атом азота) – комплексообразователь, Н – лиганд, NН4+ - комплексный ион аммония, Cl¯ -образует внешнюю сферу.
Согласно ныне принятой теории строения комплексных соединений (А. Вернер, 1893 г) в центре комплексного соединения находится комплексообразователь – атом или ион, присоединяющий к себе молекулы или противоположно заряженные ионы. Эти ионы или молекулы координируются вокруг комплексообразователя и называются лигандами. Лиганды вместе с комплексообразователем образуют комплексный ион или внутреннюю (координационную) сферу, которая изображается в квадратных скобках. Число лигандов называется координационным числом. Ионы, имеющие противоположный комплексному иону заряд, образуют внешнюю сферу координационного соединения. Например, для хлорида аммония: N (атом азота) – комплексообразователь, Н – лиганд, NН4+ - комплексный ион аммония, Cl¯ -образует внешнюю сферу.


