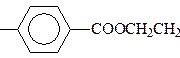Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Сырьё для производста полиэфировСодержание книги Поиск на нашем сайте
Этиленгликоль НО – СН2– СН2–ОН t кип.= 197,50С; ρ = 1,115 г/см3. В технике получают из этилена. I стадия: обработка этилена гипохлоритом (НОСl) и получение этиленхлоргидрина НО– СН2– СН2–Сl II стадия: дегидрохлорирование этиленхлоргидрина при добавлении гашеной известии получение окиси этилена III стадия: реакция гидратации окиси этилена до этиленгликоля. Окись этилена может получаться прямым окислением этилена кислородом воздуха при t 200-3000С. Этиленгликоль – гигроскопичная бесцветная жидкость, почти без запаха, смешивается с водой и спиртом во всех соотношениях. Диэтиленгликоль НО – СН2– СН2–О– СН2– СН2–ОН t кип.=245,8 0С; ρ = 1,118 г/см3. Получается при взаимодействии этиленгликоля и окиси этилена при 1000С. Диэтиленгликоль - гигроскопичная бесцветная жидкость с очень слабым запахом. С водой и спиртом смешивается во всех соотношениях. Фталевая кислота Получают фталевый ангидрид окислением нафталина кислородом воздуха в газовой фазе над ванадиевым катализатором. Фталевый ангидрид получают в промышленности окислением нафталина или о -ксилола:
Применяется синтез фталевого ангидрида окислением орто – ксилола воздухом над ванадиевым катализатором. Фталевый ангидрид – прозрачные кристаллы с t пл.= +12 0С, растворимые в воде, спирте, эфире. Терефталевая кислота является пара – изомером фталевой кислоты.
Основной метод синтеза – окисление пара – ксилола. Трудности при очистке терефталевой кислоты (она сублимируется без разложения при t = 3000С) привели к тому, на производстве получают её диметиловый эфир, легко поддающийся тщательной очистке. Диметилтерефталат по сравнению с кислотой более низкую температуру плавления. Лучше всего его очищать перегонкой в вакууме, а затем кристаллизацией из метанола. Диметилтерефталат имеет t пл.= 1420С со значительной сублимацией. Диметилтерефталат (диметиловый эфир терефталевой кислоты): Из большого числа разнообразных линейных полиэфиров практическое применение нашли полимеры на основе этиленгликоля и кислот: фталевой, адипиновой, себациновой и терефталевой, а такжена основе ароматическихдиоксисоединений и угольной кислоты (поликарбонаты).
ПОЛИЭТИЛЕНТЕРЕФТАЛАТ
Описаны три способа получения полиэтилентерефталата (ПЭТФ). 1. Прямое взаимодействие терефталевой кислоты и гликоля, взятого в избытке в присутствии катализатора этерефикации. 2. Переэтерефикация низших эфиров терефталевой кислоты и гликоля, взятого в избытке в присутствии катализатора этерефикации. 3. Взаимодействие хлорангидрида кислоты и этиленгликоля в среде инертного разбавителя (например, хлороформа) в присутствии щелочного катализатора (например, пиридина). Низкомолекулярные полиэфиры, полученные по любому из способов, могут превращаться в высокомолекулярные полимеры нагреванием в атмосфере инертного газа. Реакция заканчивается при уменьшенном давлении. Первый и третий методы синтеза практически не нашли применения. В промышленности применяется метод переэтерификации между диметилтерефталатом и этиленгликолем с последующей поликонденсацией дигликольтерефталата. Процесс производства ПЭТФ можно представить следующей схемой, включающей две стадии: 1. Переэтерификация
2. Поликонденсация
Концевые группы:
Важнейшие преимущества этого метода – более простая очистка диметилового эфира и его повышенная растворимость в этиленгликоле. Диметитилтерефталат плавится при 1420С и может быть хорошо очищен путём перегонки и перекристаллизации. Для ускорения реакций используются катализаторы. Алкоголяты щелочных металлов обычно применяются в качестве катализатора реакции переэтерификации сложных эфиров, вызывают окраску расплава полимера. В большинстве случаев используются алкоголяты цинка, свинца, магния и сурьмы. Наряду с описанной ранее реакцией пертеэтерификации протекают также некоторые побочные реакции, оказывающие влияние на структуру образующегося полиэфира. К их числу можно отнести образование простых эфирных связей при взаимодействии гидроксильных групп, приводящих к получению сегментов дигликолевого эфира, вследствие чего несколько снижается температура плавления ПЭТФ, а также образование карбоновых кислот за счёт разложения сложноэфирных групп. ...–СН2СН2ОН + ОНСН2СН2–... →...–СН2СН2ОСН2СН2–... +Н2О
 + СН2=СН –... + СН2=СН –...
Последние реакции препятствуют получению полиэфиров с большим молекулярным весом, тек как происходит уменьшение числа гидрокисльных групп, необходимых для дальнейшего роста полимерной цепи.
|
||||||
|
Последнее изменение этой страницы: 2016-07-16; просмотров: 353; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.225.92.60 (0.009 с.) |

 .
. имеет две карбоксильные группы, расположенные в орто – положении бензольного ядра и способные образовывать ангидридную связь, поэтому чаще используют не кислоту, а ангидрид.
имеет две карбоксильные группы, расположенные в орто – положении бензольного ядра и способные образовывать ангидридную связь, поэтому чаще используют не кислоту, а ангидрид.








 и –ОСН2СН2ОН.
и –ОСН2СН2ОН.