
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Активность ферментов, участвующих в фиксации СО2Содержание книги
Поиск на нашем сайте
Для экспериментального подтверждения функционирования цикла Кальвина-Бенсона-Бэссема, выяснения активности некоторых ферментов, вовлеченных в ассимиляцию и восстановление CO2 культуру выращивали в автотрофных условиях. При автотрофном росте A. thiophilum нами была показана высокая активность фосфорибулокиназы (prkB), одного из ключевых ферментов цикла Кальвина, которая при автотрофном росте A. thiophilum составила 2,5±0,13 мкмоль∙мин-1∙мг белка-1, тогда как при гетеротрофном росте активность фермента определить не удалось. Активность карбоангидразы, участвующей в превращении бикарбонатного иона (HCO3-) в CО2, непосредственно взаимодействующего с РБФК, при литоавтотрофном росте составила 19,6±1 у.е., что значительно превышает данные об активности при литогетеротрофном росте, которая составили 3,3±0,17 у.е.
3.3. Экспрессия гена rbcL большой субъединицы рибулозобисфосфаткарбоксилазы/оксигеназы В связи с тем, что РБФК является ключевым ферментом цикла Кальвина, для подтверждения возможности функционирования цикла Кальвина у A. thiophilum, был проверен уровень экспрессии гена rbcL, кодирующего большую субъединицу РБФК, при росте культуры в авто- и гетеротрофных условиях. Метоом кПЦР показано, что экспрессия гена rbcL в автотрофных условиях в 7,67 раз превышает экспрессию гена в гетеротрофных условиях (рис. 2А). Был выявлен только один продукт амплификации, длина которого соответствовала теоретически предсказанной, что указывает на специфичность подобранных праймеров (рис. 2Б).
Рис. 2. (А) Экспрессии гена rbcL при (1) автотрофном и (2) гетеротрофном культивировании и (Б) амплификация фрагмента гена rbcL с парой праймеров RbcL_F2/RbcL_R2 (длина целевого продукта 353 нуклеотида).
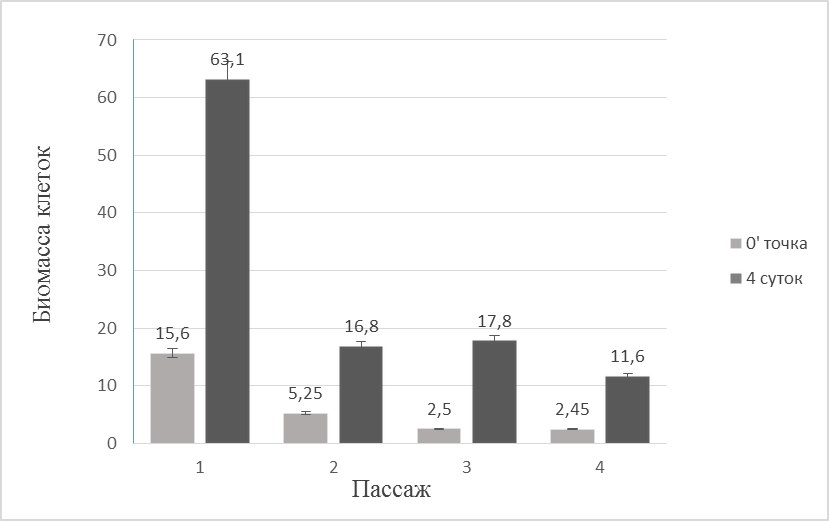
3.4. Рост в присутствии тиосульфата и NaHCO3 Проводились четыре последовательных пассажа в течение которых A. thiophilum культивировали на питательной среде, содержащей в качестве донора электронов тиосульфат и единственного источника углерода NaHCO3 (рис. 3). На протяжении первых двух пассажей наблюдалось резкое уменьшение биомассы клеток, вследствие уменьшения содержания органических веществ, пептона и сукцината, в среде. В третьем и четвертом пассаже количество биомассы стабилизировалось, так как органические соединения находились в среде в следовых количествах. В связи с этим последний пассаж считали самым достоверным. Прирост биомассы в четвертом пассаже составил 9,1*106 кл/мл среды.
Рис. 3. Прирост биомассы (кл/мл) A. thiophilum при литоавтотрорфном росте.
Автотрофный рост у A. thiophilum сопровождался окислением тиосульфата (рис. 4).
Рис. 4. Динамика окисления тиосульфата и прирост биомассы клеток A. Thiophilum при литоавтотрофном росте в присутствии тиосульфата в качестве донора электронов.
Показано, что в микроаэробных условиях в присутствии тиосульфата при литоавтотрофном росте по сравнению с миксотрофным ростом удельная скорость окисления тиосульфата возрастает в 5-6 раз.
ВЫВОДЫ
1. На основании анализа геномного сиквенса было установлено, что автотрофная ассимиляция CO2 у Azosprillum thiophilum осуществляется посредством цикла Кальвина-Бенсона-Бэссема. Был обнаружен полный набор генов, кодирующий ферменты цикла. 2. Показана экспрессия гена большой субъединицы РБФК. В результате анализа геномного сиквенса установлено наличие у этой бактерии I и IV форм РБФК. 3. Показана активность фосфорибулокиназы, одного из ключевых ферментов икла Кальвина-Бенсона-Бэссема, и карбоангидразы, участвующео в превращении бикарбонатного иона ( СПИСОК ИСПОЛЬЗУЕМОЙ ЛИТЕРАТУРЫ
1. 34Резников А.А. Методы анализа природных вод./ А.А. Резников, Е.П. Муликовская, В.Ю. Соколов.// М.: Госгеолтехиздат. – 1970. – С. 488. 2. 33Романова А.К. Биохимические методы изучения автотрофии у микроорганизмов. // М.: Наука, 1980, 160 с. 3. 16Турова Т. П., Спиридонова Е. М. Филогения и эволюция генов Рибулозо-1, 5-бисфосфаткарбоксилазы/оксигеназы у прокариот / Т. П. Турова, Е. М. Спиридонова // Молекулярная биология. – 2009. – Т. 43, №. 5. – С. 772-788. 4. 3Andersson, I. Large structures at high resolution: the 1.6 Å crystal structure of spinach ribulose-1, 5-bisphosphate carboxylase/oxygenase complexed with 2-carboxyarabinitol bisphosphate / I. Andersson // Journal of molecular biology. – 1996. – Vol. 259, №. 1. – P. 160-174. 5. 27 Azospirillum thiophilum sp. nov., a diazotrophic bacterium isolated from a sulfide spring/ K. Lavrinenko, E. Chernousova, E. Gridneva [et al.]// Int. J. of Syst. and Evol. Microbiol. – 2010. – Vol. 60. – P. 2832–2837. 6. 35Basic local alignment search tool./ S.F. Altschul, W. Gish, W. Miller et al.// J. Mol. Biol. - 215:403-410. – 1990. 7. 23Boggetto, N. Regulation of phosphoribulokinase and glyceraldehyde 3‐phosphate dehydrogenase in a freshwater diatom, Asterionella formosa 1 / N. Boggetto, B. Gontero, S. C. Maberly // Journal of Phycology. – 2007. – Vol. 43, № 6. – P. 1227-1235. 8. 28Capacity of Azospirillum thiophilum for Lithotrophic Growth Coupled to Oxidation of Reduced Sulfur Compounds/ E. N. Frolov, E. V. Belousova, K. S. Lavrinenko [et al.]// Microbiology. - 2013. - Vol. 82, № 3. - P.271-279. 9. 31Caraway, B. H., & Krieg, N. R. (1974). Aerotaxis in Spirillum volutans. Can J Microbiol 20: 1367 - 1377. 10. 29Flechner, A., Gross, W., Martin, W.F., and Schnarrenberger, C. (1999) Chloroplast class I and class II aldolases are bifunctional for fructose-1,6-P and sedoheptulose-1,7-P cleavage in the Calvin cycle. FEBS Letters 447: 200-202. 11. 39Del Prete S, Vullo D, Fisher GM, Andrews KT, Poulsen SA, Capasso C, Supuran CT (2014) Discovery of a new family of carbonic anhydrases in the malaria pathogen Plasmodium falciparum – the η-carbonic anhydrases. Bioorg Med Chem Lett 24:4389-4396. 12. 2Distinct form I, II, III, and IV Rubisco proteins from the three kingdoms of life provide clues about Rubisco evolution and structure/function relationships/ F. Robert Tabita, Sriram Satagopan, Thomas E. Hanson [et al.] // Journal of Experimental Botany. – 2008. – Vol. 59, № 7. – P. 1515-1524. 13. 5Dubbs, J. M. Regulators of nonsulfur purple phototrophic bacteria and the interactive control of CO2 assimilation, nitrogen fixation, hydrogen metabolism and energy generation / J. M. Dubbs, F. R. Tabita // FEMS microbiology reviews. – 2004. – Vol. 28, №. 3. – P. 353-376. 14. 41Kupriyanova E, Villarejo A, Markelova A, Gerasimenko L, Zavarzin G, Samuelsson G, Los DA, Pronina N (2007) Extracellular carbonic anhydrases of the stromatolite-forming cyanobacterium Microcoleus chthonoplastes. Microbiology 153(4):1149–1156 15. 42Sültemeyer D, Klughammer В, Badger МR, Price GD (1998) Fast induction оf high affinity НСО3- transport in cyanobacteria. Plant Physiol 116:183-192 16. 11Finn, M. W. Modified pathway to synthesize ribulose 1, 5-bisphosphate in methanogenic archaea / M. W. Finn, F. R. Tabita // Journal of bacteriology. – 2004. – Vol. 186, №. 19. – P. 6360-6366. 17. 9Finn, M. W. Synthesis of catalytically active form III ribulose 1, 5-bisphosphate carboxylase/oxygenase in archaea / M. W. Finn, F. R. Tabita // Journal of bacteriology. – 2003. – Vol. 185, №. 10. – P. 3049-3059. 18. 1.Function, Structure, and Evolution of the RubisCO-Like Proteins and Their RubisCO Homologs / F. Robert Tabita, Thomas E. Hanson, Huiying Li [et al.] // Microbiol. Mol. Biol. Rev. – 2007. – Vol. 71, № 4. – P. 576-599. 19. 21Gibson, J. L. Organization of phosphoribulokinase and ribulose bisphosphate carboxylase/oxygenase genes in Rhodopseudomonas (Rhodobacter) sphaeroides / J. L. Gibson, F. R. Tabita // Journal of bacteriology. – 1987. – Vol. 169, № 8. – P. 3685-3690. 20. 14Hanson, T. E. A ribulose-1, 5-bisphosphate carboxylase/oxygenase (RubisCO)-like protein from Chlorobium tepidum that is involved with sulfur metabolism and the response to oxidative stress / T. E. Hanson, F. R. Tabita // Proceedings of the National Academy of Sciences. – 2001. – Vol. 98, № 8. – С. 4397-4402. 21. 26Hartmann, A. Regulation of nitroge nase activity by oxygen in Azospirillum brasilense and Azospirillum lipoferum / A. Hartmann, R.H. Burris // Int. J. Syst. Bacteriol. – 1987. – Vol. 169. – P. 944–948. 22. 13Igamberdiev, A. U. Feedforward non-Michaelis–Menten mechanism for CO 2 uptake by Rubisco: contribution of carbonic anhydrases and photorespiration to optimization of photosynthetic carbon assimilation / A. U. Igamberdiev, M. R. Roussel // Biosystems. – 2012. – Vol. 107, №. 3. – P. 158-166. 23. 36Moriya, Y., Itoh, M., Okuda, S., Yoshizawa, A., and Kanehisa, M.; KAAS: an automatic genome annotation and pathway reconstruction server. Nucleic Acids Res. 35, W182-W185 (2007). 24. 4Knight, S. Crystallographic analysis of ribulose 1, 5-bisphosphate carboxylase from spinach at 2· 4 Å resolution: Subunit interactions and active site / S. Knight, I. Andersson, C. I. Brändén // Journal of molecular biology. – 1990. – Vol. 215, №. 1. – P. 113-160. 25. 43Khalifah RG (1971) The carbon dioxide hydration activity of carbonic anhydrase. I. Stop-flow kinetic studies on the native human isoenzymes B and C. J Biol Chem 246:2561-2573 26. 44Lindskog S (1997) Structure and mechanism of carbonic anhydrase. Pharmacol Ther 74:1-20. 27. 18Murphy, B. A. Prediction of gene function in methylthioadenosine recycling from regulatory signals / B. A. Murphy, F. J. Grundy, T. M. Henkin // Journal of bacteriology. – 2002. – Vol. 184, № 8. – P. 2314-2318. 28. 15Occurrence, phylogeny and evolution of ribulose-1, 5-bisphosphate carboxylase/oxygenase genes in obligately chemolithoautotrophic sulfur-oxidizing bacteria of the genera Thiomicrospira and Thioalkalimicrobium / T. P. Tourova, E. M. Spiridonova, I. A. Berg [et al.] // Microbiology. – 2006. – Vol. 152, № 7. – P. 2159-2169. 29. 22Phosphoribulokinase from Chlamydomonas reinhardtii: a Benson–Calvin cycle enzyme enslaved to its cysteine residues / G. Thieulin-Pardo, T. Remy, S. Lignon [et al] // Molecular BioSystems. – 2015. – Vol. 11, № 4. – P. 1134-1145. 30. 30Pfennig, N. D. & Lippert, K. D. (1966). Uber das vitamin B12 - bedurfuis phototropher Schwefelbakterien. Arch Mikrobiol 55: 245 - 256. 31. 8Presence of a structurally novel type ribulose-bisphosphate carboxylase/oxygenase in the hyperthermophilic archaeon, Pyrococcus kodakaraensis KOD1 / S. Ezaki, N. Maeda, T. Kishimoto [et al.] // Journal of Biological Chemistry. – 1999. – Vol. 274, №. 8. – P. 5078-5082. 32. 32Lowry, O.H., Rosenbrough, N.J., Farr A.L., Randall R.J. (1951) Protein measurement with the folin pihend reagent. J. Biol. Chem. 193: 265-275. 33. 17RuBisCO-like proteins as the enolase enzyme in the methionine salvage pathway: functional and evolutionary relationships between RuBisCO-like proteins and photosynthetic RuBisCO / H. Ashida, S. Yohtaro, T. Nakano [et al.] // Journal of experimental botany. – 2008. – Vol. 59, № 7. – P. 1543-1554. 34. 12Sato, T. Archaeal type III RuBisCOs function in a pathway for AMP metabolism / T. Sato, H. Atomi, T. Imanaka // Science. – 2007. – Vol. 315, № 5814. – P. 1003-1006. 35. 19Sekowska, A. The methionine salvage pathway in Bacillus subtilis / A. Sekowska, A. Danchin // BMC microbiology. – 2002. – Vol. 2, № 1. – P. 1. 36. 40Smith KS, Ferry JG (2000) Prokaryotic carbonic anhydrases. FEMS MicrobiolRev 24:335-366. 37. 38Supuran CT (2008) Carbonic anhydrases: novel therapeutic applications for inhibitors and activators. Nat Rev Drug Discov 7:168–181 38. 6Tabita, F. R. Microbial ribulose 1, 5-bisphosphate carboxylase/oxygenase: a different perspective / F. R. Tabita // Photosynthesis Research. – 1999. – Vol. 60, №. 1. – С. 1-28. 39. 24The Calvin cycle in cyanobacteria is regulated by CP12 via the NAD (H)/NADP (H) ratio under light/dark conditions / M. Tamoi, T. Miyazaki, T. Fukamizo, S. Shigeoka // The Plant Journal. – 2005. – Vol. 42, № 4. – P. 504-513. 40. 20The form II fructose 1, 6-bisphosphatase and phosphoribulokinase genes form part of a large operon in Rhodobacter sphaeroides: primary structure and insertional mutagenesis analysis / J. L. Gibson, J. H. Chen, P. A. Tower, F. R. Tabita // Biochemistry. – 1990. – Vol. 29, № 35. – P. 8085-8093. 41. 37The RAST Server: Rapid Annotations using Subsystems Technology. Aziz RK, Bartels D, Best AA, DeJongh M, Disz T, Edwards RA, Formsma K, Gerdes S, Glass EM, Kubal M, Meyer F, Olsen GJ, Olson R, Osterman AL, Overbeek RA, McNeil LK, Paarmann D, Paczian T, Parrello B, Pusch GD, Reich C, Stevens R, Vassieva O, Vonstein V, Wilke A, Zagnitko O. BMC Genomics, 2008. 42. 25Transfer of Conglomeromonas largomobile subsp. largo mobilis to the genus Azospirillum as Azospirillum largo mobile comb. nov. and elevation of Conglomeromonas largomobilis subsp. paroensis to the new type species of Conglomeromonas, Conglomeromonas paroensis sp. nov./ B.Dekhil, M. Cahill, E. Stackebrandt, L. Sly// Syst. Appl. Microbiol. – 1997. – Vol. 20. – P. 72–77. 43. 7Watson, G. M. F. Microbial ribulose 1, 5-bisphosphate carboxylase/oxygenase: a molecule for phylogenetic and enzymological investigation / G. M. F. Watson, F. R. Tabita / FEMS microbiology letters. – 1997. – Vol. 146, №. 1. – С. 13-22. 44. 10Watson, G. M. F. Unusual ribulose 1, 5-bisphosphate carboxylase/oxygenase of anoxic Archaea / G. M. F. Watson, J. P. Yu, F. R. Tabita // Journal of bacteriology. – 1999. – Vol. 181, №. 5. – P. 1569-1575.
|
||||
|
Последнее изменение этой страницы: 2016-07-16; просмотров: 215; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.189.237 (0.008 с.) |



 ) в CO2, непосредственно взаимодействующего с РБФК, при литоавтотрофном росте. Активность фосфорибулокиназы составила 2,5 мкмоль
) в CO2, непосредственно взаимодействующего с РБФК, при литоавтотрофном росте. Активность фосфорибулокиназы составила 2,5 мкмоль  мин-1
мин-1 


