

Мы поможем в написании ваших работ!
ЗНАЕТЕ ЛИ ВЫ?
|
Квантовая механика. Волновая ф-я и её физический смысл.Уравнение Шредингера. Диалектическое единствокорпускулярных и волновых свойств частиц.
КВАНТОВАЯ МЕХАНИКА, изучает состояния микрочастиц и их систем (элементарных частиц, атомных ядер, атомов, молекул, кристаллов), изменение этих состояний во времени, а также связь величин, характеризующих состояния микрочастиц, с эксперим. макроскопич. величинами. К. м. исследует уровни энергии, пространственные и импульсные характеристики систем частиц, эволюцию этих систем во времени, вероятности переходов между состояниями под влиянием взаимод. между системами и внеш. воздействий. В нерелятивистской К.м. для средних скоростей v всех частиц системы предполагается выполненным условие: (v /с)2<<1, где с - скорость света. Результаты нерелятивистской К. м. переходят в таковые классич. механики, когда выполняется принцип соответствия, т.е. когда произведение импульса каждой из взаимодействующих частиц на размер области, в к-рой это взаимод. существенно меняется, велико по сравнению с постоянной Планка  =1,0546.10-34 Дж.с. К.м. была сформулирована для объяснения явлений, к-рые не могли быть объяснены в рамках классич. механики и электродинамики. Трудами М. Планка (1900), А. Эйнштейна (1905, 1916) и Н. Бора (1912) было показано, что атомы имеют стационарные состояния, переходы между к-рыми происходят при излучении или поглощении кванта света, имеющего энергию =1,0546.10-34 Дж.с. К.м. была сформулирована для объяснения явлений, к-рые не могли быть объяснены в рамках классич. механики и электродинамики. Трудами М. Планка (1900), А. Эйнштейна (1905, 1916) и Н. Бора (1912) было показано, что атомы имеют стационарные состояния, переходы между к-рыми происходят при излучении или поглощении кванта света, имеющего энергию 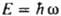 и импульс и импульс  , где w и k - круговая частота и волновой вектор световой волны соответственно. Проблема объяснения этих св-в атомов была решена почти одновременно с неск. сторон. Л. де Бройль (1924) предложил распространить волновые представления, привычные для описания электромагн. поля, на атомные частицы, сопоставляя своб. движению частицы с энергией Е и импульсом р волну , где w и k - круговая частота и волновой вектор световой волны соответственно. Проблема объяснения этих св-в атомов была решена почти одновременно с неск. сторон. Л. де Бройль (1924) предложил распространить волновые представления, привычные для описания электромагн. поля, на атомные частицы, сопоставляя своб. движению частицы с энергией Е и импульсом р волну 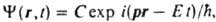 распространяющуюся в пространстве и времени t (r-радиус-вектор частицы, i - мнимая единица, С - постоянный множитель). Тем самым он предсказал дифракцию таких частиц при рассеянии на кристаллах. В. Гейзенберг (1925) нашел матричное представление для динамич. переменных классич. механики, позволившее объяснить структуру уровней энергии нек-рых систем. Так возникла матричная механика. Э. Шрёдингер [Шредингер] (1926) предложил дифференц. ур-ние, решениями к-рого при заданных граничных условиях являются собств. ф-ции y, названные волновыми ф-циями, и собств. значения, указывающие уровни энергии системы. Так возникла волновая механика. Анализ показал, что подходы В. Гейзенберга и Э. Шрёдингера [Шредингера] эквивалентны, поэтому термины "матричная механика", "волновая механика" и наиб. употребительный сейчас "К. м." являются синонимами. С вычислит, точки зрения, как правило, наиб. удобным оказывается метод решения ур-ния Шрёдингера [Шредингера]. Осн. постулаты К.м. При рассмотрении задач о состояниях частиц и их систем осн. положения К.м. обычно формулируют в след, виде: распространяющуюся в пространстве и времени t (r-радиус-вектор частицы, i - мнимая единица, С - постоянный множитель). Тем самым он предсказал дифракцию таких частиц при рассеянии на кристаллах. В. Гейзенберг (1925) нашел матричное представление для динамич. переменных классич. механики, позволившее объяснить структуру уровней энергии нек-рых систем. Так возникла матричная механика. Э. Шрёдингер [Шредингер] (1926) предложил дифференц. ур-ние, решениями к-рого при заданных граничных условиях являются собств. ф-ции y, названные волновыми ф-циями, и собств. значения, указывающие уровни энергии системы. Так возникла волновая механика. Анализ показал, что подходы В. Гейзенберга и Э. Шрёдингера [Шредингера] эквивалентны, поэтому термины "матричная механика", "волновая механика" и наиб. употребительный сейчас "К. м." являются синонимами. С вычислит, точки зрения, как правило, наиб. удобным оказывается метод решения ур-ния Шрёдингера [Шредингера]. Осн. постулаты К.м. При рассмотрении задач о состояниях частиц и их систем осн. положения К.м. обычно формулируют в след, виде:
1. Состояние системы из N микрочастиц полностью определяется волновой ф-цией y(r1,..., rN), где rl,..., rN - радиусы-векторы частиц. Если 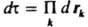 - элемент объема в конфигурац. пространстве переменных N частиц, то величина |y(r 1,..., r N;t)| 2 dtпропорциональна вероятности найти в момент времени t первую частицу вблизи точки с радиусом-вектором r1 в объеме dr 1(т. е. в параллелепипеде со сторонами dx 1, dy 1и dz 1, одной из вершин к-рого служит точка r1), вторую частицу - вблизи точки r2в объеме dr2 и т.д. (М. Борн, 1926). - элемент объема в конфигурац. пространстве переменных N частиц, то величина |y(r 1,..., r N;t)| 2 dtпропорциональна вероятности найти в момент времени t первую частицу вблизи точки с радиусом-вектором r1 в объеме dr 1(т. е. в параллелепипеде со сторонами dx 1, dy 1и dz 1, одной из вершин к-рого служит точка r1), вторую частицу - вблизи точки r2в объеме dr2 и т.д. (М. Борн, 1926).
2. Каждой наблюдаемой физ. величине А (координате, импульсу, энергии и т.п.) сопоставляется линейный оператор  . Для системы, находящейся в состоянии с волновой ф-цией y, при измерении величины А м.б. получены лишь те значения а i,к-рые являются собств. значениями оператора . Для системы, находящейся в состоянии с волновой ф-цией y, при измерении величины А м.б. получены лишь те значения а i,к-рые являются собств. значениями оператора  , т. е. удовлетворяют равенству: , т. е. удовлетворяют равенству: 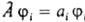 , где ji нек-рая ф-ция от тех же переменных, что и волновая ф-ция системы. Вероятность найти значение аi определяется квадратом модуля интеграла , где ji нек-рая ф-ция от тех же переменных, что и волновая ф-ция системы. Вероятность найти значение аi определяется квадратом модуля интеграла 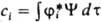 , а среднее значение , а среднее значение  - интегралом - интегралом 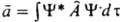 , где j*i и y* - ф-ции, комплексно сопряженные ji и y. Поскольку величины а iи их среднее вещественны, на операторы , где j*i и y* - ф-ции, комплексно сопряженные ji и y. Поскольку величины а iи их среднее вещественны, на операторы 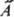 накладывается дополнит. ограничение: они должны быть эрмитовыми. Это означает, что для любых ф-ций j и y должно выполняться соотношение: накладывается дополнит. ограничение: они должны быть эрмитовыми. Это означает, что для любых ф-ций j и y должно выполняться соотношение: 
3. Операторы  , отвечающие наблюдаемым физ. величинам, к-рые определены в классич. механике (энергия, импульс и т. п.), получаются, если в соотношениях, установленных для этих величин классич. физикой, заменить координаты частиц операцией умножения на эти координаты, а импульсы - операцией дифференцирования (с точностью до множителя) по соответствующей переменной (т. наз. сопряженной координате). Напр., вместо координаты х употребляют оператор , отвечающие наблюдаемым физ. величинам, к-рые определены в классич. механике (энергия, импульс и т. п.), получаются, если в соотношениях, установленных для этих величин классич. физикой, заменить координаты частиц операцией умножения на эти координаты, а импульсы - операцией дифференцирования (с точностью до множителя) по соответствующей переменной (т. наз. сопряженной координате). Напр., вместо координаты х употребляют оператор  : :  ; вместо компоненты импульса рх -оператор ; вместо компоненты импульса рх -оператор 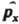 : :  Полученный при такой замене оператор соответствующей физ. величины должен быть записан так, чтобы он был эрмитовым. Так, операторы проекций момента кол-ва движения частицы записываются след. образом: Полученный при такой замене оператор соответствующей физ. величины должен быть записан так, чтобы он был эрмитовым. Так, операторы проекций момента кол-ва движения частицы записываются след. образом:  , , 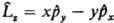 и и 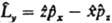 . Собств. значения оператора . Собств. значения оператора 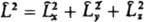 , равные , равные  , определяются неотрицат. целыми числами l, а собств. значения оператора проекции момента на к.-л. фиксированное направление, напр. ось z, - числами -l, -l+1,...,+l. , определяются неотрицат. целыми числами l, а собств. значения оператора проекции момента на к.-л. фиксированное направление, напр. ось z, - числами -l, -l+1,...,+l.
4. Волновые ф-ции y, описывающие состояния системы, являются решениями ур-ния Шрёдингера [Шредингера], или волнового ур-ния:
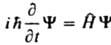
где  -оператор полной энергии системы, наз. оператором Гамильтона или гамильтонианом; он получается из классич. ф-ции Гамильтона по правилам, указанным в п. 3. -оператор полной энергии системы, наз. оператором Гамильтона или гамильтонианом; он получается из классич. ф-ции Гамильтона по правилам, указанным в п. 3.
5. У каждой элементарной частицы м.б. собств. момент кол-ва движения, не связанный с перемещением ее как целого. Этот момент наз. спином или собств. моментом кол-ва движения. Спин измеряется в единицах постоянной Планка и равен  , где s - характерное для каждого вида частиц целое или полуцелое неотрицат. число, наз. спиновым квантовым числом или просто спином. Проекция спина на любое фиксир. направление в пространстве может принимать значения (в единицах , где s - характерное для каждого вида частиц целое или полуцелое неотрицат. число, наз. спиновым квантовым числом или просто спином. Проекция спина на любое фиксир. направление в пространстве может принимать значения (в единицах 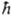 ) — s, — s +1,..., +s. Напр., спин электрона, протона и нейтрона равен 1/2,спин p-мезона-0, спин ядра атома дейтерия - l. Т. обр., частица или система из неск. частиц может находиться в разл. квантовых состояниях, каждому из к-рых отвечает свое значение спина и его проекции. Это обстоятельство обычно отражается в том, что для каждой частицы вводится помимо трех пространств, переменных дополнит, четвертая переменная s, от к-рой зависят и спиновые операторы. Волновая ф-ция системы с учетом спина м. б. записана в виде: y(r1, si; r2, s2;...; rN; sN; t)=y(1,2,...,N; t). Системы тождеств, частиц (одной и той же массы, заряда и т.д.) с целочисленным спином подчиняются статистике Бозе - Эйнштейна, системы частиц с полуцелым спином -статистике Ферми-Дирака (см. Статистическая термодинамика).В свою очередь, симметрия волновой ф-ции системы тождеств. частиц полностью определяется типом статистики, к-рой подчиняются частицы: для частиц с целым спином волновая ф-ция симметрична, т.е. не меняется при перестановке индексов двух тождеств. частиц; для частиц с полуцелым спином волновая ф-ция антисимметрична, т.е. меняет знак при любой такой перестановке (В. Паули, 1940). Перестановка индексов частиц означает переход к описанию того же состояния системы при др. порядке нумерации частиц. Состояния квантовой системы, описываемые волновыми ф-циями, наз. чистыми состояниями. Для них имеется максимально полная информация о квантовой системе. Однако в К. м. возможно описание и таких состояний, с к-рыми нельзя сопоставить определенную волновую ф-цию, а можно только указать набор вероятностей |сi|2 появления при измерении к.-л. физ. величины А состояний, в к-рых эта величина принимает определенные значения. Для таких состояний нельзя построить волновую ф-цию в виде линейной комбинации волновых ф-ций ji чистых состояний с коэффициентами сi, поскольку известны лишь квадраты модуля этих коэффициентов, но неизвестны их фазы. Такие состояния наз. смешанными. Они м.б. охарактеризованы нек-рой операторной ф-цией, наз. матрицей плотности и позволяющей вычислять средние значения и вероятности разл. значений физ. величин в таком состоянии. Матрица плотности r зависит от тех переменных, к-рые определяют квантовую систему, и от времени; она удовлетворяет квантовому ур-нию Лиувилля: ) — s, — s +1,..., +s. Напр., спин электрона, протона и нейтрона равен 1/2,спин p-мезона-0, спин ядра атома дейтерия - l. Т. обр., частица или система из неск. частиц может находиться в разл. квантовых состояниях, каждому из к-рых отвечает свое значение спина и его проекции. Это обстоятельство обычно отражается в том, что для каждой частицы вводится помимо трех пространств, переменных дополнит, четвертая переменная s, от к-рой зависят и спиновые операторы. Волновая ф-ция системы с учетом спина м. б. записана в виде: y(r1, si; r2, s2;...; rN; sN; t)=y(1,2,...,N; t). Системы тождеств, частиц (одной и той же массы, заряда и т.д.) с целочисленным спином подчиняются статистике Бозе - Эйнштейна, системы частиц с полуцелым спином -статистике Ферми-Дирака (см. Статистическая термодинамика).В свою очередь, симметрия волновой ф-ции системы тождеств. частиц полностью определяется типом статистики, к-рой подчиняются частицы: для частиц с целым спином волновая ф-ция симметрична, т.е. не меняется при перестановке индексов двух тождеств. частиц; для частиц с полуцелым спином волновая ф-ция антисимметрична, т.е. меняет знак при любой такой перестановке (В. Паули, 1940). Перестановка индексов частиц означает переход к описанию того же состояния системы при др. порядке нумерации частиц. Состояния квантовой системы, описываемые волновыми ф-циями, наз. чистыми состояниями. Для них имеется максимально полная информация о квантовой системе. Однако в К. м. возможно описание и таких состояний, с к-рыми нельзя сопоставить определенную волновую ф-цию, а можно только указать набор вероятностей |сi|2 появления при измерении к.-л. физ. величины А состояний, в к-рых эта величина принимает определенные значения. Для таких состояний нельзя построить волновую ф-цию в виде линейной комбинации волновых ф-ций ji чистых состояний с коэффициентами сi, поскольку известны лишь квадраты модуля этих коэффициентов, но неизвестны их фазы. Такие состояния наз. смешанными. Они м.б. охарактеризованы нек-рой операторной ф-цией, наз. матрицей плотности и позволяющей вычислять средние значения и вероятности разл. значений физ. величин в таком состоянии. Матрица плотности r зависит от тех переменных, к-рые определяют квантовую систему, и от времени; она удовлетворяет квантовому ур-нию Лиувилля: 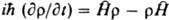
Ур-ние Шрёдингера [Шредингера] и мат. аппарат К. м. Ур-ние Шрёдингера [Шредингера] является линейным дифференциальным и - что очень важно - однородным ур-нием. Это означает, что если y1 и y2 - к.-л. два решения этого ур-ния, то и любая их линейная комбинация c1y1+с2y2с постоянными коэф. c1и с2будет также решением ур-ния Шрёдингера [Шредингера] (т. наз. принцип суперпозиции). Если гамильтониан 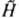 не зависит в явном виде от времени (напр., для своб. молекулы или для молекулы, находящейся во внеш. стационарном поле), ур-ние Шрёдингера [Шредингера] допускает разделение пространственных переменных, определяющих положения частиц, и времени. Волновая ф-ция состояния с энергией Ek (энергетич. уровень системы) принимает вид: не зависит в явном виде от времени (напр., для своб. молекулы или для молекулы, находящейся во внеш. стационарном поле), ур-ние Шрёдингера [Шредингера] допускает разделение пространственных переменных, определяющих положения частиц, и времени. Волновая ф-ция состояния с энергией Ek (энергетич. уровень системы) принимает вид:

где ф-ция Фk удовлетворяет ур-нию 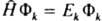 , к-рое наз. стационарнымур-нием Шрёдингера [Шредингера]. Вероятностная интерпретация квадрата модуля волновой ф-ции, сформулированная в п. 1 осн. постулатов К. м. для состояний системы с дискретным спектром уровней энергии, требует выполнения условия нормировки. Нормировка волновой ф-ции на единицу возможна, , к-рое наз. стационарнымур-нием Шрёдингера [Шредингера]. Вероятностная интерпретация квадрата модуля волновой ф-ции, сформулированная в п. 1 осн. постулатов К. м. для состояний системы с дискретным спектром уровней энергии, требует выполнения условия нормировки. Нормировка волновой ф-ции на единицу возможна,
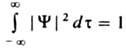
если соответствующий интеграл по всему конфигурац. пространству сходится, что имеет место всегда, когда модуль волновой ф-ции достаточно быстро убывает вне нек-рой конечной области (финитное движение). В этом случае энергетич. спектр, т. е. множество уровней энергии, оказывается дискретным, а волновые ф-ции, принадлежащие разл. уровням энергии (в общем случае-разл. собств. значениям эрмитова оператора), оказываются ортогональными:  , где dmn=1 при m=пи dmn=0 при т ¹ п. В противном случае, когда частицы уходят на сколь угодно большое расстояние, напр., от места их столкновения (инфинитное движение), спектр собств. значений непрерывен, а нормировка и ортогональность волновых ф-ций таких состояний формулируется с помощью 5-ф-ции. Напр., для состояний частицы с определенными импульсами p и р , где dmn=1 при m=пи dmn=0 при т ¹ п. В противном случае, когда частицы уходят на сколь угодно большое расстояние, напр., от места их столкновения (инфинитное движение), спектр собств. значений непрерывен, а нормировка и ортогональность волновых ф-ций таких состояний формулируется с помощью 5-ф-ции. Напр., для состояний частицы с определенными импульсами p и р
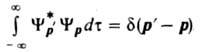
Волновая ф-ция, описывающая к.-л. состояние системы, определяется неоднозначно, но все такие описания эквивалентны, т. е. приводят к одинаковым наблюдаемым следствиям. Так, любую волновую ф-цию можно умножить на произвольный фазовый множитель ехр(iа), где a - действительная постоянная, не меняя средних значений любых операторов. Далее, любые преобразования систем отсчета, оставляющие инвариантным ур-ние Шрёдингера [Шредингера], преобразуют волновую ф-цию, но все получаемые при этом ее представления будут эквивалентными. И, наконец, волновая ф-ция м. б. задана в разл. формах при разл. представлениях пространства, на к-ром определяются волновые ф-ции; так, волновая ф-ция, заданная как ф-ция пространств. координат, т.е. в конфигурац. (или координатном) представлении, м. б. разложена в интеграл Фурье, так что коэффициенты этого разложения (т.е. ее фурье-образ) будут представлять волновую ф-цию того же состояния в импульсном представлении. Мат. аппарат К. м. определяется прежде всего тем, что наблюдаемые физ. величины представляются эрмитовыми операторами. Разл. соотношения между наблюдаемыми величинами должны сказываться на тех мат. соотношениях, к-рым подчиняются операторы. Если, напр., для рассматриваемого состояния системы волновая ф-ция является собст. ф-цией оператора  нек-рой наблюдаемой величины А с собств. значением а, то в этом состоянии измерение величины А будет приводить к одному и тому же значению а. Измерение др. физ. величин F(k) будет также приводить к определенным значениям f(k)только в том случае, если эти величины имеют в рассматриваемом состоянии определенные значения. Это возможно, если отвечающие этим величинам операторы нек-рой наблюдаемой величины А с собств. значением а, то в этом состоянии измерение величины А будет приводить к одному и тому же значению а. Измерение др. физ. величин F(k) будет также приводить к определенным значениям f(k)только в том случае, если эти величины имеют в рассматриваемом состоянии определенные значения. Это возможно, если отвечающие этим величинам операторы 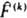 коммутируют с оператором коммутируют с оператором 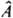 , т. е. если выполняется соотношение: , т. е. если выполняется соотношение: 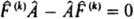 . Если же нек-рый оператор . Если же нек-рый оператор 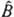 не коммутирует с А, так что не коммутирует с А, так что 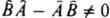 , то не может существовать состояний системы, для к-рых А и В имеют одновременно определенные значения. В частности, не существует состояний, в к-рых координата и импульс частицы имели бы определенные значения, т. к. имеют место соотношения: , то не может существовать состояний системы, для к-рых А и В имеют одновременно определенные значения. В частности, не существует состояний, в к-рых координата и импульс частицы имели бы определенные значения, т. к. имеют место соотношения:  , где индексы j и k принимают значения 1, 2, 3 и относятся к нумерации переменных: , где индексы j и k принимают значения 1, 2, 3 и относятся к нумерации переменных: 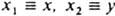 и и 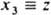 . Из приведенных коммутационных соотношений для координат и импульсов следует, что в любом состоянии произведение среднеквадратичных разбросов координат Dr2 и импульсов Dp2для каждой из частиц удовлетворяет соотношению: . Из приведенных коммутационных соотношений для координат и импульсов следует, что в любом состоянии произведение среднеквадратичных разбросов координат Dr2 и импульсов Dp2для каждой из частиц удовлетворяет соотношению: 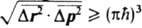 . Это неравенство наз. соотношениемнеопределенностей для координат и импульсов. Следует подчеркнуть, что в К. м. подобного типа соотношение справедливо также для энергии системы и времени: . Это неравенство наз. соотношениемнеопределенностей для координат и импульсов. Следует подчеркнуть, что в К. м. подобного типа соотношение справедливо также для энергии системы и времени:  , где DE - разброс в измеряемых значениях энергии, обусловленный взаимод. между измерит, прибором и исследуемой системой, Dt - длительность процесса измерения. Это же соотношение может иметь и др. смысл: в качестве D Е может выступать неопределенность значения энергии нестационарного состояния замкнутой системы, тогда Dt будет тем характерным для данного состояния временем, за к-рое существенно меняются средние значения физ. величин. Соотношения неопределенностей для координат и импульсов, для энергии и времени имеют важное значение для понимания осн. положений К. м. и их интерпретации. Поэтому эти соотношения часто наз. принципом неопределенности. Совокупность волновых ф-ций в заданном представлении (конфигурационном или импульсном), описывающих стационарные квантовые состояния системы из N частиц, наз. полной, если любая др. волновая ф-ция этой системы м. б. представлена в виде линейной комбинации или ряда, состоящего из таких ф-ций. Волновые ф-ции полной системы являются совместными собств. ф-циями 3N (без учета спина) или 4N(при учете спина) эрмитовых операторов, к-рые коммутируют между собой. Один из этих операторов - гамильтониан. Если одному и тому же уровню энергии системы отвечает неск. состояний, различающихся собств. значениями др. операторов, то такие уровни наз. вырожденными (см. Вырождение энергетических уровней). Собств. значения ряда операторов либо пропорциональны целым числам, либо выражаются через целые числа. Такие числа наз. квантовыми числами; они часто служат для идентификации состояний квантовомеханич. системы. В ряде случаев набор квантовых чисел позволяет полностью задать состояние системы. Напр., для указания состояния атома водорода достаточно четырех квантовых чисел: главное квантовое число n=1,2,... определяет спектр возможных энергий Еп =- R/n2, где R - постоянная Ридберга, равная 13,6 эВ (109737 см-1); азимутальное (или орбитальное) квантовое число l =0,1,..., n—1 (при заданном п)определяет квадрат орбитального (углового) момента , где DE - разброс в измеряемых значениях энергии, обусловленный взаимод. между измерит, прибором и исследуемой системой, Dt - длительность процесса измерения. Это же соотношение может иметь и др. смысл: в качестве D Е может выступать неопределенность значения энергии нестационарного состояния замкнутой системы, тогда Dt будет тем характерным для данного состояния временем, за к-рое существенно меняются средние значения физ. величин. Соотношения неопределенностей для координат и импульсов, для энергии и времени имеют важное значение для понимания осн. положений К. м. и их интерпретации. Поэтому эти соотношения часто наз. принципом неопределенности. Совокупность волновых ф-ций в заданном представлении (конфигурационном или импульсном), описывающих стационарные квантовые состояния системы из N частиц, наз. полной, если любая др. волновая ф-ция этой системы м. б. представлена в виде линейной комбинации или ряда, состоящего из таких ф-ций. Волновые ф-ции полной системы являются совместными собств. ф-циями 3N (без учета спина) или 4N(при учете спина) эрмитовых операторов, к-рые коммутируют между собой. Один из этих операторов - гамильтониан. Если одному и тому же уровню энергии системы отвечает неск. состояний, различающихся собств. значениями др. операторов, то такие уровни наз. вырожденными (см. Вырождение энергетических уровней). Собств. значения ряда операторов либо пропорциональны целым числам, либо выражаются через целые числа. Такие числа наз. квантовыми числами; они часто служат для идентификации состояний квантовомеханич. системы. В ряде случаев набор квантовых чисел позволяет полностью задать состояние системы. Напр., для указания состояния атома водорода достаточно четырех квантовых чисел: главное квантовое число n=1,2,... определяет спектр возможных энергий Еп =- R/n2, где R - постоянная Ридберга, равная 13,6 эВ (109737 см-1); азимутальное (или орбитальное) квантовое число l =0,1,..., n—1 (при заданном п)определяет квадрат орбитального (углового) момента  ; магн. квантовое число т=-l, - l (-)+1,..., l определяет проекцию ; магн. квантовое число т=-l, - l (-)+1,..., l определяет проекцию 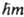 орбитального момента на заданную ось; спиновое квантовое число s (- 1/2 или -1/2)определяет проекцию спина ( орбитального момента на заданную ось; спиновое квантовое число s (- 1/2 или -1/2)определяет проекцию спина ( или - или -  ) на ту же ось. При описании молекул также используются квантовые числа, задающие, напр., состояния отдельных электронов (см. Орбиталь),возможные значения спина, орбитального и полного моментов, а также колебат. квантовые числа, характеризующие колебат. составляющую полной энергии, и вращат. квантовые числа, характеризующие вращат. составляющую полной энергии молекулы. Точное решение ур-ния Шрёдингера [Шредингера] удается найти лишь в редких случаях. Поэтому важное значение имеют разл. приближенные методы. Если при рассматриваемом движении импульсы частиц достаточно велики, а потенц. энергия их взаимод. изменяется медленно, то применимо квазиклассич. приближение. Оно позволяет, напр., рассчитывать вероятность прохождения частиц и квантовых систем через области пространства, к-рые недоступны для них согласно классич. механике вследствие недостатка энергии (см. Туннельный эффект).Иногда приближенные волновые ф-ции к.-л. состояния м.б. найдены в виде суперпозиции волновых ф-ций близкой, но более простой системы с коэффициентами, подбираемыми из условия минимума энергии системы (см. Вариационный метод).Если взаимод. в системе частиц записывается в виде суммы неск. частей, с одной из к-рых точное решение ур-ния Шрёдингера [Шредингера] возможно, а остальные могут рассматриваться как малые возмущения первой, применяют возмущений теорию. Специфич. задачей К. м. является рассмотрение нестационарных волновых ф-ций, соответствующих переходам системы частиц из одного стационарного состояния в другое под влиянием нек-рого возмущения, зависящего от времени. ) на ту же ось. При описании молекул также используются квантовые числа, задающие, напр., состояния отдельных электронов (см. Орбиталь),возможные значения спина, орбитального и полного моментов, а также колебат. квантовые числа, характеризующие колебат. составляющую полной энергии, и вращат. квантовые числа, характеризующие вращат. составляющую полной энергии молекулы. Точное решение ур-ния Шрёдингера [Шредингера] удается найти лишь в редких случаях. Поэтому важное значение имеют разл. приближенные методы. Если при рассматриваемом движении импульсы частиц достаточно велики, а потенц. энергия их взаимод. изменяется медленно, то применимо квазиклассич. приближение. Оно позволяет, напр., рассчитывать вероятность прохождения частиц и квантовых систем через области пространства, к-рые недоступны для них согласно классич. механике вследствие недостатка энергии (см. Туннельный эффект).Иногда приближенные волновые ф-ции к.-л. состояния м.б. найдены в виде суперпозиции волновых ф-ций близкой, но более простой системы с коэффициентами, подбираемыми из условия минимума энергии системы (см. Вариационный метод).Если взаимод. в системе частиц записывается в виде суммы неск. частей, с одной из к-рых точное решение ур-ния Шрёдингера [Шредингера] возможно, а остальные могут рассматриваться как малые возмущения первой, применяют возмущений теорию. Специфич. задачей К. м. является рассмотрение нестационарных волновых ф-ций, соответствующих переходам системы частиц из одного стационарного состояния в другое под влиянием нек-рого возмущения, зависящего от времени.
48. Излучение и поглощение энергии атомами и молекулами.Оптические атомные спектры. Молекулярные спектры. Применение спектрометрии в медицине и биологии.
Атомные спектры, оптические спектры, получающиеся при испускании или поглощении электромагнитного излучения свободными или слабо связанными атомами (например, в газах или парах). Являются линейчатыми, то есть состоят из отдельных спектральных линий, характеризуемых частотой излучения v, которая соответствует квантовому переходу между уровнями энергии Ei и Ek атома согласно соотношению: hv = Ei- Ek где h -постоянная Планка. Спектральные линии можно характеризовать также длиной волны 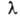 = c/v (с - скорость света), волновым числом = c/v (с - скорость света), волновым числом 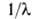 = v/c и энергией фотона hv. Частоты спектральных линий выражают в с -1, длины волн - в нм и мкм, а также в А, волновые числа - в см -1, энергии фотонов - в эВ. Типичные атомные спектры наблюдаются в видимой, УФ- и ближней ИК-областях спектра. Спектры испускания, или эмиссионные, получают при возбуждении атомов различными способами (фотонами, электронным ударом и т.д.), спектры поглощения, или абсорбционные, - при прохождении электромагнитного излучения, обладающего непрерывным спектром, через атомарные газы или пары. Для наблюдения атомных спектров применяют приборы с фотографической или фотоэлектрической регистрацией. = v/c и энергией фотона hv. Частоты спектральных линий выражают в с -1, длины волн - в нм и мкм, а также в А, волновые числа - в см -1, энергии фотонов - в эВ. Типичные атомные спектры наблюдаются в видимой, УФ- и ближней ИК-областях спектра. Спектры испускания, или эмиссионные, получают при возбуждении атомов различными способами (фотонами, электронным ударом и т.д.), спектры поглощения, или абсорбционные, - при прохождении электромагнитного излучения, обладающего непрерывным спектром, через атомарные газы или пары. Для наблюдения атомных спектров применяют приборы с фотографической или фотоэлектрической регистрацией.
Атомные спектры обладают ярко выраженной индивидуальностью: каждому элементу соответствует свой спектр нейтрального атома (так называемый дуговой спектр) и свои спектры последовательно образующихся положительных ионов (так называемые искровые спектры). Линии в этих спектрах обозначают римскими цифрами, например линии FeI, FeII, FeIII в спектрах железа соответствуют спектрам Fe, Fe+, Fe2+.
Вид спектра зависит как от электронного строения данного атома, так и от внешних условий - температуры, давления, напряженностей электрического и магнитного полей и т. п. В зависимости от способа возбуждения атома могут возникать отдельные линии спектра, некоторые его участки, весь спектр нейтрального атома или его иона определенной кратности. Положение линий в таких спектрах подчиняется определенным закономерностям, которые наиболее просты для атомов с одним внешним электроном, то есть для атома Н и нейтральных атомов щелочных металлов, а также изоэлектронных с ними ионов. В спектрах таких атомов наблюдаются спектральные серии, каждая из которых (в случае спектров испускания) получается при возможных квантовых переходах с последовательных вышележащих уровней энергии на один и тот же нижележащий (в спектрах поглощения – при обратных переходах). Промежутки между линиями одной серии убывают в сторону больших частот, то есть линии сходятся к границе серии - максимальной для данной серии частоте, соответствующей ионизации атома. Для атома Н волновые числа линий всех серий с большой точностью определяются обобщенной формулой Бальмера:
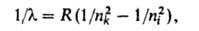
где пk и ni - значения главного квантового числа для уровней энергии, между которыми происходит квантовый переход, причем nk, характеризующее нижний уровень энергии, определяет серию, а ni - ее отдельные линии (при  получается граница серии); R-постоянная Ридберга. Аналогичные серии наблюдаются и в спектрах водородоподобных атомов, однако значения волновых чисел для спектральных линий ионов Не+, Li2+,... в Z2 раз (Z - пoрядковый номер элемента) больше, чем для соответствующих линий атома Н. получается граница серии); R-постоянная Ридберга. Аналогичные серии наблюдаются и в спектрах водородоподобных атомов, однако значения волновых чисел для спектральных линий ионов Не+, Li2+,... в Z2 раз (Z - пoрядковый номер элемента) больше, чем для соответствующих линий атома Н.
Спектры атомов щелочных металлов, имеющих один электрон на внешней электронной оболочке, схожи со спектром Н, но смещены в область меньших частот; число спектральных линий в них увеличивается, а закономерности в расположении линий усложняются. Пример - спектр Na, атом которого имеет электронную конфигурацию Is22s22p63s с легковозбуждаемым внешним электроном 3s. Переходу этого электрона из состояния Зр в состояние 3s соответствует желтая линия Na (дублет  = 589,0 нм и = 589,0 нм и  = 589,6 нм); это - наиболее яркая линия, с которой начинается так называемая, главная серия Na. Линии этой серии в спектре испускания соответствуют переходам из состояний Зр, 4р, 5р>... в состояние 3s. = 589,6 нм); это - наиболее яркая линия, с которой начинается так называемая, главная серия Na. Линии этой серии в спектре испускания соответствуют переходам из состояний Зр, 4р, 5р>... в состояние 3s.
Для атомов последующих групп элементов в периодической системе, обладающих двумя или несколькими внешними электронами, спектры еще более усложняются, что обусловлено взаимодействием электронов. Особенно сложны спектры атомов с заполняющимися d- и f-оболочками; число линий в таких спектрах достигает многих тысяч, простых закономерностей в них не обнаруживается. Однако и для сложных спектров можно произвести систематику оптических квантовых переходов и определить схему уровней энергии. Систематика спектров атомов с двумя и более внеш. Электронами основана на приближенной характеристике отдельных электронов при помощи квантовых чисел n и l с учетом взаимодействия этих электронов друг с другом. При этом приходится учитывать как их электростатического взаимодействия, так и спин-орбитальное, что приводит к расщеплению уровней энергии (так называемая тонкая структура).
В результате этого взаимодействия у большинства атомов каждая спектральная линия представляет собой более или менее тесную группу линий - мультиплет. Так, у всех щелочных металлов наблюдаются двойные линии (дублеты), причем расстояния между линиями увеличиваются с увеличением порядкового номера элемента. Для щелочноземельных элементов наблюдаются одиночные линии (синглеты) и тройные (триплеты). В спектрах атомов последующих групп периодической системы элементов наблюдаются еще более сложные мультиплеты, причем атомам с нечетным числом электронов соответствуют четные мультиплеты (дублеты, квартеты), а с четным числом - нечетные (триплеты, квинтеты). Кроме тонкой структуры в атомных спектрах наблюдается также сверхтонкая структура линий (примерно в 1000 раз уже, чем мультиплетная), обусловленная взаимодействием электронов с магнитными и электрическими моментами ядра.
В атомных спектрах проявляются не все возможные квантовые переходы, а лишь разрешенные правилами отбора. Так, в случае атома с одним внеш. электроном разрешены лишь переходы между уровнями, для которых орбитальное квантовое число l изменяется на 1 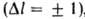 , т. е. s-уровни (l = 0) комбинируют с р-уровнями (l=1), р-уровни - с d-уровнями (l = 2) и т.д. Количественная характеристика разрешенного оптического квантового перехода - его вероятность, определяющая интенсивность спектральной линии, соответствующей этому переходу. Вероятности переходов в простейших случаях могут быть рассчитаны методами квантовой механики. , т. е. s-уровни (l = 0) комбинируют с р-уровнями (l=1), р-уровни - с d-уровнями (l = 2) и т.д. Количественная характеристика разрешенного оптического квантового перехода - его вероятность, определяющая интенсивность спектральной линии, соответствующей этому переходу. Вероятности переходов в простейших случаях могут быть рассчитаны методами квантовой механики.
Под влиянием внешних электрических и магнитных полей происходит расщепление спектральных линий. Возмущающие факторы, существующие в излучающей среде, вызывают уширение и сдвиг спектральных линий.
Методы, основанные на измерении частот и интенсивностей линий в спектре, применяют для решения различных задач спектроскопии: проведения общей систематики спектров многоэлектронных атомов; определения уровней энергии таких атомов (это существенно, в частности, при квантово-химических расчетах); нахождения вероятностей переходов и времен жизни возбужденных состояний; изучения механизмов возбуждения атомов; измерения ядерных моментов и т. п. Индивидуальность атомные спектры используют для качественного определения элементного состава вещества, а зависимость интенсивности линий от концентрации излучающих атомов - для количественного анализа.
Исследования атомных спектров сыграли важнейшую роль в развитии представлений о строении атома.
|



 =1,0546.10-34 Дж.с. К.м. была сформулирована для объяснения явлений, к-рые не могли быть объяснены в рамках классич. механики и электродинамики. Трудами М. Планка (1900), А. Эйнштейна (1905, 1916) и Н. Бора (1912) было показано, что атомы имеют стационарные состояния, переходы между к-рыми происходят при излучении или поглощении кванта света, имеющего энергию
=1,0546.10-34 Дж.с. К.м. была сформулирована для объяснения явлений, к-рые не могли быть объяснены в рамках классич. механики и электродинамики. Трудами М. Планка (1900), А. Эйнштейна (1905, 1916) и Н. Бора (1912) было показано, что атомы имеют стационарные состояния, переходы между к-рыми происходят при излучении или поглощении кванта света, имеющего энергию 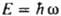 и импульс
и импульс  , где w и k - круговая частота и волновой вектор световой волны соответственно. Проблема объяснения этих св-в атомов была решена почти одновременно с неск. сторон. Л. де Бройль (1924) предложил распространить волновые представления, привычные для описания электромагн. поля, на атомные частицы, сопоставляя своб. движению частицы с энергией Е и импульсом р волну
, где w и k - круговая частота и волновой вектор световой волны соответственно. Проблема объяснения этих св-в атомов была решена почти одновременно с неск. сторон. Л. де Бройль (1924) предложил распространить волновые представления, привычные для описания электромагн. поля, на атомные частицы, сопоставляя своб. движению частицы с энергией Е и импульсом р волну 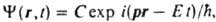 распространяющуюся в пространстве и времени t (r-радиус-вектор частицы, i - мнимая единица, С - постоянный множитель). Тем самым он предсказал дифракцию таких частиц при рассеянии на кристаллах. В. Гейзенберг (1925) нашел матричное представление для динамич. переменных классич. механики, позволившее объяснить структуру уровней энергии нек-рых систем. Так возникла матричная механика. Э. Шрёдингер [Шредингер] (1926) предложил дифференц. ур-ние, решениями к-рого при заданных граничных условиях являются собств. ф-ции y, названные волновыми ф-циями, и собств. значения, указывающие уровни энергии системы. Так возникла волновая механика. Анализ показал, что подходы В. Гейзенберга и Э. Шрёдингера [Шредингера] эквивалентны, поэтому термины "матричная механика", "волновая механика" и наиб. употребительный сейчас "К. м." являются синонимами. С вычислит, точки зрения, как правило, наиб. удобным оказывается метод решения ур-ния Шрёдингера [Шредингера]. Осн. постулаты К.м. При рассмотрении задач о состояниях частиц и их систем осн. положения К.м. обычно формулируют в след, виде:
распространяющуюся в пространстве и времени t (r-радиус-вектор частицы, i - мнимая единица, С - постоянный множитель). Тем самым он предсказал дифракцию таких частиц при рассеянии на кристаллах. В. Гейзенберг (1925) нашел матричное представление для динамич. переменных классич. механики, позволившее объяснить структуру уровней энергии нек-рых систем. Так возникла матричная механика. Э. Шрёдингер [Шредингер] (1926) предложил дифференц. ур-ние, решениями к-рого при заданных граничных условиях являются собств. ф-ции y, названные волновыми ф-циями, и собств. значения, указывающие уровни энергии системы. Так возникла волновая механика. Анализ показал, что подходы В. Гейзенберга и Э. Шрёдингера [Шредингера] эквивалентны, поэтому термины "матричная механика", "волновая механика" и наиб. употребительный сейчас "К. м." являются синонимами. С вычислит, точки зрения, как правило, наиб. удобным оказывается метод решения ур-ния Шрёдингера [Шредингера]. Осн. постулаты К.м. При рассмотрении задач о состояниях частиц и их систем осн. положения К.м. обычно формулируют в след, виде: 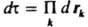 - элемент объема в конфигурац. пространстве переменных N частиц, то величина |y(r 1,..., r N;t)| 2 dtпропорциональна вероятности найти в момент времени t первую частицу вблизи точки с радиусом-вектором r1 в объеме dr 1(т. е. в параллелепипеде со сторонами dx 1, dy 1и dz 1, одной из вершин к-рого служит точка r1), вторую частицу - вблизи точки r2в объеме dr2 и т.д. (М. Борн, 1926).
- элемент объема в конфигурац. пространстве переменных N частиц, то величина |y(r 1,..., r N;t)| 2 dtпропорциональна вероятности найти в момент времени t первую частицу вблизи точки с радиусом-вектором r1 в объеме dr 1(т. е. в параллелепипеде со сторонами dx 1, dy 1и dz 1, одной из вершин к-рого служит точка r1), вторую частицу - вблизи точки r2в объеме dr2 и т.д. (М. Борн, 1926).  . Для системы, находящейся в состоянии с волновой ф-цией y, при измерении величины А м.б. получены лишь те значения а i,к-рые являются собств. значениями оператора
. Для системы, находящейся в состоянии с волновой ф-цией y, при измерении величины А м.б. получены лишь те значения а i,к-рые являются собств. значениями оператора  , т. е. удовлетворяют равенству:
, т. е. удовлетворяют равенству: 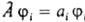 , где ji нек-рая ф-ция от тех же переменных, что и волновая ф-ция системы. Вероятность найти значение аi определяется квадратом модуля интеграла
, где ji нек-рая ф-ция от тех же переменных, что и волновая ф-ция системы. Вероятность найти значение аi определяется квадратом модуля интеграла 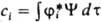 , а среднее значение
, а среднее значение  - интегралом
- интегралом 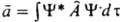 , где j*i и y* - ф-ции, комплексно сопряженные ji и y. Поскольку величины а iи их среднее вещественны, на операторы
, где j*i и y* - ф-ции, комплексно сопряженные ji и y. Поскольку величины а iи их среднее вещественны, на операторы 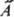 накладывается дополнит. ограничение: они должны быть эрмитовыми. Это означает, что для любых ф-ций j и y должно выполняться соотношение:
накладывается дополнит. ограничение: они должны быть эрмитовыми. Это означает, что для любых ф-ций j и y должно выполняться соотношение: 
 , отвечающие наблюдаемым физ. величинам, к-рые определены в классич. механике (энергия, импульс и т. п.), получаются, если в соотношениях, установленных для этих величин классич. физикой, заменить координаты частиц операцией умножения на эти координаты, а импульсы - операцией дифференцирования (с точностью до множителя) по соответствующей переменной (т. наз. сопряженной координате). Напр., вместо координаты х употребляют оператор
, отвечающие наблюдаемым физ. величинам, к-рые определены в классич. механике (энергия, импульс и т. п.), получаются, если в соотношениях, установленных для этих величин классич. физикой, заменить координаты частиц операцией умножения на эти координаты, а импульсы - операцией дифференцирования (с точностью до множителя) по соответствующей переменной (т. наз. сопряженной координате). Напр., вместо координаты х употребляют оператор  :
:  ; вместо компоненты импульса рх -оператор
; вместо компоненты импульса рх -оператор 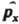 :
:  Полученный при такой замене оператор соответствующей физ. величины должен быть записан так, чтобы он был эрмитовым. Так, операторы проекций момента кол-ва движения частицы записываются след. образом:
Полученный при такой замене оператор соответствующей физ. величины должен быть записан так, чтобы он был эрмитовым. Так, операторы проекций момента кол-ва движения частицы записываются след. образом:  ,
, 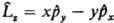 и
и 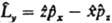 . Собств. значения оператора
. Собств. значения оператора 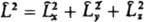 , равные
, равные  , определяются неотрицат. целыми числами l, а собств. значения оператора проекции момента на к.-л. фиксированное направление, напр. ось z, - числами -l, -l+1,...,+l.
, определяются неотрицат. целыми числами l, а собств. значения оператора проекции момента на к.-л. фиксированное направление, напр. ось z, - числами -l, -l+1,...,+l. 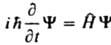
 -оператор полной энергии системы, наз. оператором Гамильтона или гамильтонианом; он получается из классич. ф-ции Гамильтона по правилам, указанным в п. 3.
-оператор полной энергии системы, наз. оператором Гамильтона или гамильтонианом; он получается из классич. ф-ции Гамильтона по правилам, указанным в п. 3.  , где s - характерное для каждого вида частиц целое или полуцелое неотрицат. число, наз. спиновым квантовым числом или просто спином. Проекция спина на любое фиксир. направление в пространстве может принимать значения (в единицах
, где s - характерное для каждого вида частиц целое или полуцелое неотрицат. число, наз. спиновым квантовым числом или просто спином. Проекция спина на любое фиксир. направление в пространстве может принимать значения (в единицах 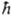 ) — s, — s +1,..., +s. Напр., спин электрона, протона и нейтрона равен 1/2,спин p-мезона-0, спин ядра атома дейтерия - l. Т. обр., частица или система из неск. частиц может находиться в разл. квантовых состояниях, каждому из к-рых отвечает свое значение спина и его проекции. Это обстоятельство обычно отражается в том, что для каждой частицы вводится помимо трех пространств, переменных дополнит, четвертая переменная s, от к-рой зависят и спиновые операторы. Волновая ф-ция системы с учетом спина м. б. записана в виде: y(r1, si; r2, s2;...; rN; sN; t)=y(1,2,...,N; t). Системы тождеств, частиц (одной и той же массы, заряда и т.д.) с целочисленным спином подчиняются статистике Бозе - Эйнштейна, системы частиц с полуцелым спином -статистике Ферми-Дирака (см. Статистическая термодинамика).В свою очередь, симметрия волновой ф-ции системы тождеств. частиц полностью определяется типом статистики, к-рой подчиняются частицы: для частиц с целым спином волновая ф-ция симметрична, т.е. не меняется при перестановке индексов двух тождеств. частиц; для частиц с полуцелым спином волновая ф-ция антисимметрична, т.е. меняет знак при любой такой перестановке (В. Паули, 1940). Перестановка индексов частиц означает переход к описанию того же состояния системы при др. порядке нумерации частиц. Состояния квантовой системы, описываемые волновыми ф-циями, наз. чистыми состояниями. Для них имеется максимально полная информация о квантовой системе. Однако в К. м. возможно описание и таких состояний, с к-рыми нельзя сопоставить определенную волновую ф-цию, а можно только указать набор вероятностей |сi|2 появления при измерении к.-л. физ. величины А состояний, в к-рых эта величина принимает определенные значения. Для таких состояний нельзя построить волновую ф-цию в виде линейной комбинации волновых ф-ций ji чистых состояний с коэффициентами сi, поскольку известны лишь квадраты модуля этих коэффициентов, но неизвестны их фазы. Такие состояния наз. смешанными. Они м.б. охарактеризованы нек-рой операторной ф-цией, наз. матрицей плотности и позволяющей вычислять средние значения и вероятности разл. значений физ. величин в таком состоянии. Матрица плотности r зависит от тех переменных, к-рые определяют квантовую систему, и от времени; она удовлетворяет квантовому ур-нию Лиувилля:
) — s, — s +1,..., +s. Напр., спин электрона, протона и нейтрона равен 1/2,спин p-мезона-0, спин ядра атома дейтерия - l. Т. обр., частица или система из неск. частиц может находиться в разл. квантовых состояниях, каждому из к-рых отвечает свое значение спина и его проекции. Это обстоятельство обычно отражается в том, что для каждой частицы вводится помимо трех пространств, переменных дополнит, четвертая переменная s, от к-рой зависят и спиновые операторы. Волновая ф-ция системы с учетом спина м. б. записана в виде: y(r1, si; r2, s2;...; rN; sN; t)=y(1,2,...,N; t). Системы тождеств, частиц (одной и той же массы, заряда и т.д.) с целочисленным спином подчиняются статистике Бозе - Эйнштейна, системы частиц с полуцелым спином -статистике Ферми-Дирака (см. Статистическая термодинамика).В свою очередь, симметрия волновой ф-ции системы тождеств. частиц полностью определяется типом статистики, к-рой подчиняются частицы: для частиц с целым спином волновая ф-ция симметрична, т.е. не меняется при перестановке индексов двух тождеств. частиц; для частиц с полуцелым спином волновая ф-ция антисимметрична, т.е. меняет знак при любой такой перестановке (В. Паули, 1940). Перестановка индексов частиц означает переход к описанию того же состояния системы при др. порядке нумерации частиц. Состояния квантовой системы, описываемые волновыми ф-циями, наз. чистыми состояниями. Для них имеется максимально полная информация о квантовой системе. Однако в К. м. возможно описание и таких состояний, с к-рыми нельзя сопоставить определенную волновую ф-цию, а можно только указать набор вероятностей |сi|2 появления при измерении к.-л. физ. величины А состояний, в к-рых эта величина принимает определенные значения. Для таких состояний нельзя построить волновую ф-цию в виде линейной комбинации волновых ф-ций ji чистых состояний с коэффициентами сi, поскольку известны лишь квадраты модуля этих коэффициентов, но неизвестны их фазы. Такие состояния наз. смешанными. Они м.б. охарактеризованы нек-рой операторной ф-цией, наз. матрицей плотности и позволяющей вычислять средние значения и вероятности разл. значений физ. величин в таком состоянии. Матрица плотности r зависит от тех переменных, к-рые определяют квантовую систему, и от времени; она удовлетворяет квантовому ур-нию Лиувилля: 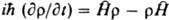
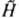 не зависит в явном виде от времени (напр., для своб. молекулы или для молекулы, находящейся во внеш. стационарном поле), ур-ние Шрёдингера [Шредингера] допускает разделение пространственных переменных, определяющих положения частиц, и времени. Волновая ф-ция состояния с энергией Ek (энергетич. уровень системы) принимает вид:
не зависит в явном виде от времени (напр., для своб. молекулы или для молекулы, находящейся во внеш. стационарном поле), ур-ние Шрёдингера [Шредингера] допускает разделение пространственных переменных, определяющих положения частиц, и времени. Волновая ф-ция состояния с энергией Ek (энергетич. уровень системы) принимает вид: 
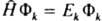 , к-рое наз. стационарнымур-нием Шрёдингера [Шредингера]. Вероятностная интерпретация квадрата модуля волновой ф-ции, сформулированная в п. 1 осн. постулатов К. м. для состояний системы с дискретным спектром уровней энергии, требует выполнения условия нормировки. Нормировка волновой ф-ции на единицу возможна,
, к-рое наз. стационарнымур-нием Шрёдингера [Шредингера]. Вероятностная интерпретация квадрата модуля волновой ф-ции, сформулированная в п. 1 осн. постулатов К. м. для состояний системы с дискретным спектром уровней энергии, требует выполнения условия нормировки. Нормировка волновой ф-ции на единицу возможна,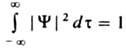
 , где dmn=1 при m=пи dmn=0 при т ¹ п. В противном случае, когда частицы уходят на сколь угодно большое расстояние, напр., от места их столкновения (инфинитное движение), спектр собств. значений непрерывен, а нормировка и ортогональность волновых ф-ций таких состояний формулируется с помощью 5-ф-ции. Напр., для состояний частицы с определенными импульсами p и р
, где dmn=1 при m=пи dmn=0 при т ¹ п. В противном случае, когда частицы уходят на сколь угодно большое расстояние, напр., от места их столкновения (инфинитное движение), спектр собств. значений непрерывен, а нормировка и ортогональность волновых ф-ций таких состояний формулируется с помощью 5-ф-ции. Напр., для состояний частицы с определенными импульсами p и р 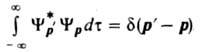
 нек-рой наблюдаемой величины А с собств. значением а, то в этом состоянии измерение величины А будет приводить к одному и тому же значению а. Измерение др. физ. величин F(k) будет также приводить к определенным значениям f(k)только в том случае, если эти величины имеют в рассматриваемом состоянии определенные значения. Это возможно, если отвечающие этим величинам операторы
нек-рой наблюдаемой величины А с собств. значением а, то в этом состоянии измерение величины А будет приводить к одному и тому же значению а. Измерение др. физ. величин F(k) будет также приводить к определенным значениям f(k)только в том случае, если эти величины имеют в рассматриваемом состоянии определенные значения. Это возможно, если отвечающие этим величинам операторы 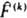 коммутируют с оператором
коммутируют с оператором 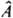 , т. е. если выполняется соотношение:
, т. е. если выполняется соотношение: 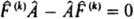 . Если же нек-рый оператор
. Если же нек-рый оператор 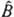 не коммутирует с А, так что
не коммутирует с А, так что 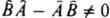 , то не может существовать состояний системы, для к-рых А и В имеют одновременно определенные значения. В частности, не существует состояний, в к-рых координата и импульс частицы имели бы определенные значения, т. к. имеют место соотношения:
, то не может существовать состояний системы, для к-рых А и В имеют одновременно определенные значения. В частности, не существует состояний, в к-рых координата и импульс частицы имели бы определенные значения, т. к. имеют место соотношения:  , где индексы j и k принимают значения 1, 2, 3 и относятся к нумерации переменных:
, где индексы j и k принимают значения 1, 2, 3 и относятся к нумерации переменных: 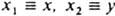 и
и 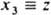 . Из приведенных коммутационных соотношений для координат и импульсов следует, что в любом состоянии произведение среднеквадратичных разбросов координат Dr2 и импульсов Dp2для каждой из частиц удовлетворяет соотношению:
. Из приведенных коммутационных соотношений для координат и импульсов следует, что в любом состоянии произведение среднеквадратичных разбросов координат Dr2 и импульсов Dp2для каждой из частиц удовлетворяет соотношению: 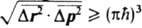 . Это неравенство наз. соотношениемнеопределенностей для координат и импульсов. Следует подчеркнуть, что в К. м. подобного типа соотношение справедливо также для энергии системы и времени:
. Это неравенство наз. соотношениемнеопределенностей для координат и импульсов. Следует подчеркнуть, что в К. м. подобного типа соотношение справедливо также для энергии системы и времени:  , где DE - разброс в измеряемых значениях энергии, обусловленный взаимод. между измерит, прибором и исследуемой системой, Dt - длительность процесса измерения. Это же соотношение может иметь и др. смысл: в качестве D Е может выступать неопределенность значения энергии нестационарного состояния замкнутой системы, тогда Dt будет тем характерным для данного состояния временем, за к-рое существенно меняются средние значения физ. величин. Соотношения неопределенностей для координат и импульсов, для энергии и времени имеют важное значение для понимания осн. положений К. м. и их интерпретации. Поэтому эти соотношения часто наз. принципом неопределенности. Совокупность волновых ф-ций в заданном представлении (конфигурационном или импульсном), описывающих стационарные квантовые состояния системы из N частиц, наз. полной, если любая др. волновая ф-ция этой системы м. б. представлена в виде линейной комбинации или ряда, состоящего из таких ф-ций. Волновые ф-ции полной системы являются совместными собств. ф-циями 3N (без учета спина) или 4N(при учете спина) эрмитовых операторов, к-рые коммутируют между собой. Один из этих операторов - гамильтониан. Если одному и тому же уровню энергии системы отвечает неск. состояний, различающихся собств. значениями др. операторов, то такие уровни наз. вырожденными (см. Вырождение энергетических уровней). Собств. значения ряда операторов либо пропорциональны целым числам, либо выражаются через целые числа. Такие числа наз. квантовыми числами; они часто служат для идентификации состояний квантовомеханич. системы. В ряде случаев набор квантовых чисел позволяет полностью задать состояние системы. Напр., для указания состояния атома водорода достаточно четырех квантовых чисел: главное квантовое число n=1,2,... определяет спектр возможных энергий Еп =- R/n2, где R - постоянная Ридберга, равная 13,6 эВ (109737 см-1); азимутальное (или орбитальное) квантовое число l =0,1,..., n—1 (при заданном п)определяет квадрат орбитального (углового) момента
, где DE - разброс в измеряемых значениях энергии, обусловленный взаимод. между измерит, прибором и исследуемой системой, Dt - длительность процесса измерения. Это же соотношение может иметь и др. смысл: в качестве D Е может выступать неопределенность значения энергии нестационарного состояния замкнутой системы, тогда Dt будет тем характерным для данного состояния временем, за к-рое существенно меняются средние значения физ. величин. Соотношения неопределенностей для координат и импульсов, для энергии и времени имеют важное значение для понимания осн. положений К. м. и их интерпретации. Поэтому эти соотношения часто наз. принципом неопределенности. Совокупность волновых ф-ций в заданном представлении (конфигурационном или импульсном), описывающих стационарные квантовые состояния системы из N частиц, наз. полной, если любая др. волновая ф-ция этой системы м. б. представлена в виде линейной комбинации или ряда, состоящего из таких ф-ций. Волновые ф-ции полной системы являются совместными собств. ф-циями 3N (без учета спина) или 4N(при учете спина) эрмитовых операторов, к-рые коммутируют между собой. Один из этих операторов - гамильтониан. Если одному и тому же уровню энергии системы отвечает неск. состояний, различающихся собств. значениями др. операторов, то такие уровни наз. вырожденными (см. Вырождение энергетических уровней). Собств. значения ряда операторов либо пропорциональны целым числам, либо выражаются через целые числа. Такие числа наз. квантовыми числами; они часто служат для идентификации состояний квантовомеханич. системы. В ряде случаев набор квантовых чисел позволяет полностью задать состояние системы. Напр., для указания состояния атома водорода достаточно четырех квантовых чисел: главное квантовое число n=1,2,... определяет спектр возможных энергий Еп =- R/n2, где R - постоянная Ридберга, равная 13,6 эВ (109737 см-1); азимутальное (или орбитальное) квантовое число l =0,1,..., n—1 (при заданном п)определяет квадрат орбитального (углового) момента  ; магн. квантовое число т=-l, - l (-)+1,..., l определяет проекцию
; магн. квантовое число т=-l, - l (-)+1,..., l определяет проекцию 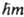 орбитального момента на заданную ось; спиновое квантовое число s (- 1/2 или -1/2)определяет проекцию спина (
орбитального момента на заданную ось; спиновое квантовое число s (- 1/2 или -1/2)определяет проекцию спина ( или -
или -  ) на ту же ось. При описании молекул также используются квантовые числа, задающие, напр., состояния отдельных электронов (см. Орбиталь),возможные значения спина, орбитального и полного моментов, а также колебат. квантовые числа, характеризующие колебат. составляющую полной энергии, и вращат. квантовые числа, характеризующие вращат. составляющую полной энергии молекулы. Точное решение ур-ния Шрёдингера [Шредингера] удается найти лишь в редких случаях. Поэтому важное значение имеют разл. приближенные методы. Если при рассматриваемом движении импульсы частиц достаточно велики, а потенц. энергия их взаимод. изменяется медленно, то применимо квазиклассич. приближение. Оно позволяет, напр., рассчитывать вероятность прохождения частиц и квантовых систем через области пространства, к-рые недоступны для них согласно классич. механике вследствие недостатка энергии (см. Туннельный эффект).Иногда приближенные волновые ф-ции к.-л. состояния м.б. найдены в виде суперпозиции волновых ф-ций близкой, но более простой системы с коэффициентами, подбираемыми из условия минимума энергии системы (см. Вариационный метод).Если взаимод. в системе частиц записывается в виде суммы неск. частей, с одной из к-рых точное решение ур-ния Шрёдингера [Шредингера] возможно, а остальные могут рассматриваться как малые возмущения первой, применяют возмущений теорию. Специфич. задачей К. м. является рассмотрение нестационарных волновых ф-ций, соответствующих переходам системы частиц из одного стационарного состояния в другое под влиянием нек-рого возмущения, зависящего от времени.
) на ту же ось. При описании молекул также используются квантовые числа, задающие, напр., состояния отдельных электронов (см. Орбиталь),возможные значения спина, орбитального и полного моментов, а также колебат. квантовые числа, характеризующие колебат. составляющую полной энергии, и вращат. квантовые числа, характеризующие вращат. составляющую полной энергии молекулы. Точное решение ур-ния Шрёдингера [Шредингера] удается найти лишь в редких случаях. Поэтому важное значение имеют разл. приближенные методы. Если при рассматриваемом движении импульсы частиц достаточно велики, а потенц. энергия их взаимод. изменяется медленно, то применимо квазиклассич. приближение. Оно позволяет, напр., рассчитывать вероятность прохождения частиц и квантовых систем через области пространства, к-рые недоступны для них согласно классич. механике вследствие недостатка энергии (см. Туннельный эффект).Иногда приближенные волновые ф-ции к.-л. состояния м.б. найдены в виде суперпозиции волновых ф-ций близкой, но более простой системы с коэффициентами, подбираемыми из условия минимума энергии системы (см. Вариационный метод).Если взаимод. в системе частиц записывается в виде суммы неск. частей, с одной из к-рых точное решение ур-ния Шрёдингера [Шредингера] возможно, а остальные могут рассматриваться как малые возмущения первой, применяют возмущений теорию. Специфич. задачей К. м. является рассмотрение нестационарных волновых ф-ций, соответствующих переходам системы частиц из одного стационарного состояния в другое под влиянием нек-рого возмущения, зависящего от времени.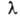 = c/v (с - скорость света), волновым числом
= c/v (с - скорость света), волновым числом 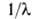 = v/c и энергией фотона hv. Частоты спектральных линий выражают в с -1, длины волн - в нм и мкм, а также в А, волновые числа - в см -1, энергии фотонов - в эВ. Типичные атомные спектры наблюдаются в видимой, УФ- и ближней ИК-областях спектра. Спектры испускания, или эмиссионные, получают при возбуждении атомов различными способами (фотонами, электронным ударом и т.д.), спектры поглощения, или абсорбционные, - при прохождении электромагнитного излучения, обладающего непрерывным спектром, через атомарные газы или пары. Для наблюдения атомных спектров применяют приборы с фотографической или фотоэлектрической регистрацией.
= v/c и энергией фотона hv. Частоты спектральных линий выражают в с -1, длины волн - в нм и мкм, а также в А, волновые числа - в см -1, энергии фотонов - в эВ. Типичные атомные спектры наблюдаются в видимой, УФ- и ближней ИК-областях спектра. Спектры испускания, или эмиссионные, получают при возбуждении атомов различными способами (фотонами, электронным ударом и т.д.), спектры поглощения, или абсорбционные, - при прохождении электромагнитного излучения, обладающего непрерывным спектром, через атомарные газы или пары. Для наблюдения атомных спектров применяют приборы с фотографической или фотоэлектрической регистрацией.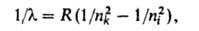
 получается граница серии); R-постоянная Ридберга. Аналогичные серии наблюдаются и в спектрах водородоподобных атомов, однако значения волновых чисел для спектральных линий ионов Не+, Li2+,... в Z2 раз (Z - пoрядковый номер элемента) больше, чем для соответствующих линий атома Н.
получается граница серии); R-постоянная Ридберга. Аналогичные серии наблюдаются и в спектрах водородоподобных атомов, однако значения волновых чисел для спектральных линий ионов Не+, Li2+,... в Z2 раз (Z - пoрядковый номер элемента) больше, чем для соответствующих линий атома Н.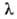 = 589,0 нм и
= 589,0 нм и 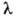 = 589,6 нм); это - наиболее яркая линия, с которой начинается так называемая, главная серия Na. Линии этой серии в спектре испускания соответствуют переходам из состояний Зр, 4р, 5р>... в состояние 3s.
= 589,6 нм); это - наиболее яркая линия, с которой начинается так называемая, главная серия Na. Линии этой серии в спектре испускания соответствуют переходам из состояний Зр, 4р, 5р>... в состояние 3s.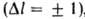 , т. е. s-уровни (l = 0) комбинируют с р-уровнями (l=1), р-уровни - с d-уровнями (l = 2) и т.д. Количественная характеристика разрешенного оптического квантового перехода - его вероятность, определяющая интенсивность спектральной линии, соответствующей этому переходу. Вероятности переходов в простейших случаях могут быть рассчитаны методами квантовой механики.
, т. е. s-уровни (l = 0) комбинируют с р-уровнями (l=1), р-уровни - с d-уровнями (l = 2) и т.д. Количественная характеристика разрешенного оптического квантового перехода - его вероятность, определяющая интенсивность спектральной линии, соответствующей этому переходу. Вероятности переходов в простейших случаях могут быть рассчитаны методами квантовой механики.


