
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Абсолютная и относительная погрешности.Содержание книги
Поиск на нашем сайте Абсолютная и относительная погрешности. Абсолютная погрешность – отклонение результата измерения от истинного значения измеряемой величины: ΔXͥi=Xi-µ, где Xi – измеряемая величина, µ - истинное значение измеряемой или анализируемой величины. В большинстве случаев µ неисвестно, и абсолютная погрешность не может быть точно определена, поэтому часто определяют верхнюю границу ΔXͥi. Предельная абсолютная погрешность ΔX приближенно ΔXͥi является наименьшим числом: ΔX≥l ΔXͥil, тогда интервал, в котором заключено точное значение числа µ будет находится в этих пределах: Х- ΔX≤µ≤ Х+ΔX, где Х – измеряемая величина. Абсолютные погрешности не полностью характеризуют отклонение величины от истинного значения. ΔX=1, но в первом случае µ1=10, а во втором µ2=1000. Поэтому используют понятие относительной погрешности (ошибки), кот представ собой отношение абсолют погрешности к истинному значению измеряемой величины: Ɛ= ΔX/µ. Обычно относительная погрешность измер в %: Ɛ= ΔX/µ*100%.
Классификация погрешностей по форме представления: - абсолютная - отклонение результата измерения от истинного назначения измеряемой величины. ∆Xi=Xi-µ - относительная - отношение абсолютной погрешности к истинному значению. E=∆X/µ - приведённая - погрешность, выраженная отношением абсолютной погрешности средства измерений к условно принятому значению величины, постоянному во всем диапазоне измерений или в части диапазона. E =∆X/ µn, где µn - нормирующее значение, которое зависит от типа шкалы измерительного прибора и определяется по его градуировке. Погрешности измерений и анализа по характеру проявлений условно подразделяют на 3 группы: 1. Систематические 2. Случайные 3. Грубые Систематические – погрешности, которая при повторных измерениях остается постоянной или закономерно изменяется. К ним можно отнести приборные погрешности, обусловленные несовершенством конструкции прибора. Знак данной погрешности от опыта к опыту не меняется, т.е. такая погрешность или только занижает, или только завышает результат. Источником сист погрешности может быть использование некалиброванных приборов. Систематические погрешности по причине возникновения делятся на инструментальные, методические, оперативные и личностные погрешности и погрешности предубеждения. Инструментальные: источник погрешности – некалиброванные приборы и непроверенные реактивы. Методические: погрешности метода зависят от св-в анализируемой системы. Методические погрешности дают расчетные формулы, кот использ для вычисления величин на основании замеренных данных. Такие погрешности часто остаются не обнаружены. Оперативные и личностные погрешности: они связаны с операциями, выполняемыми в ходе анализа и зависят от квалификации исследователя и его способностей. Погрешности предубеждения: они заключаются в том, что при повторных определениях исследователь из 2-ух равновероятных показателей прибора при отсчете на глаз выбирает то значение, кот находится ближе к предыдущему результату. Случайная погрешность – погрешность, кот при повторном измерении изменяется случайным образом. Они обнаруживаются в нерегулярных расхождениях результатов измерений, обычно в последних двух-трех цифрах. Знак такой погрешности может меняться от опыта к опыту. Грубые ошибки – погрешности, которые существенно превышают ожидаемые погрешности при данных условиях исследования. Такие грубые ошибки часто бывают следствием грубых оперативных погрешностей аналитика. Они также возникают при использ неисправной измерительной аппаратуры, несоблюдения условий измерения. Результаты измерений, содержащих промах, выявляются и во внимание не принимаются.
Способы выявления систематической погрешности Выполнение анализа независимыми методами. Анализ проводят двумя или несколькими различными независимыми методами. Если результаты одинаковы, то м.б.уверенным, что анализ выполнен правильно, а в дальнейшем с достаточной точностью. Проведение холостого опыта или анализа. Ведут некоторые параллельные определения. К некоторым пробам прибавляют точно известное количество определяемого элемента. При правильном анализе количество элементов, найденного в пробах, должно соответствовать количеству добавлений. Этот метод даёт некоторую уверенность правильности анализа, а значит и возможности погрешности. Метод стандартных образцов Стандартный образец – различный материал, содержание определяемых элементов в котором известно с высокой точностью. Каждый станд.образец снабжается определённым документом (паспортом). Чтобы установить правильность анализа какого-либо материала из имеющего набора стандартных образцов, выбирают тот, который по-своему составу наиболее близок к пробе. Случайные погрешности Случайной погрешностью измерения называется составляющая погрешности измерения, изменяющаяся случайным образом (по знаку и значению) при повторных измерениях одной и той же величины. Наличие случайных погрешностей выявляется при проведении ряда измерений постоянной физической величины, когда оказывается, что результаты измерений не совпадают друг с другом. Причины случайных погрешностей многообразны: шумы измерительного прибора, вариация его показаний, случайные колебания параметров электрической сети и условий измерений, погрешности округления отсчетов и многие другие. Название случайной погрешности указывает на отсутствие известной причины, закономерностей и появлений. Мы можем лишь только предполагать о наличии причины. Мероприятия направленные на устранение этих эффектов и явлений во многих случаях позволяют уменьшить случ.погрешность, но не устранить полностью. Появление случайной погрешности рассматривается как внезапность, поэтому эти погрешности подвергаются обработке.
4. Генеральная и выборочная совокупность Генеральная совокупность состоит из всех объектов, которые подлежат изучению. Состав генеральной совокупности зависит от целей исследования. Все обобщающие показатели данной совокупности называются генеральными. Генеральная совокупность – совокупность всех наблюдений и изменений при данных условиях. Выборочная совокупность — это совокупность отобранных единиц, т.е.совокупность практических наблюдений. Все ее обобщающие показатели получили название выборочных. В основе этого наблюдения лежит идея о том, что отобранная в случайном порядке некоторая часть единиц может представлять всю изучаемую совокупность явления по интересующим признакам. Целью выборочного наблюдения является получение информации для определения сводных обобщающих характеристик всей изучаемой совокупности. Характеристиками генеральной и выборочной совокупностей могут служить средние значения признаков, их дисперсия, среднеквадратическое отклонение, мода, медиана, характеристики альтернативного признака.
Нормальное распределение Свойство большого числа малых случайных погрешностей описываются нормальным распределением (уравнением Гаусса). Говорят, что случайная величина
где a - любое действительное число, а Физическая величина, подверженная влиянию значительного числа независимых факторов, способных вносить с равной погрешностью положительные и отрицательные отклонения, вне зависимости от природы этих случайных факторов, часто подчиняется нормальному распределению, поэтому из всех распределений в природе чаще всего встречается нормальное (отсюда и произошло одно из названий этого распределения вероятностей).
Свойства: 1вероятность попадания СВ Х в интервал от (-∞;+)=1, следует, что площадь ограничена прямой и осью Х=1. 2.если через 2 значения Х:Х1 и Х2 провести вертикали до пересечения с прямой, то площадь, ограниченная Х1 и Х2 и кривой называется доверительной вероятностью.
Распределение Стьюдента t-распределение Стьюдента - это непрерывное одномерное распределение с одним параметром - количеством степеней свободы. Распределение Стьюдента по сути представляет собой сумму нескольких нормально распределенных случайных величин. Чем больше величин, тем больше верятность, что их сумма будет иметь нормальное распределение. (t-распределение) Таким образом, количество суммруемых величин определяет важнейший параметр формы данного распредения - число степеней свободы. Распределение Стьюдента сходится к стандартному нормальному при
Согласно данному распределению погрешность среднеарифметическая или относительное стандартное отклонение рассчитывается: S=t p,f*Sx/корень n, где t p,f – коэф.стьюдента, который зависит от f и p, p-доверительная вероятность. Sx/корень n – стандартное отклонение среднего значения. Коэф.находят в специальных статистических таблицах. Из этих таблиц можно увидеть, что наиболее эффективно сужение доверит интервала наблюдается при увеличении числа значений n до 4-5. Если задана доверит.вер-ть р, то доверит.интервал можно легко определить и тогда искомая величина будет записана <x>±S. Обычно доверит.интервал анализа вычисляют при доверит.вер-ти p=0,95.
Требование к пробе анализа. Генеральная, средняя, лабораторная и анализируемая проба Все вещества, которые поступают на предприятия для их дальнейшей переработки образуют генеральную или первичную совокупность. Поскольку поступает очень большое количество, то проводят отбор небольшой части этих веществ, т.е.отбор проб. В этом случае проба является частью всей генеральной сов-ти.Основное требование к пробе материала, поступающей в лабораторию - ее представительность, т.е.состав и свойства пробы и всей генеральной сов-ти должны бать близкими. Требование к пробам, находящимся в стадии анализа, – не допустить загрязнения в процессе пробоподготовки. В процессе отбора и хранения пробы возможны потери определяемых компонентов (особенно летучих компонентов), внесение загрязнений, изменения химического состава. Поэтому следует строго регламентировать методику пробоотбора: число и последовательность операций измельчения и просеивания, температурный режим, время растирания и контакта с атмосферой, материал пробоотборников и измельчающих устройств, способы очистки и т.д. Пробы, поступающие в лабораторию, осматривают, вскрывают упаковку и регистрируют в журнале в соответствии с сопроводительной документацией, удостоверяющей объект. Првичную или генеральную пробу отбирают на первом этапе от большой массы материала, лабораторную или паспортную пробу получают после уменьшения массы генеральной пробы до массы, необходимой для проведения всего анализа полностью, аналитическую пробу отбирают от лабораторной для проведения единичного определения. Средней пробой называют относительно небольшое количество исследуемого материала, которое по своему составу, физическим и физико-химическим свойствам соответствует всей партии.Перед отбором генеральной пробы необходимо определить ее представительность, а при получении лабораторной, кроме того, рассчитать массу пробы, позволяющую провести весь анализ. Метод разложения проб Под минерализацией в химическом анализе понимается разложение органических веществ и материалов на их основе с целью выделения определяемых элементов в виде устойчивых неорганических соединений, удобных для последующего анализа. Среди обычных методов разрушения органических компонент следует выделить способ сухой минерализации, способ мокрой минерализации, способ кислотной экстракции. Способ сухой минерализации основан на полном разложении органических веществ путём сжигания пробы сырья или продуктов в электропечи при контролируемом температурном режиме и предназначен для всех видов сырья и продовольственных продуктов, кроме животных, растительных жиров и масел. Способ мокрой минерализации основан на полном разложении органических вещ-в пробы продукта при нагревании с серной и азотной концентрированными кислотами с добавлением хлорной кислоты или перекиси водорода и предназнач.для всех видов сырья и продуктов, кроме сливочного масла и животных жиров. Способ кислотной экстракции основан на экстракции токсичных элементов из пробы продукта кипячением с разбавлением соляной или азотной кислотами и предназначен для растительных и сливочных масел, маргарина, пищевых жиров и сыров. Растворение проб. Для раствор-я тв тел их обрабатывают мин. кислотами при нагревании или без него. Нередко исп-т смесь кислот (серной, азотной, соляной и др). Часто в к-ты добавляют окислители (пероксид водорода, бром и др). Подбор растворителя упрощается, если основные компоненты пробы известны из предварительных данных. Например, при определении сурьмы, мышьяка, германия избегают обработки исходной пробы соляной кислотой и стремятся не нагревать солянокислые растворы. Если же нельзя обойтись без нагревания, то анализ проводят с помощью обратного холодильника, чтобы не допустить потерь в-ва за счет его улетучивания в хлоридах. Растворение производят в хим стаканах и конических колбах. Если при этом образуется пена или возможно разбрызгивание, то примен-ся установки, обеспечивающие улавливание пены или капель р-ра. Нередко используют колбы или тигли с затворами, кот позволяют выпускать образовавшиеся газы и защищают реакционную смесь от контакта с воздухом. Если растворение протекает при t выше t кипения растворителя, то применяются запаянные ампулы или автоклавы. Сплавление пробы. При разложении некот материалов, например силикатных изделий, разл горных пород и др для полного растворения пробы одной обработки растворителя бывает недостаточно. В этих случаях для вскрытия пробы применяют ее сплавление с различными в-вами, котор. нызыв. плавнями. Например, щелочные плавни, т.к.карбонаты, пероксиды, а так же применяют кислотные плавни, т.к. гидросульфаты. При сплавлении происходит разложение анализируемого в-ва, нередко сопровождающееся окислением компонентов пробы кислородом воздуха. Чтобы усилить окислительные действия плава в него вводят нитраты, хлораты и др. окисл-ли. В этом случае протекает процесс спекания. Для усиления вводят нитраты, хлориды и др окислители. Получаемый после спекания/сплавления продукт растворяется в воде или в разбавл-х мин кислотах.
Пиролиз пробы. При анализе орган-х материалов, а также для устранения орган-ских примесей из неорган-х проб применяется процесс пиролиза, в кот под действием высокой t происходит расщепление большинства молекул с образованием продуктов малой молек массы. По конечным или промежуточным процессам пиролиза устанавливают хар-ки исходных соединений. Пиролиз осущ-ся вспец печах с отводом продуктов расщепления при помощи потока инертного газа. Сущность титриметрии Титриметрический анализ основан на точном измерении объёма стандартного раствора реагента, израсходованного на реакцию с определяемым веществом. Расчёт результата титриметрии основан на принципе эквивалентности, в соответствии с которым вещества реагируют между собой в эквивалентных количествах. Его основными достоинствами являются точность, быстрота исполнения и возможность применения для определения самых разнообразных веществ. Определение содержания вещества в титриметрическом анализе осуществляется в результате проведения реакции точно известного количества одного вещества с неизвестным количеством другого, с последующим расчётом количества определяемого вещества по уравнению реакции. Основной операцией титриметрического анализа является титрование – постепенное смешивание веществ до полного окончания реакции. Обычно в титриметрическом анализе используются растворы веществ. В ходе титрования раствор одного вещества постепенно приливается к раствору другого вещества до тех пор, пока вещества полностью не прореагируют. Раствор, который приливают, называется титрантом, раствор, к которому приливается титрант, называется титруемым раствором. Объём титруемого раствора, который подвергается титрованию, называется аликвотной частью или аликвотным объёмом. Точка эквивалентности Точка эквивалентности (в титриметрическом анализе) — момент титрования, когда число эквивалентов добавляемого титранта эквивалентно или равно числу эквивалентов определяемого вещества в образце. Точкой эквивалентности называется момент, наступающий в ходе титрования, когда реагирующие вещества полностью прореагировали. В этот момент они находятся в эквивалентных количествах, т.е. достаточных для полного, без остатка, протекания реакции.
Точка конца титрования Кривые титрования Способы титрования Гальванический элемент 28. Общие принципы электрохимических методов анализа. Классификация электродов и электродных систем. Данные методы анализа связаны с направленным движением заряженных частиц, т. е. с электрическим током, возникающим при действии ЭДС или разности потенциалов. В электрохимических процессах электрический ток протекает в проводниках второго рода – электролитах, т. е. в растворах веществ. Заряженными частицами в электролитах явл-ся положительные и отрицательные ионы, образующиеся при электролитической диссоциации полярных молекул диссоциированного вещ-ва (различных солей, кислот, оснований) полярными молекулами р-ля (воды) или другими физико-химическими механизмами.
В электрохимических устройствах имеется как min 2 электрода, причем на одном из них постоянно или в данный момент времени возникает или подается положительный потенциал, а на втором электроде – отрицательный. При этом положительные ионы электролита будут двигаться к отриц электроду, а отрицательные – к положит. Возникает ток в электролите.
И только возле самих электродов возможна отдача отрицательными ионами электронов плюсовому электроду, а плюсовые ионы могут забрать электроны у отрицательного электрода. Электроды и электродные системы классифицируются: - по агрегатному состоянию: твердые (металлические), жидкие (ртуть), газообразные (водород) - кинематическому исполнению: неподвижные, подвижные (совершают поступательное и вращат движение) - по контакту с электролитом: контактирующие, безконтактные - по способу взаимодействия с электролитами: пассивные, активные (могут растворяться в электролитах) - твердые электроды: металлические (золото), неметалич (графит) - электродные системы: с наложением тока из вне (с электродам подается внешняя ЭДС), без наложения тока из вне.
Метод прямой кондуктометрии Ионоселективные электроды Прямая кулонометрия При прямой кулонометрии, определяют в-во окислившееся либо восстановившееся на одном из электродов, при этом побочные хим р-ции не протекают. Этот метод прямой кулонометрии примен для опред многих орг в-в, при этом различают на практике кулонометрию при постоян потенциале и при постоян силе тока. Кулонометрия при пост потенц (прям кулонометрия): В этом случае при пост потенциале эл-за сила тока пост изменяется, т.к. конц определяемого в-ва непрерывно падает. Сила тока измен-ся по экспоненте в зависимости от времени эл-за, если построить графич зависимость в корд (ln I от t), то зависимость – прямая линия. Ln I=kt: k=tg α. Схема прямой кулонометрии при пост потенц. 1 – источ питания, 2 – реастат, 3 – амперметр, 4- раб эл-д, 5 – эл-д, 6 – стандарт эл-д, 7 – потенциом электролизер. Кулонометрия при пост силе тока (хронометр. М-д): При этом м-де сила тока постоянная величина, а продолжительность электролиза t опред секундомером, затем рассчит Q: Q=I*t. Постоянную силу тока поддерживают включая последовательно с электролитической ячейкой высокополное сопротивление порядка 1*104 – 2.5*10 4. Наряжение поддерживается 100-200 В. Напряжение на ячейках обычно повышается при электролизе вследствие изменения концентрации ионов водорода в растворе. Схема: 1 – источ пит, 2 – ключ, 3 – реастат, 4 – амперметр, 5 – яч для эл-за.
Методы полярографии Методы полярографии. 1.Метод градуировочного графика. При этом методе снимают несколько полярограмм стандартных образцов, по высоте Н и концентрации С строят градуировочный график, чаще всего это прямая проходящая от начала координат: Н = f(C). По высоте волны Н неизвестного образца определяют его концентрацию про градуировочному графику. 2. Метод стандарта. В это методе присутствуют строго определенные условия, в которых снимают полярограммы стандартного и анализируемого раствора. Концентрацию неизвестного раствора находят по следующей формуле: Сх=Сст* (Нх/Нст), где Нх,ст – высота волны, искомого раствора и стандартного. Сст – концентрация стандартного растворо. 3. Метод добавок. В этом методе учитывают линейный характер зависимости Iх = к*Сх. Если в раствор добавить известное количество стандартного раствора то сила тока изменяется и станет равной в соответствии с этой зависимостью Iх+ст = к(Сх+Сст). Сх определяют, поскольку Сст известно, а Iх. Абсолютная и относительная погрешности. Абсолютная погрешность – отклонение результата измерения от истинного значения измеряемой величины: ΔXͥi=Xi-µ, где Xi – измеряемая величина, µ - истинное значение измеряемой или анализируемой величины. В большинстве случаев µ неисвестно, и абсолютная погрешность не может быть точно определена, поэтому часто определяют верхнюю границу ΔXͥi. Предельная абсолютная погрешность ΔX приближенно ΔXͥi является наименьшим числом: ΔX≥l ΔXͥil, тогда интервал, в котором заключено точное значение числа µ будет находится в этих пределах: Х- ΔX≤µ≤ Х+ΔX, где Х – измеряемая величина. Абсолютные погрешности не полностью характеризуют отклонение величины от истинного значения. ΔX=1, но в первом случае µ1=10, а во втором µ2=1000. Поэтому используют понятие относительной погрешности (ошибки), кот представ собой отношение абсолют погрешности к истинному значению измеряемой величины: Ɛ= ΔX/µ. Обычно относительная погрешность измер в %: Ɛ= ΔX/µ*100%.
Классификация погрешностей по форме представления: - абсолютная - отклонение результата измерения от истинного назначения измеряемой величины. ∆Xi=Xi-µ - относительная - отношение абсолютной погрешности к истинному значению. E=∆X/µ - приведённая - погрешность, выраженная отношением абсолютной погрешности средства измерений к условно принятому значению величины, постоянному во всем диапазоне измерений или в части диапазона. E =∆X/ µn, где µn - нормирующее значение, которое зависит от типа шкалы измерительного прибора и определяется по его градуировке. Погрешности измерений и анализа по характеру проявлений условно подразделяют на 3 группы: 1. Систематические 2. Случайные 3. Грубые Систематические – погрешности, которая при повторных измерениях остается постоянной или закономерно изменяется. К ним можно отнести приборные погрешности, обусловленные несовершенством конструкции прибора. Знак данной погрешности от опыта к опыту не меняется, т.е. такая погрешность или только занижает, или только завышает результат. Источником сист погрешности может быть использование некалиброванных приборов. Систематические погрешности по причине возникновения делятся на инструментальные, методические, оперативные и личностные погрешности и погрешности предубеждения. Инструментальные: источник погрешности – некалиброванные приборы и непроверенные реактивы. Методические: погрешности метода зависят от св-в анализируемой системы. Методические погрешности дают расчетные формулы, кот использ для вычисления величин на основании замеренных данных. Такие погрешности часто остаются не обнаружены. Оперативные и личностные погрешности: они связаны с операциями, выполняемыми в ходе анализа и зависят от квалификации исследователя и его способностей. Погрешности предубеждения: они заключаются в том, что при повторных определениях исследователь из 2-ух равновероятных показателей прибора при отсчете на глаз выбирает то значение, кот находится ближе к предыдущему результату. Случайная погрешность – погрешность, кот при повторном измерении изменяется случайным образом. Они обнаруживаются в нерегулярных расхождениях результатов измерений, обычно в последних двух-трех цифрах. Знак такой погрешности может меняться от опыта к опыту. Грубые ошибки – погрешности, которые существенно превышают ожидаемые погрешности при данных условиях исследования. Такие грубые ошибки часто бывают следствием грубых оперативных погрешностей аналитика. Они также возникают при использ неисправной измерительной аппаратуры, несоблюдения условий измерения. Результаты измерений, содержащих промах, выявляются и во внимание не принимаются.
|
|||
|
Последнее изменение этой страницы: 2016-07-11; просмотров: 335; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.102 (0.011 с.) |

 нормально распределена или подчиняется закону распределения Гаусса, если ее плотность распределения
нормально распределена или подчиняется закону распределения Гаусса, если ее плотность распределения  имеет вид
имеет вид
 >0.
>0.
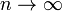 .
. Плотность распределения Стьюдента по сравнению с плотностью стандартного нормального распределения.
Плотность распределения Стьюдента по сравнению с плотностью стандартного нормального распределения.




