
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Проверьте себя (экспресс – тест)Содержание книги Поиск на нашем сайте
1. Белки – биополимеры, мономерами которых являются: а) карбоновые кислоты; б) амины; в) β-аминокислоты; г) α-аминокислоты; д) амиды карбоновых кислот.
2. В белках аминокислотные остатки связаны между собой: а) сложноэфирными связями; б) водородными связями; в) пептидными связями; г) ангидридными связями; д) гликозидными связями.
3. К основным аминокислотам относят: а) аланин б) лизин в) тирозин г) глутамин д) триптофан
4. В изоэлектрической точке пептиды имеют: а) отрицательный заряд б) положительный заряд в) нулевой заряд
5. Заряд дипептида лизилпролина в кислой среде равен: а) 0; б) 2+; в) 1+; г) 2-; д) 1-.
6. Какое определение неправильно характеризует белки? а) это высокомолекулярные пептиды; б) это бифункциональные полимеры; в) это ферменты; г) это полипептиды, образованные остатками α-аминокислот.
7. Первичная структура – это… а) последовательность аминокислот в белке; б) аминокислотный состав белка; в) молекулярная формула белка; г) строение α-спирали белка.
8. Какое взаимодействие не влияет на формирование третичной структуры? а) водородные связи между функциональными группами; б) гидрофобное взаимодействие между углеводородными радикалами; в) дисульфидная связь между цистеиновыми остатками; г) пептидная связь.
9. Денатурация белков приводит к разрушению ….. а) пептидных связей; б) первичной структуры; в) водородных связей; г) вторичной и третичной структуры.
10. Укажите общую качественную реакцию на белки и пептиды: а) ксантопротеиновая реакция; б) биуретовая реакция; в) реакция Льюиса; г) реакция Миллона.
11. Какое из перечисленных веществ не относится к белкам? а) гемоглобин; б) инсулин; в) пенициллин; г) рибонуклеаза.
12. Укажите, важнейшую на ваш взгляд, биологическую функцию белков? а) катализ биохимических процессов; б) транспорт белков; в) регуляция иммунной системы живых организмов; г) обеспечение строительного материала для тканей.
Раздел 2. Углеводы Углеводы (сахара) наряду с белками являются одной из наиболее важных и распространенных групп природных органических соединений. Они составляют до 80% массы сухого вещества растений и около 2% сухого вещества животных организмов (в печени 5-10%; скелетные мышцы 1-3%; сердечная мышца – 0,5%; головной мозг – 0,2%). Важными природными источниками углеводов являются гликозиды – они широко распространены в природе и представляют собой соединения углеводов с другими классами соединений (фенолами, спиртами и др.) Животные организмы не способны синтезировать сахара и получают их с различными пищевыми продуктами растительного происхождения. В растениях углеводы образуются из оксида углерода (IV) и воды в процессе фотосинтеза, осуществляемого за счет солнечной энергии с участием зеленого пигмента растений – хлорофилла: hυ
2867 кДж/моль Классификация и строение Углеводы – полигидроксикарбонильные соединения и их производные. Свое название углеводы (гидраты углерода) получили потому, что соотношение водорода и кислорода в молекулах первых известных представителей было 2:1, вследствие чего их рассматривали как соединения углерода с водой:
С6Н12О6 = 6 С * 6 Н2О глюкоза С12Н22О11 = 12 С * 11 Н2О сахароза
По мере развития химии углеводов оказалось, что это представление ошибочно. Так, существуют углеводы (рамноза С6Н12О5, дезоксирибоза С5Н10О4 и др.), в которых соотношение водорода и кислорода иное. Но прежнее название сохранилось. Классификация углеводов основана на их способности к гидролизу и может быть представлена схемой (схема 1).
схема 1
Простые углеводы или моносахариды – углеводы, не подвергающиеся гидролизу с образованием более простых соединений, являются основой олигосахаридов и полисахаридов. Олигосахариды – сложные углеводы, распадающиеся при гидролизе на несколько остатков моносахаридов (как правило, от двух до десяти остатков). Полисахариды – сложные углеводы, распадающиеся при гидролизе на множество остатков моносахаридов (от сотен до тысяч остатков) (схема 1). Моносахариды Моносахариды по химическому составу являются либо полигидроксиальдегидами, либо полигидроксикетонами. Моносахариды, в состав которых входит альдегидная группа (-СОН), называют альдозами, а кетонная (>С = О) – кетозами. Для более быстрого и удобного написания конфигурации моноз Э. Фишер предложил изображать их проекционными формулами. Углеродная цепь изображается вертикальной линией, на концах которой пишут первую и последнюю функциональные группы (альдегидную группу всегда пишут вверху). Поэтому общие формулы альдоз и кетоз выглядят следующим образом:
В названии моноз учитывается не только наличие альдегидной или кето-группы, но и число атомов углерода. Поэтому выделяют:
Наиболее распространены в природе пентозы и гексозы. Выделенные звездочкой атомы углерода являются асимметрическими. Асимметрическим называется атом углерода, соединенный с четырьмя разными заместителями. Вещества, в составе которых есть асимметрические атомы углерода, обладают особым видом пространственной изомерии – стереоизомерией и оптическойизомерией. Стереоизомеры отличаются пространственной конфигурацией атомов водорода и гидроксогруппы при асимметрическом атоме углерода. Число стереоизомеров равно 2n, где n – число асимметрических атомов углерода. Например, альдогексоза общей формулой С6Н12О6 с четырьмя асимметрическими атомами углерода может быть представлена любым из 16 возможных стереоизомеров, восемь из которых относятся к D – ряду, а восемь – к L – ряду. Родоначальниками D- и L-рядов можно условно считать D- и L-глицериновые альдегиды. Принадлежность моносахарида к D- и L-ряду определяется положением водорода и гидроксила у наиболее удаленного от альдегидной или кетонной группы асимметрического углеродного атома:
Наиболее важные моносахариды: Альдозы
Альдозы, отличающиеся друг от друга конфигурацией лишь у асимметрического атома углерода, соседнего с карбонильной группой, называются эпимерами (например, D – глюкоза и D - манноза). Монозы с пятью и более атомами углерода могут осуществлять не только в линейной (цепной), но и в циклической (кольчатой) форме. Циклизация происходит за счет разрыва двойной связи в карбонильной группе, перемещения атома водорода к освободившейся валентности карбонильного кислорода и замыканию кольца углеродных атомов с образованием внутренних циклических α- или β-полуацеталей:
В циклических формах моноз на один асимметрический атом углерода больше, чем в открытых, поэтому у них в два раза большее число оптических изомеров (за счет α- или β-форм). Изомер, в изображении которого полуацетальный гидроксил находится справа от С- цепи, называется α-формой, а слева – β-формой. Структурные формулы в проекции Фишера не способен дать всесторонний геометрический образ полуацетальной структуры, так как они не отражают реальных пространственных углов между химическими связями. В 1929 году Хеуорс предложил рассматривать полуацетальные формы моноз как производные гидрированных гетероциклов пирана и фурана:
Моносахариды, имеющие пятичленное кольцо, как у фурана, называют фуранозами, а имеющие шестичленное кольцо – относят к производным пирана и называют пиранозами. Пяти- и шестичленные циклические структуры изображаются при этом в виде плоских циклических систем, гидроксильные группы у каждого атома углерода ориентированы либо вверх, либо вниз. Для преобразовывания формул D–моноз в проекции Фишера в формулу Хеуорса надо придерживаться следующих правил: 1) Все группы, расположенные справа от углеродной цепи в формулах Фишера, в формулах Хеуорса занимают положение под плоскостью кольца (внизу). 2) Группы, расположенные в формулах Фишера слева от углеродной цепи, располагают над плоскостью кольца (вверху). 3) Атом кислорода всегда располагают в правом верхнем углу. 4) Концевую группу –СН2ОН в проекции Хеуорса направляют вверх.
α-D-глюкоза D-глюкоза β-D-глюкоза
В растворе линейные и циклические формы моносахаридов существуют одновременно и способны самопроизвольно превращаться друг в друга. Такие изомерные формы называют кольчато-цепными таутомерами. Преобладают, как правило, циклические изомеры моносахаридов; они используются организмами для построения олиго- и полисахаридов, мононуклеотидов и других молекул. Через линейную форму происходит переход α-формы в β-форму.
Рентгеноструктурные исследования моносахаридов показали, что пиранозы существуют в виде кресловидной конформации (аналогично конформации «кресло» для циклогексана), причем такой, в которой максимально возможное число объемистых заместителей (четыре) расположено экваториально. Так, α-D-глюкопираноза имеет вид:
Свойства моносахаридов Моносахариды – полифункциональные соединения со смешанными функциями. Их химические свойства определяются наличием в молекуле карбонильной группы, спиртовых гидроксилов и полуацетального гидроксила. Окисление
а) при осторожном окислении альдоз бромной водой образуются одноосновные полиоксикислоты с тем же числом атомов углерода – альдоновые кислоты (глюкоза глюконовая кислота,
б) при более сильном окислении концентрированной азотной кислотой образуются двухосновные оксикислоты – сахарные кислоты (глюкоза глюкосахарная кислота):
Восстановление
  При восстановлении моносахаридов они переходят в многоатомные спирты (D-глюкоза сорбит; D – ксилоза ксилит): При восстановлении моносахаридов они переходят в многоатомные спирты (D-глюкоза сорбит; D – ксилоза ксилит):
Реакция со спиртами Среди реакций, которые обусловлены свойствами моносахаридов как циклических многоатомных спиртов, особую роль играет полуацетальный гидроксил. Так, при нагревании моносахаридов с низшими спиртами в присутствии НСl атом водорода в гликозидном гидроксиле замещается на алкильный радикал с образованием простого эфира – гликозида:
Остальные спиртовые гидроксилы в этих условиях во взаимодействие не вступают. О – гликозиды широко распространены в растительном мире. В большинстве природных гликозидов в качестве сахарной компоненты выступает D – глюкоза и почти все они являются β-глюкозидами. Несахарная компонента называется агликоном и обладает сложным строением. Обычно гликозиды классифицируют по агликоновой компоненте. Важное значение имеют и азотсодержащие, так называемые N – гликозиды, в которых агликон связан с монозой через атом азота (в том числе нуклеозиды). В гликозидах отсутствует полуацетальный гидроксил, поэтому они не способны к таутомерии и не проявляют восстанавливающих свойств.
Брожение моносахаридов Брожение – это расщепление сахаров под влиянием биологических катализаторов – ферментов. Процессы брожения протекают сложными путями – через ряд промежуточных продуктов. Различные микроорганизмы вызывают определенные виды брожения. Например: а) спиртовое брожение
этанол б) маслянокислое брожение
масляная кислота в) молочнокислое брожение
| ОН молочная кислота г) лимоннокислое брожение ОН |
| СООН лимонная кислота
Производные моносахаридов Большую группу производных моносахаридов составляют фосфорные эфиры, которые образуются в ходе превращений углеводов в тканях. Некоторые из них:
В природе широко распространены два аминопроизводных моносахарида: глюкозамин и галактозамин, которые существуют как в линейной, так и в циклической форме. Глюкозамин входит в состав многих полисахаридов, содержащихся в тканях животных и человека; галактозамин является компонентом гликопротеинов и гликолипидов:
В состав полисахаридов входит глюкуроновая кислота. По химической природе аскорбиновая кислота близка к моносахаридам L-ряда и является внутренним циклическим эфиром (лактоном) одной из альдоновых кислот:
Получают синтетически из D-глюкозы. Содержится в соке лимона, черной смородины, плодах шиповника, свежей капусте.
|
||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-06-29; просмотров: 911; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.198.250 (0.007 с.) |

 6 СО2 + 6 Н2О С6Н12О6 + 6 О2 ↑
6 СО2 + 6 Н2О С6Н12О6 + 6 О2 ↑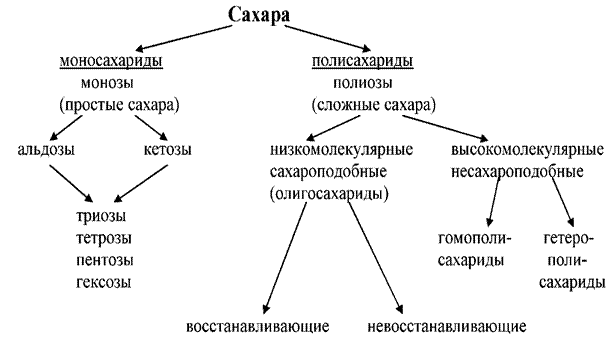


 Стереоизомеры отличаются физико-химическими свойствами и биологической активностью.
Стереоизомеры отличаются физико-химическими свойствами и биологической активностью.










 манноза манноновая кислота и т.д.):
манноза манноновая кислота и т.д.):



 - D- глюкопираноза
- D- глюкопираноза  С6Н12О6 2 С2Н5ОН + 2 СО2 ↑
С6Н12О6 2 С2Н5ОН + 2 СО2 ↑ С6Н12О6 2 СН3 – СН – СООН
С6Н12О6 2 СН3 – СН – СООН С6Н12О6 НООС – СН2 – С – СН2 – СООН + 2Н2О
С6Н12О6 НООС – СН2 – С – СН2 – СООН + 2Н2О





