
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Завдання 1–60 мають чотири варіанти відповідей, З яких лише один правильний. Оберіть, на вашу думку, правильний варіант відповіді.Содержание книги
Поиск на нашем сайте
61. Зазначте, до якого електрода буде рухатися гранула у міцелі {[(Zn(OH)2)m nZn2+ 2(n–x)Cl-]2x+ 2xCl-}: а) не буде рухатись; б) до анода; в) до катода; г) правильної відповіді немає. 62. Виберіть формулу гранули, утвореної при дії надлишку Na3PO4 на MgCl2: а) [(Mg3(PO4)2)mnMg+22(n-x)H+]2x+; б) [(Mg3(PO4)2)mnMg+22(n-x)Cl-]2x+; в) [(Mg3(PO4)2)mnPO43- 3(n-x)Na+]3x-; г) [(Mg3(PO4)2)m 2nPO43-8(n-x)Mg2+]3x-. 63. Виберіть формулу найкращого коагулянта для наведеної гранули[(Au)m n а) Na2SO4; б) NaBr; в) CaBr2; г) AlBr3. 64. Виберіть формулу найкращого коагулянта для наведеної гранули[(Cd(OH)2)m n Cd2+2(n – x)Cl-]2x+: а) CaCl2; б) NaF; в) Al2(SO4)3; г) CoCl2. 65. Зазначте умову, за якої відбувається утворення міцели {[(FeS)m nS-22(n – x)Na+]2xNa+} унаслідок взаємодії розчинів ферум (ІІ) хлориду та натрій сульфіду: а) FeCl2 взято у надлишку; б) Na2S взято у надлишку; в) використано еквімолярні кількості обох речовин; г) правильної відповіді немає. 66. Виберіть формулу гранули, утвореної при дії надлишку MgCl2 на Na3PO4: а) [(Mg3(PO4)2)mnMg+22(n-x)H+]2x+; б) [(Mg3(PO4)2)mnMg+22(n-x)Cl-]2x+; в) [(Mg3(PO4)2)mnPO43- 3(n-x)Na+]3x-; г) [(Mg3(PO4)2)m 2nPO43-8(n-x)Mg2+]3x-. 67. Зазначте умову, за якої відбувається утворення міцели{[(AgI)m nAg+(n – x)NO3-]x NO3-} внаслідок взаємодії розчинів арґентум нітрату та калій йодиду. а) AgNO3 взято у надлишку; б) KI взято у надлишку; в) використано еквімолярні кількості обох речовин; г) правильної відповіді немає. 68. Вкажіть, до якого електрода буде рухатися гранула у міцелі {[(FeS)m nS-22(n – x)Na+]2xNa+}: а) не буде рухатись; б) до анода; в) до катода; г) правильної відповіді немає. 69. Виберіть формулу гранули, утвореної при дії надлишку AgNO3 на KI: а) [(AgI)m nAg+(n – x)I-]; б) [(AgI)m nK+(n – x)NO3-]; в) [(AgI)m nI-(n – x)K+]; г) [(AgI)m nAg+(n – x)NO3-]. 70. Виберіть формулу гранули, утвореної при змішуванні розчинів натрій ортофосфату (надлишок) і алюміній сульфату: а) [(AlPO4)m nSO42-2(n – x)Na+]; б) [(AlPO4)m nPO43-3(n – x)Na+]; в) [(Al2(SO4)3)m nPO42-3(n – x)Na+]; г) [(AlPO4)m 3nNa+(n – x)PO43-]. 71. Зазначте, до якого електрода буде рухатися гранула у міцелі {[(AgF)m n F- (n – x)Na+]x- xNa+}: а) не буде рухатись; б) до анода; в) до катода; г) правильної відповіді немає. 72. Зазначте умову, за якої відбувається утворення міцели{[(Ag2S)m nAg+(n – x)NO3-]x NO3-} унаслідок взаємодії розчинів арґентум нітрату та калій сульфіду: а) AgNO3 взято у надлишку; б) K2S взято у надлишку; в) використано еквімолярні кількості обох речовин; г) правильної відповіді немає. 73. Виберітьформулу найкращогокоагулянта для наведеної гранули[(Fe(OH)3)m nFeO+(n – x)Cl-]x+: а) KCl; б) AlCl3; в) NaF; г) K2SO4. 74. Зазначте умову, за якої відбувається утворення міцелизолю{[(MnS)mnMn+22(n-x)NO3-]2x+ 2xNO3-} унаслідок взаємодії у розчині натрій сульфіду з манган (ІІ) нітратом. а) при еквімолярних значеннях реагуючих речовин; б) правильної відповіді немає; в) манган (ІІ) нітрат взято у надлишку; г) натрій сульфід взято у надлишку. 75. Виберітьформулу найкращогокоагулянта для наведеної гранули[(Co(OH)2)m n Co2+2(n – x)Cl-]2x+: а) NaCI; б) KF; в) Al2(SO4)3; г) CaCl2. 76. Зазначте, до якого електроду буде рухатися гранула у міцелі {[(AgF)m n F- (n – x)Na+]x- xNa+}: а) не буде рухатись; б) до анода; в) до катода; г) правильної відповіді немає. 77. Зазначте, до якого електрода буде рухатися гранула у міцелі {[(Mg3(PO4)2)mnMg+22(n-x)Cl-]2x+2xCl-}: а) не буде рухатись; б) до анода; в) до катода; г) правильної відповіді немає. 78. Зазначте умову, за якої відбувається утворення міцели{[(FeS)m nFe+2 2(n – x)Cl-]2x+ 2xCl-} унаслідок взаємодії у розчині натрій сульфіду з ферум (ІІ) хлоридом: а) FeCl2 взято у надлишку; б) Na2 S взято у надлишку; в) взято еквімолярні кількості речовин; г) правильної відповіді немає. 79. Зазначте умову, за якої відбувається утворення міцели {[(BaSO4)m n а) BaCl2 взято у надлишку; б) K2SO4 взято у надлишку; в) взято еквімолярні кількості речовин; г) правильної відповіді немає. 80. Виберіть формулу міцели золю, одержаного внаслідок реакції, яку відображає така схема: BaCl2(надл)+ AgNO3 →: а) [(AgCl)mnBa2+2(n-x)Cl-]2x+ 2xCl-; б) [(AgCl) mnCl - ½(n-x)Ba2+]x- ½xBa2+; в) [(AgCl)mnAg+2(n-x)Cl-]2xCl-; г) правильної відповіді немає. 81. Виберіть формулу найкращого коагулянта для золю, одержаного внаслідок гідролізу кобальт (ІІ) хлориду: а) KCl; б) NaF; в) CuCl2; г) K2SO4. 82. Виберіть формулу гранули, утвореної при змішуванні розчинів натрій гідроксиду (надлишок) і купрум (ІІ) сульфату: а) [(Cu(OH)2)m nOH-(n – x)Na+]; б) [(Cu(OH)2)m nOH-(n – x)Cu2+]; в) [(CuSO4)m nOH-(n – x)Na+]; г) [(Cu(OH)2)m nCu2+(n – x)SO42-]. 83. Виберіть формулу гранули, утвореної при змішуванні розчинів натрій ортофосфату і алюміній сульфату (надлишок): а) [(AlPO4)m nSO42-2(n – x)Na+]; б) [(AlPO4)m nPO43-3(n – x)Na+]; в) [(Al2(SO4)3)m nPO42-3(n – x)Na+]; г) [(AlPO4)m nAl3+1,5(n – x)SO42-]. 84. Виберітьформулу найкращогокоагулянта для наведеної гранули[(Co(OH)2)m n Co2+2(n – x)Cl-]2x: а) NaCI; б) KF; в) Al2(SO4)3; г) CaCl2. 85. Виберітьформулу найкращогокоагулянта для наведеної гранули [(Fe(OH)3)m nFeO+(n – x)Cl-]x+: а) KCl; б) AlCl3; в) NaF; г) K2SO4. 86. Зазначте умову, за якої відбувається утворення міцели{[(Ag2S)m nS2-2(n – x)K+]2x K+} унаслідок взаємодії розчинів арґентум нітрату та калій сульфіду: а) AgNO3 взято у надлишку; б) K2S взято у надлишку; в) використано еквімолярні кількості обох речовин; г) правильної відповіді немає. 87. Виберіть формулу міцели золю, одержаного внаслідок реакції, яку відображає така схема: BaCl2+ AgNO3(надл)→: а) [(AgCl)mnBa2+2(n-x)Cl-]2x+ 2xCl-; б) [(AgCl) mnCl - ½(n-x)Ba2+]x- ½xBa2+; в) [(AgCl)mnAg+2(n-x)Cl-]2xCl-; г) правильної відповіді немає. 88. Виберіть формулу гранули, утвореної при змішуванні розчинів натрій гідроксиду і купрум (ІІ) сульфату (надлишок): а) [(Cu(OH)2)m nOH-(n – x)Na+]; б) [(Cu(OH)2)m nOH-(n – x)Cu2+]; в) [(CuSO4)m nOH-(n – x)Na+]; г) [(Cu(OH)2)m nCu2+(n – x)SO42-]. 89. Назвіть протийон у золі, який утворюється при змішуванні розчинів FeCl3 та Na3PO4 (надлишок): а) Fe3+ б) Cl-; в) PO43-; г) Na+. 90. Назвіть потенціалоутворюючий йон міцели, яка утворюється при змішуванні розчинів CaCl2 та Na2SO4 (надлишок): а) Ca2+ б) Cl-; в) SO42-; г) Na+. 91. Виберіть правильний вираз стосовно співвідношення порогів коагуляції одно- дво- та тризарядних йонів згідно з першим правилом Шульца-Гарді. а) б) в) г) 92. Виберіть правильне твердження щодо седиментації: а) розчинення дрібних і збільшення великих частинок; б) злипання дисперсних частинок; в) осідання дисперсних частинок; г) розчинення дисперсних частинок. 93. Виберіть правильне твердження щодо висалювання білків: а) збільшення розчинності білків під дією сильних електролітів; б) збільшення розчинності білків під дією слабких електролітів; в) зменшення розчинності білків під дією сильних електролітів; г) зменшення розчинності білків під дією слабких електролітів. 94. Виберіть, як називається метод утворення дисперсної системи внаслідок реакції обміну, що супроводжується утворенням осаду: а) фізична конденсація; б) пептизація; в) диспергування; г) хімічна конденсація. 95. Виберіть правильне твердження щодо порогу коагуляції: а) найбільша концентрація електроліту, яка викликає коагуляцію; б) найменша концентрація електроліту, яка викликає коагуляцію; в) середня концентрація електроліту, яка викликає коагуляцію; г) правильної відповіді немає. 96. Виберіть схематичне зображення аніонiту:
97. Виберіть ряд йонів, який є ліотропним: а) б) в) г) 98. Зазначте, як називається переміщення фаз дисперсної системи під впливом електричного струму: а) електрична провідність; б) електроосмос; в) електрофорез; г) потенціал седиментації. 99. Виберіть прикладповерхнево-активних речовин (ПАР): а) білки; б) неорганічні кислоти; в) багатоатомні спирти; г) солі. 100. Виберіть правильне твердження щодо ліофільних систем: а) розчини, що містять тверді і рідкі речовини; б) частинки речовин, які добре взаємодіють із розчинником; в) частинки речовин, які погано взаємодіють із розчинником; г) істинні розчини. 101. Виберіть правильне твердження щодо електрокінетичного потенціалу: а) виникає на межі адсорбційного і дифузійного шарів; б) виникає на межі ядра та потенціалвизначальних іонів; в) виникає на межі потенціалвизначальних іонів та адсорбційного шару; г) виникає між ядрами та дифузійним шаром. 102. З наведених формул оберіть рівняння адсорбції Гіббса: а) в) 103. Виберіть прикладповерхнево-інактивних речовин (ПІР): а) органічні кислоти; б) спирти; в) луги; г) мила. 104. Зазначте, яким чином поверхнево-активні речовини впливають на поверхневий натяг у розчинах: а) зменшують; б) підвищують; в) не змінюють; г) закономірність впливу не встановлено. 105. Виберіть визначеннякоагуляції: а) розчинення дрібних і зростання більших частинок; б) злипання дисперсних частинок; в) осідання дисперсних частинок; г) розчинення дисперсних частинок. 106. Зазначте, як називається твердження: «поверхнева активність одного гомологічного ряду зростає у 3-3,5 раза при збільшенні вуглеводневого радикала на одну –СН2–групу»: а) правило Гіббса; б) правило Ленгмюра; в) правило Дюкло-Траубе; г) правилоПанета-Фаянса. 107. Виберіть правильне твердження щодоелектрофорезу: а) рух частинок дисперсної фази у полі постійного струму; б) рух дисперсного середовища щодо дисперсної фази; в) розкладання електроліту під дією електричного струму; г) метод кількісного аналізу, який базується на використанні електролізу. 108. Виберіть правильне твердження щодоадсорбції. а) виділення речовини з поверхні іншої; б) поглинання однієї речовини на поверхні іншої; в) утворення нової хімічної сполуки на поверхні іншої речовини; г) розчинення частинок твердої речовини під дією розчинника. 109. Зазначте, як називається здатність системи зберігати однорідний розподіл частинок у всьому об’ємі системи: а) термодинамічна стійкість; б) агрегативна стійкість; в) седиментаційна стійкість; г) коагулююча здатність. 110. Зазначте, як впливаєпідвищення температури, що призводить до збільшення адсорбції ПАР на пористому матеріалі: а) так; б) не змінює; в) призводить до зменшення адсорбції; г) правильної відповіді немає. 111. Поверхнево-активні речовини у розчинах зменшують поверхневий натяг: а) так; б) ні; в) не змінюють; г) правильної відповіді немає. 112. Виберіть правильне висловлювання щодоліофобних систем: а) розчини, що містять тверді і рідкі речовини; б) частинки речовин, які добре взаємодіють із розчинником; в) частинки речовин, які погано взаємодіють із розчинником; г) істинні розчини. 113. Виберіть приклад ліофільної системи: а) розчин сахарози у воді; б) розчин білка; в) золь золота; г) розчин глини у воді. 114. Виберіть схематичне зображення катіонiту:
115. Що таке седиментація: а) розчинення дрібних і зростання великих частинок; б) злипання дисперсних частинок; в) осідання дисперсних частинок; г) розчинення дисперсних частинок. 116. Зазначте назву грубих дисперсій твердих тіл у рідкому дисперсному середовищі: а) суспензія; б) емульсія; в) гель; г) піна. 117. Що таке електрофорез: а) рух частинок дисперсної фази у полі постійного струму; б) рух дисперсного середовища щодо дисперсної фази; в) розкладання електроліту під дією електричного струму; г) метод кількісного аналізу, який збазується на використанні електролізу. 118. Роль електрохімічних явищ у біологічних процесах. 119. Електродні потенціали і механізм їх виникнення. Рівняння Нернста для обчислення електродних потенціалів. 120. Нормальний (стандартний) електродний потенціал. Вимір електродних потенціалів. Електроди визначення та електроди прорівняння. 121. Гальванічні елементи. 122. Роль окисно-відновних реакцій у процесах життєдіяльності. Окисно-відновний потенціал як міра окисної та відновної здатності системи. Нормальний окисно–відновний потенціал. 123. Прогнозування напрямку окисно–відновних реакцій за величинами окисно–відновних потенціалів. Значення окисно–відновних потенціалів у механізмі процесів біологічного окиснення. 124. Поверхневі явища та їх значення в біології та медицині. 125. Поверхневий натяг рідин та розчинів. Ізотерма поверхневого натягу. 126. Поверхнево–активні та поверхнево–неактивні речовини. 127. Поверхнева активність. Правило Дюкло-Траубе. 128. Адсорбція на межі поділу рідина – газ, рідина – рідина, тверде тіло – газ. Рівняння Гіббса. 129. Орієнтація молекул поверхнево–активних речовин у поверхневому шарі. Уявлення про структуру біологічних мембран. 130. Абсорбція на межі поділу тверде тіло-газ. Рівняння Ленгмюра. 131. Абсорбція із розчину на поверхні твердого тіла. Фізична та хімічна адсорбція. 132. Адсорбція електролітів: специфічна (вибірна) та іонообмінна. Правило Панета–Фаянса. 133. Іонообмінники природні та синтетичні. Роль адсорбції та іонного обміну в процесах життєдіяльності рослин і організмів. 134. Хроматографія. Класифікація хроматографічних методів аналізу за ознакою агрегатного стану фаз, техніки виконання та механізму розподілу. 135. Адсорбційна, іонообмінна та розподільна хроматографія. Застосування хроматографії в біології та медицині. 136. Організм як складна сукупність дисперсних систем. Класифікації дисперсних систем за ступенем дисперсності. 137. Колоїдний стан. Ліофільні та ліофобні колоїдні системи. 138. Будова колоїдних часток. Подвійний електричний шар. Електрокінетичний потенціал колоїдної частинки. 139. Методи одержання та очищення колоїдних розчинів. 140. Молекулярно–кінетичні властивості колоїдних систем. Оптичні властивості колоїдних систем. 141. Електрокінетичні явища. Електрофорез. Застосування електрофорезу в дослідницькій та клініко–лабораторній практиці. 142. Кінетична (седиментаційна) та агрегативна стійкість дисперсних систем. 143. Фактори стійкості. Коагуляція. Механізм коагулюючої дії електролітів. Поріг коагуляції. Правило Щульце–Гарді. Взаємна коагуляція. 144. Процеси коагуляції при очищенні питної води та стічних вод. Колоїдний захист. 145. Прогнозування напрямку окисно–відновних реакцій за величинами окисно–відновних потенціалів. Значення окисно–відновних потенціалів у механізмі процесів біологічного окиснення. 146. Електродні потенціали і механізм їх виникнення. Рівняння Нернста для обчислення електродних потенціалів. 147. Роль окисно-відновних реакцій у процесах життєдіяльності. Окисно-відновний потенціал як міра окисної та відновної здатності системи. Нормальний окисно–відновний потенціал. 148. Добування колоїдних систем методами диспергування. 149. Добування колоїдної системи методами конденсації. 150. Електрофорез та електроосмос, їх застосування у медицині. СПИСОК ЛІТЕРАТУРИ
1. Ершов Ю. А. Общая химия. Биофизическая химия. Химия биогенных элементов / В. А. Попков, А. С. Берлянд и др.; под ред. Ю. А. Ершова. – М.: Высшая школа, 2003. –560с. 2. Мороз А. С. Медична хімія: підручник для студентів вищих навч. мед. закл. / Д. Д. Луцевич, Л. П. Яворська. - Вінниця, 2011. – 776 с. 3. Кинетика химических реакций и биокатализ: методические указания / составители: В. М. Марьяновский, А. А. Марьяновская. – Сумы: СумГУ, 1998. 4. Комплексные соединения. Окислительно-восстанови-тельные реакции: методические указания / составители: В. М. Марьяновский, А. А. Марьяновская. – Сумы: СФТИ, 1993. 5. Манжос О. П. Методичні вказівки до практичних занять з курсу «Медична хімія» / Т. В. Диченко, Л. М. Миронович. - Суми: СумДУ, 2008. 6. Манжос О. П. Методичні вказівки до практично-лабораторних занять з курсу «Медична хімія» / Т. В. Диченко, Л. М. Миронович. - Суми: СумДУ, 2009. 7. Миронович Л.М. Медична хімія / О. О. Мардашко. –К.: Каравела, 2007. –160 с. 8. Основы химической термодинамики и биоэнергетики: методические указания / составители: В. М. Марьяновский, А. А. Марьяновская. – Сумы: СумГУ, 1998. 9. Полумбрик О. М. Окисно–відновні процеси / О. І. Карнаухов, П. В. Федоренко. –Київ: НУХТ, 2002. 10. Растворы в биологических системах: методические указания / составители: В. М. Марьяновский, А. А. Марьяновская, Л. И. Марченко. – Сумы: СумГУ, 1998. 11. Физико-химия поверхностных явлений: методические указания / составители: В. М. Марьяновский, А. А. Марьяновская. – Сумы: СумГУ, 1999. 12. Физико-химия дисперсных систем: методические указания / составители: В. М. Марьяновский, А. А. Марьяновская. – Сумы: СумГУ, 1999.
Додаток А (обов’язковий) ВАРІАНТИ ІНДИВІДУАЛЬНИХ ЗАВДАНЬ
Продовження додатку А
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-06-26; просмотров: 159; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.184.36 (0.01 с.) |

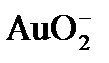 (n – x)K+]x-:
(n – x)K+]x-: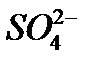 2(n – x)K+] 2x K+} унаслідок взаємодії у розчині барій хлориду та калій сульфату:
2(n – x)K+] 2x K+} унаслідок взаємодії у розчині барій хлориду та калій сульфату: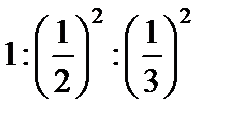 ;
;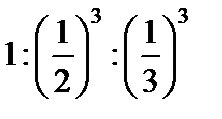 ;
;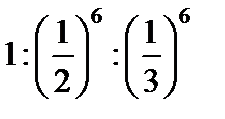 ;
;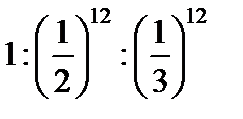 .
.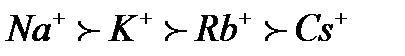 ;
;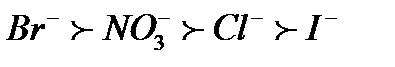 ;
;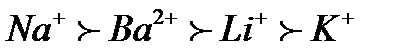 ;
;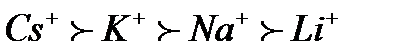 .
.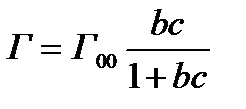 ; б)
; б) 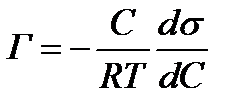 ;
;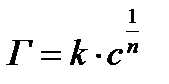 ; г)
; г) 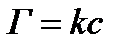 .
.


