
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Рівновага у розчинах електролітівСодержание книги
Поиск на нашем сайте
61. Назвіть, які з наведених солей 62. Назвіть, які з наведених солей 63. Зазначте, які з наведених солей 64. Зазначте, які з наведених солей 65. Зазначте, які з наведених солей 66. Зазначте, які з наведених солей 67. Зазначте, які з наведених солей 68. Зазначте, які з наведених солей 69. Зазначте, які з наведених солей 70. Зазначте, які з наведених солей 71. Назвіть, які з наведених солей 72. Назвіть, які з наведених солей 73. Назвіть, які з наведених солей 74. Назвіть, які з наведених солей 75. Назвіть, які з наведених солей 76. Назвіть, які з наведених солей 77. Назвіть, які з наведених солей 78. Назвіть, які з наведених солей 79. Назвіть, які з наведених солей 80. Назвіть, які з наведених солей 81. Назвіть, які з наведених солей 82. Назвіть, які з наведених солей 83. Назвіть, які з наведених солей 84. Назвіть, які з наведених солей 85. Назвіть, які з наведених солей 86. Назвіть, які з наведених солей 87. Яким чином можна послабити гідроліз солі 88. Назвіть, які з наведених солей 89. Назвіть, які з наведених солей 90. Назвіть, які з наведених солей 91. Розрахуйте рН і рОН розчину, у якому молярна концентрація KOH дорівнює 0,00001 моль/л. 92. Розрахуйте концентрацію гідроксид-іонів та йонів Гідрогену у розчині, рН якого 9. 93. Розрахуйте рН і рОН розчину, у якому молярна концентрація NaOH дорівнює 0,000001 моль/л. 94. Розрахуйте концентрацію йонів Гідрогену та гідроксид-йонів у розчині, рОН якого 10. 95. Чи зміниться рН та буферна ємність буферного розчину при його розведенні? Відповідь поясніть на прикладі ацетатного буфера. 96. Чи зміниться рН та буферна ємність буферного розчину при його розведенні? Відповідь поясніть на прикладі амонійного буфера. 97. Розрахуйте рН розчину, у якому молярна концентрація 98. Розрахуйте рН розчину, у якому молярна концентрація 99. Розрахуйте рОН розчину, у якому молярна концентрація 100. Розрахуйте рН розчину, у якому молярна концентрація 101. Розрахуйте рН ацетатного буферного розчину, у якому співвідношення компонентів 102. Розрахуйте рН форміатного буферного розчину, у якому співвідношення компонентів 103. Розрахуйте рН аміачного буферного розчину, у якому співвідношення компонентів 104. Розрахуйте рН аміачного буферного розчину, у якому співвідношення компонентів 105. Розрахуйте, як зміниться рН, якщо до 1 л буферного розчину, що містить 0,01 моль ацетатної кислоти і 0,01 моль натрій ацетату, додати 0,001 моль хлоридної кислоти (рКа = 4,76). 106. Розрахуйте співвідношення молярних концентрацій йонів амонію та амоній гідроксиду в аміачному буферному розчині, рН якого 9 (рКв = 4,75). 107. Розрахуйте рН ацетатної буферної суміші, яка містить в 1 л 0,2 моль кожного з компонентів. Як зміниться рН буферної суміші при додаванні до 1 л суміші 0,01 моль хлоридної кислоти (рКа = 4,76). 108. Розрахуйте рН ацетатної буферної суміші, яка містить в 1 л 0,05 моль кожного з компонентів. Як зміниться рН буферної суміші при додаванні до 1 л суміші 0,001 моль натрій гідроксиду (рКа = 4,76). 109. Розрахуйте рН ацетатної буферної суміші, яка містить в 1 л 0,1 моль кожного з компонентів. Як зміниться рН буферної суміші при додаванні до 1 л суміші 0,02 моль хлоридної кислоти (рКа = 4,76). 110. Розрахуйте рН бензоатної буферної суміші, яка містить в 1 л 0,3 моль бензойної кислоти 111. Розрахуйте співвідношення молярних концентрацій ацетат-іонів та ацетатної кислоти в ацетатному буферному розчині, рН якого 5 (рКа = 4,76). 112. Розрахуйте рН буферного розчину, для приготування 20 мл якого було змішано 12 мл 0,1М розчину оцтової кислоти та 8 мл 0,1М розчину натрій ацетату (рКа = 4,76). 113. Розрахуйте рН буферного розчину, у якому концентрація мурашиної кислоти 0,2 моль/л, а натрій форміату – 0,15 моль/л (рКа = 3,74). 114. Розрахуйте рН буферного розчину для приготування якого було змішано 50 мл 0,5 М розчину амоній гідроксиду та 200 мл 0,1М розчину амоній хлориду (рКв = 4,75). 115. Розрахуйте рН форміатної буферної суміші, яка містить в 1 л 0,1 моль кожного з компонентів 116. Розрахуйте співвідношення концентрацій натрій ацетату та оцтової кислоти у буферному розчині, рН якого 5,8 (рКа = 4,76). 117. Розрахуйте рН буферного розчину, у якому концентрація амоній гідроксиду становить 0,1 моль/л, амоній хлориду – 0,2 моль/л (рКв = 4,75). 118. Розрахуйте, яку масу натрій ацетату потрібно додати до 200 мл 2 моль/л розчину оцтової кислоти, щоб отримати буферний розчин з рН 3,44 (рКа = 4,76). 119. Розрахуйте рН буферного розчину, у якому концентрація оцтової кислоти становить 0,1 моль/л, а натрій ацетату – 0,01 моль/л (рКа = 4,76). 120. Розрахуйте рН буферного розчину, який утворений при змішуванні 15 мл 0,5 М розчину оцтової кислоти і 25 мл 0,5 М розчину натрій ацетату (рКа = 4,76).
ТЕРМОДИНАМІКА На підставі стандартних ентальпій утворення Таблиця 1
Продовження таблиці 1
Таблиця 2. Стандартні ентальпії утворення
Продовження таблиці 2
Продовження таблиці 2
٭Наведені у таблиці величини взято з довідника (Термические константы веществ / под ред. В.П. Глушко. - М: ВИНИТИ, 1965-1981. Вып.І-Х)
КІНЕТИКА 1. Розрахуйте, у скільки разів зросте швидкість хімічної реакції при підвищенні температури на Таблиця 3
У таблиці 2 зазначене значення температурного коефіцієнта хімічної реакції Таблиця 4
На скільки градусів необхідно підвищити температуру, щоб швидкість реакції зросла в n разів при даному значенні Таблиця 5
2. Складіть вираз константи рівноваги оборотної реакції, наведеної в таблиці. Визначте, в який бік зміститься рівновага оборотної реакції: а) при підвищенні температури (р=const); б) при підвищенні тиску (T=const) (табл. 6). Таблиця 6
3. Розрахуйте, як зміниться швидкість прямої та зворотної реакцій, якщо об’єм газової суміші змінити в n разів (табл. 7).
Таблиця 7
4. Розрахуйте, як зміниться швидкість прямої та зворотної реакцій, якщо тиск змінити в n разів (продовження табл. 7): Продовження таблиці 7
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-06-26; просмотров: 137; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.227.21.101 (0.01 с.) |

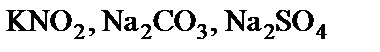 підлягають гідролізу, складіть рівняння гідролізу, зазначте реакцію середовища їх водних розчинів.
підлягають гідролізу, складіть рівняння гідролізу, зазначте реакцію середовища їх водних розчинів. підлягають гідролізу, складіть рівняння гідролізу, зазначте реакцію середовища їх водних розчинів.
підлягають гідролізу, складіть рівняння гідролізу, зазначте реакцію середовища їх водних розчинів.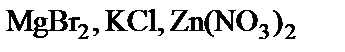 підлягають гідролізу, складіть рівняння гідролізу, зазначте реакцію середовища їх водних розчинів.
підлягають гідролізу, складіть рівняння гідролізу, зазначте реакцію середовища їх водних розчинів.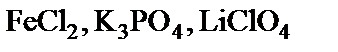 підлягають гідролізу, складіть рівняння гідролізу, зазначте реакцію середовища їх водних розчинів.
підлягають гідролізу, складіть рівняння гідролізу, зазначте реакцію середовища їх водних розчинів.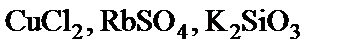 підлягають гідролізу, складіть рівняння гідролізу, назвіть реакцію середовища їх водних розчинів.
підлягають гідролізу, складіть рівняння гідролізу, назвіть реакцію середовища їх водних розчинів. підлягають гідролізу, складіть рівняння гідролізу, назвіть реакцію середовища їх водних розчинів.
підлягають гідролізу, складіть рівняння гідролізу, назвіть реакцію середовища їх водних розчинів. підлягають гідролізу, складіть рівняння гідролізу, назвіть реакцію середовища їх водних розчинів.
підлягають гідролізу, складіть рівняння гідролізу, назвіть реакцію середовища їх водних розчинів.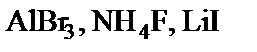 підлягають гідролізу, складіть рівняння гідролізу, назвіть реакцію середовища їх водних розчинів.
підлягають гідролізу, складіть рівняння гідролізу, назвіть реакцію середовища їх водних розчинів. підлягають гідролізу, складіть рівняння гідролізу, назвіть реакцію середовища їх водних розчинів.
підлягають гідролізу, складіть рівняння гідролізу, назвіть реакцію середовища їх водних розчинів. підлягають гідролізу, складіть рівняння гідролізу, назвіть реакцію середовища їх водних розчинів.
підлягають гідролізу, складіть рівняння гідролізу, назвіть реакцію середовища їх водних розчинів. підлягають гідролізу, складіть рівняння гідролізу, зазначте реакцію середовища їх водних розчинів.
підлягають гідролізу, складіть рівняння гідролізу, зазначте реакцію середовища їх водних розчинів. підлягають гідролізу, складіть рівняння гідролізу, зазначте реакцію середовища їх водних розчинів.
підлягають гідролізу, складіть рівняння гідролізу, зазначте реакцію середовища їх водних розчинів. підлягають гідролізу, складіть рівняння гідролізу, зазначте реакцію середовища їх водних розчинів.
підлягають гідролізу, складіть рівняння гідролізу, зазначте реакцію середовища їх водних розчинів.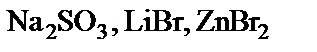 підлягають гідролізу, складіть рівняння гідролізу, зазначте реакцію середовища їх водних розчинів.
підлягають гідролізу, складіть рівняння гідролізу, зазначте реакцію середовища їх водних розчинів. підлягають гідролізу, складіть рівняння гідролізу, зазначте реакцію середовища їх водних розчинів.
підлягають гідролізу, складіть рівняння гідролізу, зазначте реакцію середовища їх водних розчинів. підлягають гідролізу, складіть рівняння гідролізу, зазначте реакцію середовища їх водних розчинів.
підлягають гідролізу, складіть рівняння гідролізу, зазначте реакцію середовища їх водних розчинів. підлягають гідролізу, складіть рівняння гідролізу, зазначте реакцію середовища їх водних розчинів.
підлягають гідролізу, складіть рівняння гідролізу, зазначте реакцію середовища їх водних розчинів.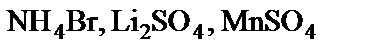 підлягають гідролізу, складіть рівняння гідролізу, зазначте реакцію середовища їх водних розчинів.
підлягають гідролізу, складіть рівняння гідролізу, зазначте реакцію середовища їх водних розчинів.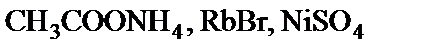 підлягають гідролізу, складіть рівняння гідролізу, зазначте реакцію середовища їх водних розчинів.
підлягають гідролізу, складіть рівняння гідролізу, зазначте реакцію середовища їх водних розчинів. підлягають гідролізу, складіть рівняння гідролізу, зазначте реакцію середовища їх водних розчинів.
підлягають гідролізу, складіть рівняння гідролізу, зазначте реакцію середовища їх водних розчинів. підлягають гідролізу, складіть рівняння гідролізу, зазначте реакцію середовища їх водних розчинів.
підлягають гідролізу, складіть рівняння гідролізу, зазначте реакцію середовища їх водних розчинів.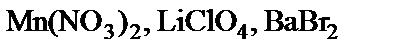 підлягають гідролізу, складіть рівняння гідролізу, зазначте реакцію середовища їх водних розчинів.
підлягають гідролізу, складіть рівняння гідролізу, зазначте реакцію середовища їх водних розчинів. підлягають гідролізу, складіть рівняння гідролізу, зазначте реакцію середовища їх водних розчинів.
підлягають гідролізу, складіть рівняння гідролізу, зазначте реакцію середовища їх водних розчинів.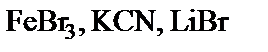 підлягають гідролізу, складіть рівняння гідролізу, зазначте реакцію середовища їх водних розчинів
підлягають гідролізу, складіть рівняння гідролізу, зазначте реакцію середовища їх водних розчинів підлягають гідролізу, складіть рівняння гідролізу, зазначте реакцію середовища їх водних розчинів.
підлягають гідролізу, складіть рівняння гідролізу, зазначте реакцію середовища їх водних розчинів. підлягають гідролізу, складіть рівняння гідролізу, зазначте реакцію середовища їх водних розчинів.
підлягають гідролізу, складіть рівняння гідролізу, зазначте реакцію середовища їх водних розчинів. ? Відповідь поясніть.
? Відповідь поясніть. підлягають гідролізу, складіть рівняння гідролізу, зазначте реакцію середовища їх водних розчинів.
підлягають гідролізу, складіть рівняння гідролізу, зазначте реакцію середовища їх водних розчинів. підлягають гідролізу, складіть рівняння гідролізу, зазначте реакцію середовища їх водних розчинів.
підлягають гідролізу, складіть рівняння гідролізу, зазначте реакцію середовища їх водних розчинів.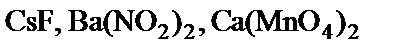 підлягають гідролізу, складіть рівняння гідролізу, зазначте реакцію середовища їх водних розчинів.
підлягають гідролізу, складіть рівняння гідролізу, зазначте реакцію середовища їх водних розчинів.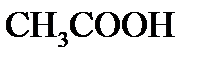 дорівнює 0,01 моль/л, а константа дисоціації кислоти –
дорівнює 0,01 моль/л, а константа дисоціації кислоти – 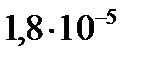 .
. дорівнює 0,025 моль/л, а константа дисоціації кислоти –
дорівнює 0,025 моль/л, а константа дисоціації кислоти –  .
.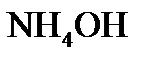 дорівнює 0,0015 моль/л, а константа дисоціації амоній гідроксиду –
дорівнює 0,0015 моль/л, а константа дисоціації амоній гідроксиду –  .
. дорівнює 0,003 моль/л, константа дисоціації кислоти –
дорівнює 0,003 моль/л, константа дисоціації кислоти – 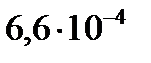 .
.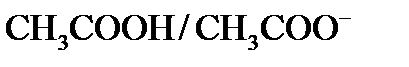 становить 2:3 (рКа = 4,76).
становить 2:3 (рКа = 4,76). становить 3:2 (рКа = 3,74).
становить 3:2 (рКа = 3,74). становить 2:1 (рКв = 4,75).
становить 2:1 (рКв = 4,75). та 0,2 моль натрій бензоату
та 0,2 моль натрій бензоату  . Як зміниться рН буферної суміші при додаванні до 1 л суміші 0,02 моль натрій гідроксиду (рКа = 4,2).
. Як зміниться рН буферної суміші при додаванні до 1 л суміші 0,02 моль натрій гідроксиду (рКа = 4,2). . Як зміниться рН буферної суміші при додаванні до 1 л суміші 0,01 моль калій гідроксиду (рКа = 3,74).
. Як зміниться рН буферної суміші при додаванні до 1 л суміші 0,01 моль калій гідроксиду (рКа = 3,74).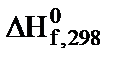 і абсолютних ентропій
і абсолютних ентропій 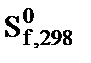 речовин визначте:
речовин визначте:  ,
, 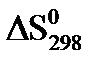 ,
,  хімічної реакції. Зробіть висновок щодо термодинамічної імовірності перебігу реакції за стандартних умов. Розрахунки провести за рівняннями реакцій, наведеними у таблиці 1, використовуючи довідкові дані, наведені у таблиці 2.
хімічної реакції. Зробіть висновок щодо термодинамічної імовірності перебігу реакції за стандартних умов. Розрахунки провести за рівняннями реакцій, наведеними у таблиці 1, використовуючи довідкові дані, наведені у таблиці 2.

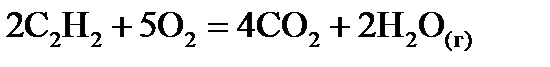
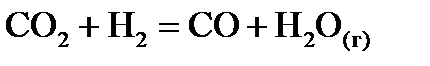


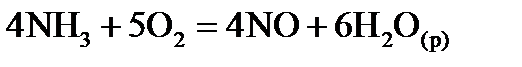

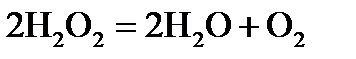
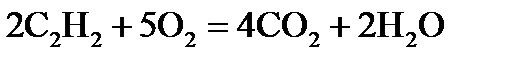

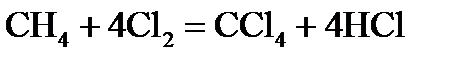
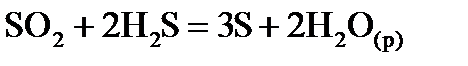
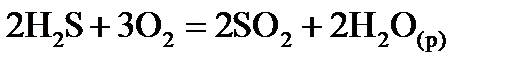
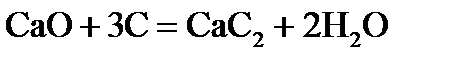


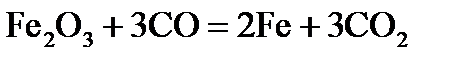

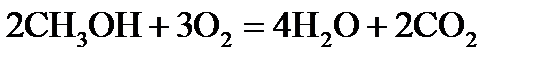


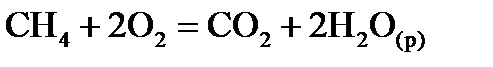

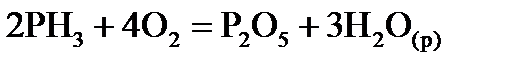

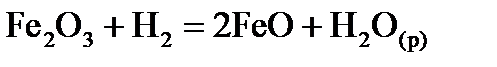
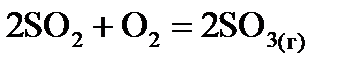


 , стандартні ентропії
, стандартні ентропії 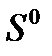 деяких неорганічних та органічних речовин при 298,15К٭
деяких неорганічних та органічних речовин при 298,15К٭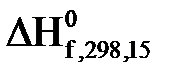 ,
кДж/моль
,
кДж/моль
 ,
Дж/(моль. К)
,
Дж/(моль. К)
 при названому значенні температурного коефіцієнта
при названому значенні температурного коефіцієнта  (табл. 3).
(табл. 3).
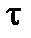 хвилин. Визначте час перебігу реакції при температурі 35 0С (табл. 4).
хвилин. Визначте час перебігу реакції при температурі 35 0С (табл. 4).
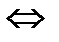 CO + CI2
CO + CI2
 CH3OH(г)
CH3OH(г)
 2SO3
2SO3
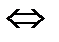 2NO +O2
2NO +O2



