
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Збірник індивідуальних завданьСодержание книги
Поиск на нашем сайте
ЗБІРНИК ІНДИВІДУАЛЬНИХ ЗАВДАНЬ з медичної хімії для студентів Медичного інституту СумДУ денної форми навчання
Суми Сумський державний університет Збірник індивідуальних завдань з медичної хімії / укладачі: О. П. Манжос, Ю. В. Ліцман. – Суми: Сумський державний університет, 2013. – 65 с.
Кафедра загальної хімії
ВСТУП Однією з основних форм самостійної роботи студентів є виконання ними індивідуальних домашніх завдань. Ці методичні вказівки містять типові завдання з дисципліни «Медична хімія», яка викладається на першому курсі для студентів Медичного інституту СумДУ зі спеціальностей «Лікувальна справа» та «Профілактична справа». Виконання завдань потребує від студента застосування теоретичних знань на конструктивному та творчому рівнях. Для успішного виконання завдань доцільно спочатку опрацювати необхідний теоретичний матеріал за підручником, посібником, конспектом лекцій тощо, після цього розпочати виконання завдання. У разі виникнення ускладнень під час розв’язання задач або вправ необхідно звернутися за консультацією до викладача. При оформленні завдань треба дотримуватися таких правил: виконання кожного завдання починати з нової сторінки, обов’язково записувати умову завдання, наводити його розв’язок і відповідь. Завдання необхідно здавати вчасно. У разі незарахування виконаного завдання його необхідно виконати знову і подати разом із попереднім. Розв’язання окремих задач потребує використання довідкових даних, які для зручності подані у відповідних додатках. Вчасне і самостійне виконання індивідуальних завдань сприяє формуванню глибоких знань і навичок, дозволяє студентові орієнтуватися у рівні виконаної підготовки і визначати питання, які потребують доопрацювання. Подібний набір завдань дозволяє викладачеві за результатами виконання домашнього завдання об’єктивно оцінити рівень засвоєння студентами навчального матеріалу.
БІОГЕННІ ЕЛЕМЕНТИ 1. Як називається стан, зумовлений підвищенням концентрації вуглекислого газу в крові? Зазначте можливі причини виникнення такого стану. 2. Поясніть токсичну дію CO. 3. Які біомолекули організму містять Фосфор? 4. Складіть формули усіх оксидів Нітрогену. Які з них є кислотними? Який оксид Нітрогену використовується для інгаляційного наркозу? 5. Яку властивість озону використовують для знезаражування води? 6. У чому полягає небезпека хлорування питної води? До утворення яких токсичних речовин може призвести хлорування питної води? 7. У вигляді яких йонів галогени наявні в організмі? У чому полягає їх біологічна роль в організмі? 8. Наведіть приклади ендемічних захворювань. Надлишок або нестача яких елементів зумовлює їх виникнення? 9. Чому у медичній практиці використовують розчин йоду з калій йодидом? 10. У яких органах людини переважно накопичуються F, I? 11. Поясніть, чому при отруєнні бромом хворому рекомендовано приймати з їжею 10-30 г на добу натрій хлориду (повареної солі)? 12. За допомогою яких галогенів можна витіснити бром із розчину KBr? Напишіть відповідні рівняння хімічних реакцій? 13. Складіть формули і наведіть назви солей сульфатної кислоти, які застосовують у медичній практиці. Зазначте також мету їх застосування. 14. Поясніть, чим зумовлено застосування сульфуровмісних амінокислот як радіопротекторів (речовин, які використовують для захисту організму від дії йонізуючого випромінювання)? 15. Що називається натрій - калієвим насосом? Поясніть механізм його дії. 16. Поясніть механізм токсичної дії катіона Pb2+? 17. Складіть формули йонів, у складі яких міститься хімічний елемент Манган із ступенями окиснення +6 та +7. Назвіть забарвлення цих йонів у розчинах. Складіть також формулу манган(ІV) оксиду і зазначте його забарвлення. 18. У яких ступенях окиснення сполуки Феруму, Кобальту та Нікелю є найбільш стійкими? 19. Які особливості електронних структур Феруму, Кобальту та Нікелю зумовлюють їх високу здатність до комплексоутворення? 20. За допомогою яких реакцій можна отримати розчин ферум(ІІ) хлориду? Що відбувається з розчином цієї солі при зберіганні її на повітрі? Напишіть рівняння хімічних реакцій. 21. Чи можна розчин FeCl2, що довго зберігався, використовувати для отримання лікувальних препаратів двовалентного Феруму? Відповідь поясніть. 22. Які функції виконують комплекси Феруму в організмі людини? 23. У чому полягає фізіологічна функція гемоглобіну? Який механізм «роботи» гемоглобіну? 24. Наведіть особливості електронної будови d-елементів та їх йонів. Які біологічні функції пов’язані з їхньою будовою? 25. Які функції в організмі людини виконує вітамін В12. Назвіть комплексоутворювач у вітаміні В12. Що є спільним у структурах молекул гемоглобіну і вітаміну В12? 26. Яку роль виконує хімічний елемент Купрум у білках і ферментах? 27. Який механізм токсичної дії розчинних солей Купруму, Аргентуму та Ауруму на організм людини? 28. Що обумовлює високу токсичність сполук Zn, Cd, Hg? 29. На чому ґрунтується застосування комплексонів як лікувальних препаратів при отруєнні сполуками Цинку, Кадмію та Меркурію? 30. Поясніть, чому тіоловмісні ферменти необоротно отруюються йонами Cu2+ і Ag+?
Завдання у тестовій формі КОМПЛЕКСНІ СПОЛУКИ Завдання у тестовій формі РОЗЧИНИ Кількісний склад розчинів 1. Розрахуйте: а) молярну концентрацію; б) молярну концентрацію еквівалента; в) моляльну концентрацію магній сульфату у його розчині з масовою часткою 20 % і густиною 1,22 г/мл. Опишіть застосування зазначеного розчину у медичній практиці. 2. Розрахуйте: а) молярну концентрацію; б) моляльну концентрацію; в) масу солі, що міститься у 20 мл розчину натрій нітриту з масовою часткою 2 % і густиною 1,011 г/мл. Опишіть застосування зазначеного розчину у медичній практиці. 3. Розрахуйте: а) молярну концентрацію; б) моляльну концентрацію; в) масу солі, що міститься у 50 мл розчину натрій хлориду з масовою часткою 10 % і густиною 1,07 г/мл. Опишіть застосування зазначеного розчину у медичній практиці. 4. Розрахуйте: а) молярну концентрацію; б) мольну частку; в) моляльну концентрацію хлоридної кислоти у її розчині з масовою часткою 8 % і густиною 1,04 г/мл. Опишіть застосування зазначеного розчину у медичній практиці. 5. Розрахуйте: а) молярну концентрацію; б) мольну частку; в) моляльну концентрацію глюкози у її розчині з масовою часткою 5 % і густиною 1,02 г/мл. Опишіть застосування зазначеного розчину у медичній практиці. 6. Розрахуйте: а) молярну концентрацію; б) молярну концентрацію еквівалента; в) моляльну концентрацію натрій тіосульфату у його розчині з масовою часткою 30 % і густиною 1,27 г/мл. Опишіть застосування зазначеного розчину у медичній практиці. 7. Розрахуйте: а) молярну концентрацію; б) мольну частку; в) моляльну концентрацію гідроген пероксиду у його розчині з масовою часткою 3 % і густиною 1,01 г/мл. Опишіть застосування зазначеного розчину у медичній практиці. 8. Розрахуйте: а) молярну концентрацію; б) моляльну концентрацію; в) масу калій перманганату у 100 мл його розчину з масовою часткою 2 % і густиною 1,013 г/мл. Опишіть застосування зазначеного розчину у медичній практиці. 9. Розрахуйте: а) молярну концентрацію; б) мольну частку; в) моляльну концентрацію етилового спирту у його розчині з масовою часткою 70 % і густиною 0,87 г/мл. Опишіть застосування зазначеного розчину у медичній практиці. 10. Розрахуйте: а) молярну концентрацію; б) молярну концентрацію еквівалента; в) моляльну концентрацію кальцій хлориду у його розчині з масовою часткою 5 % і густиною 1,08 г/мл. Опишіть застосування зазначеного розчину у медичній практиці. 11. Розрахуйте: а) масову частку; б) молярну концентрацію еквівалента; в) моляльну концентрацію магній сульфату у його розчині з молярною концентрацією 2,03 моль/л густиною 1,22 г/мл. Опишіть застосування зазначеного розчину у медичній практиці. 12. Розрахуйте: а) масову частку; б) моляльну концентрацію; в) масу солі, що міститься у 50 г розчину натрій хлориду з молярною концентрацією 1,83 моль/л і густиною 1,07 г/мл. Опишіть застосування зазначеного розчину у медичній практиці. 13. Розрахуйте: а) масову частку; б) молярну концентрацію еквівалента; в) моляльну концентрацію натрій тіосульфату у його розчині з молярною концентрацією 2,4 моль/л і густиною 1,27 г/мл. Опишіть застосування зазначеного розчину у медичній практиці. 14. Розрахуйте: а) масову частку; б) моляльну концентрацію; в) масу калій перманганату у 50 г його розчину з молярною концентрацією 0,128 моль/л і густиною 1,013 г/мл. Опишіть застосування зазначеного розчину у медичній практиці. 15. Розрахуйте: а) молярну концентрацію; б) мольну частку; в) моляльну концентрацію етилового спирту у його розчині з масовою часткою 95 % і густиною 0,79 г/мл. Опишіть застосування зазначеного розчину у медичній практиці. 16. Розрахуйте: а) молярну концентрацію; б) молярну концентрацію еквівалента; в) моляльну концентрацію кальцій хлориду у його розчині з масовою часткою 10 % і густиною 1,084 г/мл. Опишіть застосування зазначеного розчину у медичній практиці. 17. Розрахуйте: а) масову частку; б) молярну концентрацію еквівалента; в) моляльну концентрацію кальцій хлориду у його розчині з молярною концентрацією 0,976 моль/л густиною 1,084 г/мл. Опишіть застосування зазначеного розчину у медичній практиці. 18. Розрахуйте: а) молярну концентрацію еквівалента; б) моляльну концентрацію; в) масу натрій гідрогенкарбонату у 200 мл його розчину з масовою часткою 2 % і густиною 1,0132 г/мл. Опишіть застосування зазначеного розчину у медичній практиці. 19. Розрахуйте: а) масову частку; б) моляльну концентрацію; в) масу солі, що міститься у 150 мл розчину натрій гідрогенкарбонату з молярною концентрацією 0,62 моль/л і густиною 1,0354 г/мл. Опишіть застосування зазначеного розчину у медичній практиці. 20. Розрахуйте: а) масову частку; б) мольну частку; в) моляльну концентрацію хлоридної кислоти з молярною концентрацією 2,4 моль/л і густиною 1,04 г/мл. Опишіть застосування зазначеного розчину у медичній практиці. 21. Розрахуйте: а) молярну концентрацію; б) мольну частку; в) моляльну концентрацію калій йодиду у його розчині з масовою часткою 4 % і густиною 1,028 г/мл. Опишіть застосування зазначеного розчину у медичній практиці. 22. Розрахуйте: а) масову частку; б) мольну частку; в) моляльну концентрацію калій йодиду у його розчині з молярною концентрацією 0,248 моль/л і густино 1,028 г/мл. Опишіть застосування зазначеного розчину у медичній практиці. 23. Розрахуйте: а) молярну концентрацію; б) мольну частку; в) моляльну концентрацію натрій йодиду у його розчині з масовою часткою 10 % і густиною 1,08 г/мл. Опишіть застосування зазначеного розчину у медичній практиці. 24. Розрахуйте: а) масову частку; б) мольну частку; в) моляльну концентрацію натрій йодиду у його розчині з молярною концентрацією 0,721 моль/л і густиною 1,08 г/мл. Опишіть застосування зазначеного розчину у медичній практиці. 25. Розрахуйте: а) молярну концентрацію; б) моляльну концентрацію; в) мольну частку фенолу у його розчині з масовою часткою 5 % і густиною 1 г/мл. Опишіть застосування зазначеного розчину у медичній практиці. 26. Розрахуйте: а) молярну концентрацію; б) мольну частку; в) моляльну концентрацію амоній хлориду у його розчині з масовою часткою 5 % і густиною 1,014 г/мл. Опишіть застосування зазначеного розчину у медичній практиці. 27. Розрахуйте: а) молярну концентрацію калій хлориду; б) мольну частку глюкози; в) моляльну концентрацію глюкози у розчині, який містить 7 г натрій хлориду, 5 г натрій гідрогенокарбонату, 3 г калій хлориду, 40 г глюкози у 2 літрах води, вважаючи, що густина розчину 1 г/мл. Опишіть застосування зазначеного розчину у медичній практиці. 28. Розрахуйте: а) молярну концентрацію; б) мольну частку; в) моляльну концентрацію натрій броміду у його розчині з масовою часткою 3 % густиною 1,022 г/мл. Опишіть застосування зазначеного розчину у медичній практиці. 29. Розрахуйте: а) масову частку; б) моляльну концентрацію; в) масу солі, що міститься у 300 г розчину амоній хлориду з молярною концентрацією 0,95 моль/л і густиною 1,014 г/мл. Опишіть застосування зазначеного розчину у медичній практиці. 30. Розрахуйте: а) мольну частку; б) молярну концентрацію еквівалента; в) моляльну концентрацію калій ацетату у його розчині з масовою часткою 35 % і густиною 1,19 г/мл. Опишіть застосування зазначеного розчину у медичній практиці. ТЕРМОДИНАМІКА На підставі стандартних ентальпій утворення Таблиця 1
Продовження таблиці 1
Таблиця 2. Стандартні ентальпії утворення
Продовження таблиці 2
Продовження таблиці 2
٭Наведені у таблиці величини взято з довідника (Термические константы веществ / под ред. В.П. Глушко. - М: ВИНИТИ, 1965-1981. Вып.І-Х)
КІНЕТИКА 1. Розрахуйте, у скільки разів зросте швидкість хімічної реакції при підвищенні температури на Таблиця 3
У таблиці 2 зазначене значення температурного коефіцієнта хімічної реакції Таблиця 4
На скільки градусів необхідно підвищити температуру, щоб швидкість реакції зросла в n разів при даному значенні Таблиця 5
2. Складіть вираз константи рівноваги оборотної реакції, наведеної в таблиці. Визначте, в який бік зміститься рівновага оборотної реакції: а) при підвищенні температури (р=const); б) при підвищенні тиску (T=const) (табл. 6). Таблиця 6
3. Розрахуйте, як зміниться швидкість прямої та зворотної реакцій, якщо об’єм газової суміші змінити в n разів (табл. 7).
Таблиця 7
4. Розрахуйте, як зміниться швидкість прямої та зворотної реакцій, якщо тиск змінити в n разів (продовження табл. 7): Продовження таблиці 7
ОКИСНО-ВІДНОВНІ РЕАКЦІЇ На основі електронного балансу розставте коефіцієнти у рівнянні окисно-відновної реакції і зазначте суму всіх коефіцієнтів, зазначте тип окисно-відновної реакції:
1. FeCl3 + KI à FeCl2 + I2 + KCl. а) 15; б) 16; в) 17; г) 18.
2. S + KClO3 + H2O à Cl2 + K2SO4 + H2SO4. а) 17; б) 19; в) 21; г) 23.
3. FeSO4+KMnO4 + H2SO4à Fe2(SO4)3 + MnSO4 +K2SO4+ H2O. а) 34; б) 35; в) 33; г) 36.
4. Cu + H2SO4 (к) à CuSO4 + SO2 + H2O. а) 5; б) 6; в) 7; г) 8.
5. Н2О2 + НI à HIO3 + H2O. а) 6; б) 7; в) 8; г) 5.
6. Cd + H2SO4 (к) à CdSO4 + S + H2O. а) 15; б) 14; в) 12; г) 13.
7. Zn + KNO3 + KOH + H2O à K2[Zn(OH)4] + NH3. а) 20; б) 25; в) 26; г) 23.
8. AsH3 + HNO3 à H3AsO4 + NO + H2O. а) 26; б) 24; в) 23; г) 28.
9. K2MnO4 + H2O àKMnO4 + MnO2 + КOН. а) 12; б) 10; в) 13; г)11.
10. KMnO4 + H2C2O4 + H2SO4 à K2SO4 + MnSO4 + CO2 +H2O. а) 31; б) 29; в) 26; г) 32.
11. Na2SO3 + KMnO4 + HClàNa2SO4 + MnCl2 + КCl + H2O. а) 30; б) 25; в) 21; г) 26.
12. KClO3 + KCl + H2SO4 à Cl2 + K2SO4 + H2O. а) 20; б) 19; в) 18; г)17.
13. Ca3(PO4)2 + C + SiO2 à P + CO + CaSiO3. а) 17; б) 18; в) 20; г)19.
14. KСrO2 + KOH + H2O2 à K2CrO4 + H2O. а) 12; б) 13; в) 14; г) 15.
15. Mg + H2SO4 (к) à MgSO4 + H2S + H2O. а) 15; б) 17; в) 16; г) 18.
16. MnO(OH)2 + F2 + H2O àHMnO4 + HF. а) 13; б) 14; в) 15; г) 16.
17. Zn + HNO3 à Zn(NO3)2 + NH4NO3 + H2O. а) 23; б) 24; в) 25; г) 22.
18. Mg + H2SO4 àMgSO4 + H2S + H2O. а) 13; б) 14; в) 15; г) 16.
19. Zn + K2Cr2O7 + H2SO4 ® ZnSO4 + Cr2(SO4)3 +K2SO4 +.H2O. а) 21; б) 23; в) 25; г) 27.
20. K2Cr2O7 + KNO2 + H2SO4 ® Cr2(SO4)3 + KNO3 +K2SO4 +H2O. а) 15; б) 17; в) 19; г) 21.
21. Br2 + K3[Cr(OH)6] + KOH → KBr + K2CrO4+ H2O а) 21; б) 23; в) 25; г) 27.
22. SnSO4 + KMnO4 + H2SO4 ® Sn(SO4)2 + MnSO4 + K2SO4 +H2O. а) 31; б) 33; в) 35; г) 37.
23. Al + NaOH + H2O → Na3[Al(OH)6] + H2 а) 17; б) 19; в) 20; г) 21. 24. Si + HNO3 + HF → H2[SiF6] + NO + H2O а) 25; б) 30; в) 35; г) 40.
25. Au + HCl + HNO3 → H[AuCl4] + NO + H2O а) 7; б) 8; в) 9; г) 10. 26. MnCO3 + KClO3 → MnO2 + KCl + CO2 а) 9; б) 10; в) 11; г) 12.
27. KClO3 + FeSO4 + H2SO4 ® KCl + Fe2(SO4)3 + H2O. а) 13; б) 15; в) 17; г) 19.
28. Ti + HNO3 + HF → H2[TiF6] + NO + H2O а) 30; б) 35; в) 40; г) 45.
29. H2O2 + CrCl3 + NaOH ® Na2CrO4 + NaCl + H2O. а) 21; б) 25; в) 31; г) 35.
30. Zn + KClO3 + KOH + H2O → K2[Zn(OH)4] + KCl. а) 14; б) 16; в) 18; г) 20.
ГАЛЬВАНІЧНІ ЕЛЕМЕНТИ Складіть схему гальванічного елемента, враховуючи значення стандартних електродних потенціалів металів (див. табл. 8, 9) і концентрації розчинів, в яких знаходяться металічні пластинки, складіть рівняння катодного та анодного процесів і сумарне рівняння реакції, розрахуйте ЕРС для складеного гальванічного елемента.
Таблиця 8
Таблиця 9 Стандартні електродні потенціали металічних електродів
|


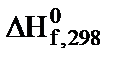 і абсолютних ентропій
і абсолютних ентропій 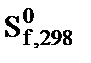 речовин визначте:
речовин визначте:  ,
, 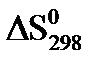 ,
,  хімічної реакції. Зробіть висновок щодо термодинамічної імовірності перебігу реакції за стандартних умов. Розрахунки провести за рівняннями реакцій, наведеними у таблиці 1, використовуючи довідкові дані, наведені у таблиці 2.
хімічної реакції. Зробіть висновок щодо термодинамічної імовірності перебігу реакції за стандартних умов. Розрахунки провести за рівняннями реакцій, наведеними у таблиці 1, використовуючи довідкові дані, наведені у таблиці 2.

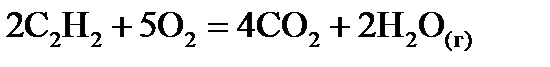
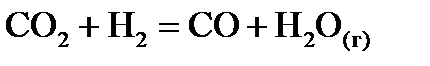


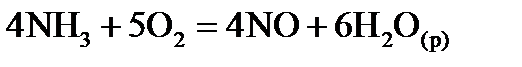

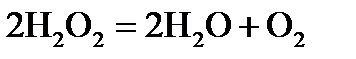
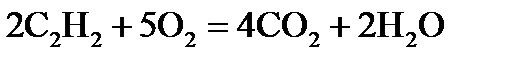

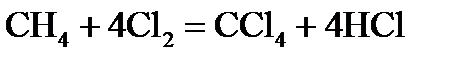
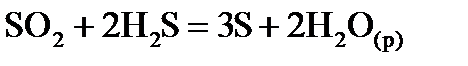
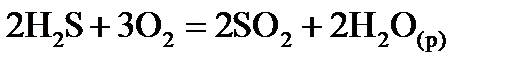
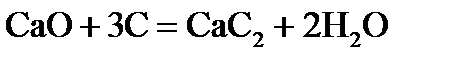


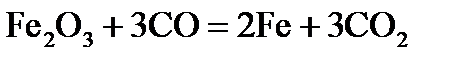

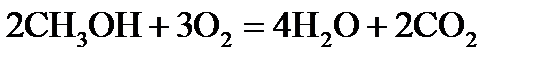


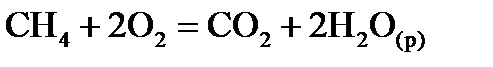

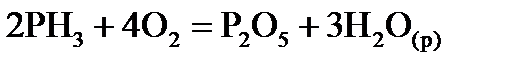

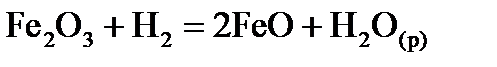
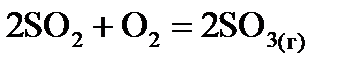


 , стандартні ентропії
, стандартні ентропії 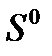 деяких неорганічних та органічних речовин при 298,15К٭
деяких неорганічних та органічних речовин при 298,15К٭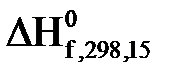 ,
кДж/моль
,
кДж/моль
 ,
Дж/(моль. К)
,
Дж/(моль. К)
 при названому значенні температурного коефіцієнта
при названому значенні температурного коефіцієнта  (табл. 3).
(табл. 3).
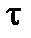 хвилин. Визначте час перебігу реакції при температурі 35 0С (табл. 4).
хвилин. Визначте час перебігу реакції при температурі 35 0С (табл. 4).
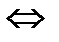 CO + CI2
CO + CI2
 CH3OH(г)
CH3OH(г)
 2SO3
2SO3
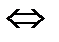 2NO +O2
2NO +O2



