
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
История возникновения сульфаниламидных препаратов.Содержание книги Поиск на нашем сайте Сульфаниламидные препараты. Родоначальник – бензолсульфокислота, но она не используется. Перед твоими глазами все сульфаниламиды (таблица нагло срисована с той, которую выдавала Татьяна Юрьевна):
История возникновения сульфаниламидных препаратов. Были впервые синтезированы Гелью в 1908 году. В 1935 году Домаж получил прантозил и выяснил, что он обладает противомикробной активностью. В конце 1935 года – Берефуэль доказл, что этим свойством обладает NH2SO2-Ar-N… группа. Известно что ПАБК обладает сходством по структуре с сульфаниламидами, что позволяет использовать их в качестве эффективных ингибиторов роста и дальнейшего развития микроорганизмов, т.е. они начинают усваивать сульфаниламиды и погибают (теория конкурентного антогонизма). В 1935 году в СССР под руководством академика Магидсона было впервые налажено получение белого и красного стрептоцида. Классификация сульфаниламидов. I. Химическая Если заместить первичную амино-группу на CH3COOH или другие – эффективность пропадает. Если перместить амино-группу в орто- или мета- положение – эффективность также пропадает. В амино-, как и в сульфо-группу можно вводить заместители:
R1 = -SO2- сульфанил R1 = -SO2-NH- сульфамидо R1 = -SO2-NH2 сульфамаил
1. Средства, имеющие в положении R1=H, в R2=различные алифатические заместители.
2. Производные, у которых R1=H, а в R2 у них гетероцикл.
3. Препараты в R1=амид, R2=гетероциклы
4. Средства имеющие азосоединение вместо NH2. Эти соединения являются пролонгированными версиями сульфаниламидов.
II. Фармакологическая Основана на способности сульфамидов выводиться из организма во времени:
Необходимо первые дозы приёма сульфаниламидов увеличить в 2 – 3 раза (ударная доза). Она необходима чтобы следующие дозы были поддерживающими. III. В зависимости от области применения: 1. На микроорганизмы лёгких. 2. На кишечник (фталазол). 3. Мочевыводящих путей (уросульфан). 4. Микрофлору глаз (сульфацил натрия). Сhloraminum В (Хлорамин Б)
N-хлорбензолсульфамид Na. Описание: Белый или слегка желтоватый кристаллический порошок со слабым запахом хлора. Растворимость: Растворим в воде (1:20), легко растворим в горячей воде или в воде при рН>7. Растворяется в спирте (1:25), образуя мутноватые растворы. Химические свойства:
NaClO +H2O à HClO + NaOH (pH > 7) 2HClO à 2HCl + O2 HClO + HCl à Cl2 + H2O На этом основана подлинность. То же будет и у пантоцида. Подлинность (все реакции подлинности даны из лекций): 1. С AgNO3 à AgCl↓ 2. На O2, Cl2↑ + KI à I2 (окрашивает хлороформный слой или крахмал в фиолетовый цвет). 3. Лакмусовая бумажка постепенно обесцвечивается – отбеливающий эффект. Количественное определение: 1. Добавляем HCl (для ускорения процесса). Потом KI. Препарат + KI à Cl2 + 2KI à I2 +2 KCl I2 + 2Na2S2O3 à 2NaI + Na2S4O6 f=1/2, Хранение: в хорошо укупоренных стеклянных банках в прохладном, защищенном от света месте. Применение: Действует как антисептическое и дезодорируюшее средство. Обладает также сперматоцидными свойствами. Pantocidum (Пантоцид)
N -дихлор-п-карбоксибензолсульфамид Описание: Белый порошок со слабым запахом хлора. Растворимость: Очень мало растворим в воде и разведенных кислотах; легко растворим в растворах едких и углекислых щелочей. Подлинность (все реакции подлинности даны из лекций): 1. С AgNO3 à AgCl↓ 2. На O2, Cl2↑ + KI à I2 (окрашивает хлороформный слой в фиолетовый слой или крахмал). 3. Лакмусовая бумажка постепенно обесцвечивается – отбеливающий эффект. 4. Прибавляют к препарату воды и щелочной раствор метилового красного. Жидкость окрашивается в красный цвет и далее обесцвечивается. Чистота: Общие допустимые примеси: мышьяк, сульфатная зола и тяжелые металлы. Количественное определение: 1. Добавляем HCl (для ускорения процесса). Потом KI. Препарат + KI à Cl2 + 2KI à I2 +2 KCl I2 + 2Na2S2O3 à 2NaI + Na2S4O6 T(Na2S2O3/Cl2)= Хранение: в хорошо укупоренной таре в прохладном, защищенном от света месте. Применение: Применяют главным образом для обеззараживания воды; может быть использован для дезинфекции рук (1 - 1,5 % растворы), спринцеваний и обработки ран (0,1 - 0,5 % растворы). Для обеззараживания воды применяют по 1 таблетке пантоцида на 0, 5 - 0, 75 л воды. Обеззараживание происходит в течение 15 мин. При сильном заражении воды, на тот же объем, количество таблеток увеличивают до 2. Вкус воды не изменяется. Форма выпуска: таблетки, содержащие 0,0082 г пантоцида, 0, 0036 г безводного натрия карбоната и 0,1082 г натрия хлорида. Каждая таблетка содержит 3 мг активного хлора. Алкилуреиды сульфокислот Butamidum Бутамид
N- (пара-Метилбензолсульфонил) –N’-н-бутилмочевина Описание: Белый кристаллический порошок без запаха или с очень слабым запахом, слегка горького вкуса. Растворимость: Практически нерастворим в воде, растворим в спирте, легко растворим в ацетоне и хлороформе, мало растворим в эфире. Подлинность: По ГФ10: 1. Образование бутиламина: к препарату прибавляют р. серную кислоту и кипятят, затем осторожно прибавляют NaOH (30%) на поверхности образуются жирные капли бутиламина имеющего характерный запах.
Далее: Na2CO3 + HCl à NaCl + CO2↑ + H2O CO2 + Ca(OH)2 à муть 2. Реакция на сульфат-ион после минерализации (с BaCl2 выпадает осадок). 3. Кислотный гидролиз: добавляют 30% кислоты и кипятят с обратным холодильником, получают:
NH4HSO4 + (NH3R)HSO4 + NaOH à NH3↑(посинение лакмуса) + NH2R (запах) Охлаждают, сушат. Температура плавления полученного п-толуолсульфамида 135-138о. 4. Осаждение в виде солей меди. 5. реакция со щелочью:
Чистота: 1. Потеря в массе при высушивании. 2. Температура плавления. 3. Величина удельного показателя поглощения. 4. Общие допустимые примеси: хлориды, сульфатная зола и тяжелые металлы. 5. Общие недопустимые: сульфаты. Количественное определение: 1. Титрование спиртовых растворов водной щёлочью. Индикатор: тимолфталеин. 2. Неводное титрование. Среда: диметилформамид. Индикатор: тимолфталеин. 3. Метод Кьельдаля (косвенная ацидиметрия). Применение: Является одним из основных представителей пероральных гипогликемизирующих производных сульфонилмочевины. Как и другие препараты этой группы, применяется в основном при сахарном диабете II типа. Назначают внутрь. Хранение: список Б. В хорошо укупоренной таре в сухом месте. Форма выпуска: таблетки по 0,25 и 0,5 г. Chlorpropamidum (Хлорпропамид).
N-(пара-хлорбензолсульфонил)–N’- пропилмочевина. Описание: Белый кристаллический порошок без запаха и вкуса. Растворимость: Практически нерастворим в воде, спирте, бензоле, ацетоне. Подлинность: 1. Нагревают препарат с NaOH, выделяющиеся пары окрашивают лакмусовую бумажку в синий цвет. 2. На сульфат-ион после минерализации (осадок с BaCl2). 3. С AgNO3 – осадок AgCl (отличие от батамида). 4. Кислотный гидролиз: добавляют 30% кислоты и кипятят с обратным холодильником, получают п-хлортолуолсульфамид, температура плавления 143-144о. Количественное определение: точно также как у Бутамида (см. выше). Хранение: список Б. В хорошо укупоренной таре. Применение: Сравнительно с бутамидом хлорпропамид более активен и оказывает сахаропонижающее действие в меньших дозах. Антибактериального эффекта не вызывает. Назначают внутрь. Форма выпуска: таблетки по 0,1 и 0,25 г. Bucarban (Букарбан)
N-(пара-Аминобензолсульфонил)-N'-н- бутилмочевина. Описание: Белый кристаллический порошок. Растворимость: Практически нерастворим в воде, растворим в спирте. Хранение: список Б. В защищенном от света месте. Применение: Оказывает более выраженное сахаропонижающее действие, чем бутамид, но несколько более токсичен. В связи с наличием в молекуле букарбана группы NH2 при бензольном ядре, что характерно для сульфаниламидных препаратов антибактериального действия, этот препарат может вызывать изменения микрофлоры кишечника и желудочно-кишечные нарушения. Кроме того, он чаще вызывает кожноаллергические явления и нарушения кроветворения. Показания к применению и дозы такие же, как для бутамида Форма выпуска: таблетки по 0,5 г в упаковке по 50 штук. Ciclamidum (Цикламид)
N-(4-метилил-фенилсульфонил)-N-циклогексил-мочевина. Glibenclamidum (Глибенкламид)
N- [4- [2-(5-Хлор-2-метоксибензамидо)-этил] -фенилсульфонил] -N-циклогексил-мочевина. Описание: Белый или белый с едва заметным кремоватым оттенком мелкокристаллический порошок. Растворимость: Практически нерастворим в воде, мало растворим в спирте. Количественное определение: Хранение: список Б. В защищенном от света месте. Применение: Подобно другим противодиабетическим производным сульфонилмочевины является стимулятором β-клеток поджелудочной железы. По сравнению с препаратами первого поколения (бутамид, хлорпропамид и др.) отличается большей активностью (эффект наступает при значительно меньших дозах), быстрой всасываемостью, относительно хорошей переносимостью. Форма выпуска: таблетки по 0, 005 г (5 мг) в упаковке по 20 штук. Производные нитрофурана
Подлинность: 1. В качестве групповой реакции на нитрофурановую группировку в молекулах данных соединений характерна реакция с растворами щелочей. Характер окраски зависит от строения заместителя в положении 2. У некоторых соединений она появляется лишь в сильно щелочной среде или при нагревании, у других – на холоду. Предполагают, что окраска обуславливается раскрытием фуранового цикла с образованием сильно окрашенного аниона:
2. Кроме того, для отличия одного препарат от другого рекомендуется реакция со спиртовым раствором щелочи в различных органических растворителях. Чаще всего берут ацетон или диметилформамид, в которых нитрофураны очень хорошо растворяются. В зависимости от концентрации испытуемого препарата в органическом растворителе и количества добавляемой щелочи окраски меняются в соответствии с характером каждого препарата. 3. Также групповая реакция – это образование аммиака при обработке их щелочных растворов цинковой пылью.
Na2CO3 + HCl àCO2 N2H4 + N,N-диэтиламинобензальдегид à азокраситель (красный в H+). 4. Реакция серебряного зеркала. 2[Ag(NH3)2]OH + восстановленная форма 5. С реактивом Фелинга: Реактив – смесь равных объемов раствора Фелинга 1 (CuSO4 + следов. H2SO4 – прозрачная жидкость голубоватого цвета) и раствора Фелинга 2 (сеньетова соль – тартрат калия натрия в растворе щелочи). Собственно реактив Фелинга – прозрачная жидкость ярко-синего цвета, комплекс соли меди (нижеприведенная формула – по Ильиной Татьяне Юрьевне; Трусов же Сергей Николаевич представляет себе комплекс меди с калия натрия татртратом несколько иначе – по его мнению, медь связывается по спиртовым гидроксилам только лишь с одной молекулой винной кислоты).
При добавлении альдегида и кипячении на водяной бане, выпадает осадок красно-бурого цвета. Альдегид + комплекс Фелинга + KOH + 3NaOH 2CuOH à Cu2O + H2O Гидроксид меди 1 – желтоватого цвета, очень неустойчив и быстро разлагается до кирпично-красного оксида. 6. С реактивом Несслера: RCHO + K2[HgI4] + 3KOH à Hg¯ + RCOOK + 4KI + 2H2O 7. В качестве специфичных реакций для препаратов нитрофуранового ряда можно использовать их способность образовывать в водных растворах окрашенные или малорастворимые комплексы с солями тяжелых металлов: СuSO4, AgNO3, Co(NO)2 и др. 9. Можно использовать различные виды хроматографии и по значению Rf характеризовать каждый из препаратов. Количественное определение: 1. Поскольку все препараты нитрофуранового ряда дают окрашенные растворы с растворами щелочей, в качестве общего метода из количественного определения можно применить колориметрические метода. Для этой цели из точной навески препарата готовят раствор, обрабатывают его 1н. раствором щелочи и через некоторое время измеряют оптическую плотность раствора на фотоэлектроколориметре. В тех же условиях определяют удельный показатель поглощения стандартного образца препарата и затем рассчитывают процентное содержание препарата по соответствующей формуле. Таким методом ГФ10 рекомендует определять фурадонин и фуразолидон (ГФ10 стр. 322). 2. Для препаратов имеющих в своей молекуле гидразиновую группировку, способную окисляться, рекомендуется йодометрический метод (например, фурацилин). Обратная йодометрия в щелочной среде. Выделяется NH2-NH2, реагирует с I2/OH- I2 + 2NaOH à NaI + NaIO + H2O 2NaIO + N2H4 à N2 +NaI + 2H2O NaI +NaIOизб + H2SO4 + H20 à I2 + Na2SO4 + H2O f=1/4. Аналогично для подобных препаратов можно применить и броматометрический метод. 3. По удельному показателю поглощения Е. 4. По стандартным растворам. 5. Методами хроматографии (ТСХ). Применение: бактерицидные свойства широкого спектра действия фурацилин 1:5000 – полоскания промывание гнойных ран. Хранение: в хорошо укупоренных банках из тёмного стекал, в прохладном, защищенном от света месте. По списку Б. Furacilinum – Фурацилин.
5-Нитрофурфурола семикарбазон. Описание: Желтый или зеленовато-желтый мелкокристаллический порошок горький на вкус. Растворимость: Очень мало растворим в воде, мало - в спирте, растворим в щелочах. Подлинность: Фурацилин дает все реакции, характерные для препаратов нитрофуранового ряда (см. выше). Для фурацилина описана реакция (нефармакопейная), отличающая его от всех других препаратов нитрофуранового ряда – это реакция с резорцином в солянокислой среде. При нагревании реакционной смеси и последующем подщелачивании наблюдается флуоресценция, которая усиливается при добавлении изоамилового спирта (химизм не надо). Количественное определение: Методом обратной йодометрии: навеску препарата растворяют воде при нагревании на водяной бане. Для лучшей растворимости добавляют натрия хлорид. Затем к определенному количеству данного раствора добавляют избыток титрованного раствора йода и 0,1 мл раствора NaOH. Происходит окислительный распад гидразиновой группы до азота:
В щелочной среде йод может реагировать со щёлочью и давать гипойодиды: I2 + 2NaOH à NaI + NaIO + H2O При добавлении серной кислоты выделяется йод, который вместе со взятым избытком титрованного раствора I2 оттитровывается тиосульфатом натрия: NaI +NaIO + H2SO4 à I2 + Na2SO4 + H2O I2 + 2Na2S2O3à 2NaI + Na2S4O6 Примеси: ГФ10 допускает: хлориды, сульфаты, тяжелые металлы, и мышьяк в пределах эталона. В препарате может быть примесь семикарбазида, которая определяется с раствором Фелинга. Поскольку эта примесь недопустимая в препарате, то при добавлении реактива Фелинга и нагревании не должен выпадать красный осадок закиси меди. Хранение: список Б. В хорошо укупоренных банках темного стекла в прохладном, защищенном от света месте. Применение: Назначают наружно для лечения и предупреждения гнойно-воспалительных процессов и внутрь для лечения бактериальной дизентерии. Форма выпуска: порошок; таблетки по 0,1 г для приема внутрь и по 0,02 г для - приготовления раствора (для наружного применения), 0,2 % мазь. Furadoninum (Фурадонин)
N- (5-Нитро-2-фурфурилиден)-1-аминогидантоин. Описание: Желтый или оранжево-желтый кристаллический порошок, горький на вкус. Растворимость: Практически нерастворим в воде и спирте. Подлинность: 1. С раствором щёлочи наблюдается темно-красное окрашивание. 2. При растворении препарата в свежеприготовленном растворе диметилформамида появляется жёлтое окрашивание, которое при добавлении 2 капель 1 н. спиртового раствора КОН переходит в коричнево-жёлтое. Количественное определение: По ГФ10 определяют фотоэлектроколориметрически (ГФ10 стр.322). Хранение: в сухом, защищенном от света месте. Применение: Препарат эффективен при лечении инфекционных заболеваний мочевых путей. Показания: пиелит, пиелонефрит, цистит, уретрит. Его применяют также для предупреждения инфекций при урологических операциях, цистоскопии, катетеризации и т.п. Форма выпуска: таблетки по 0,05 г, таблетки фурадонина, растворимые в кишечнике, по 0,1 г таблетки желтого цвета с оранжеватым или зеленоватым оттенком с риской; таблетки, растворимые в кишечнике, по 0,03 г для детей. Furazolidonum (Фуразолидон)
N - (5- Нитро-2-фурфурилиден) - 3-аминооксазолидон-2. Описание: Желтый или зеленовато-желтый порошок, без запаха, слабогорький на вкус. Растворимость: Практически нерастворим в воде, очень мало - в спирте. Подлинность: 1. При нагревании с раствором щёлочи наблюдается бурое окрашивание, что связано с наличием в молекуле фуразолидона легкогидролизуемого оксазолидонового цикла. Добавление щёлочи приводит к разрыву кольца с образованием растворимого в воде окрашенного соединения:
2. При растворении препарата в орг. растворителях и добавлении спиртового раствора щёлочи появляется фиолетовое окрашивание. При изменении концентрации окраска меняется. Количественное определение: ГФ10 предписывает использовать метод фотоколориметрии (ГФ10 стр.322). Хранение: список Б. В сухом, защищенном от света месте. Применение: Эффективен в отношении грамположительных и грамотрицательных бактерий. Кроме того, обладает противотрихомонадной активностью. Препарат также эффективен при лямблиозе. Из возбудителей кишечных инфекций наиболее чувствительны к фуразолидону возбудители дизентерии, брюшного тифа и паратифов. Относительно слабо влияет на возбудителей гнойной и анаэробной инфекций. Одной из положительных особенностей фуразолидона является то, что устойчивость к нему микроорганизмов развивается медленно. Форма выпуска: таблетки по 0,05 г в упаковке по 20 штук. Furaginum (Фурагин) N-(5-Нитро-2-фурил)-аллилиденаминогидантоин.
Описание: Желтый или оранжево-желтый мелкокристаллический порошок, без запаха, горький на вкус. Растворимость: Практически нерастворим в воде и спирте. Хранение: список Б. В сухом, защищенном от света месте. Применение: Применяют внутрь и местно. Внутрь назначают главным образом при заболеваниях мочевых путей (острые и хронические пиелонефриты, циститы, уретриты, инфекции после оперативных вмешательств на органах мочеполовой системы и др.). Форма выпуска: порошок; таблетки по 0, 05 г в упаковке по 100 штук. Antipyrinum (Антипирин) 1-Фенил-2, 3-диметилпиразолон-5.
Получение: Синтез антипирина был осуществлен впервые Кнорром в 1883 г. Сырьём служат: фенилгидразин и ацетоуксусный эфир (реакция Кляйзена).
Реакцию ведут в нейтральной среде, т.к. в кислой фенилгидразин вступает в рекацию в другой таутомерной форме, в результате чего при циклизации получается побочный продукт снижающий выход и качество основного продукта – антипирина. Щелочная среда также непригодна, т.к. в этом случае образуется сильное осмоление. Полученный фенилметилпиразолон метилируют, затем обрабатывают щёлочью и выделяют свободный антипирин:
Описание: Бесцветные кристаллы или белый кристаллический порошок без запаха, слабогорького вкуса. Температура плавления = 110 – 113°С. Растворимость: Очень легко растворим в воде (1:1), легко - в спирте, хлороформе, трудно растворим в эфире. Подлинность: 1. Нитрозирование – образование нитрозоантипирина (изумрудно-зелёного цвета):
2. С FeCl3 – интенсивно красное окрашивание (у Татьяны Юрьевны в лекциях – коричневое), обусловленное образованием комплексной соли феррипирина: 3C11H12ON2•2FeCl3. Нефармакопейная: 1. (В ГФ10 нет, но в лекциях отнесена к фармакопейным) Образование фиолетово-красного пиразолонового красителя (в отличие от амидопирина). Для этой цели сначала нитрозируем антипирин в присутствии уксусной кислоты (см. реакцию выше, вместо HCl тут будет уксусная кислота). Избыток HNO2 разрушают азидом натрия, после чего вводят α-нафтиламин – образуется азокраситель:
реакция является специфичной для антипирина! 2. Обрабатываем разбавленный раствор антипирина конц. раствором 2-нитроиндандиона в результате образуется оранжевая окраска, исчезающая при добавлении аммиака. Эта реакция специфична для антипирина.
Чистота: 1. Температура плавления = 110 – 113°С. 2. Прозрачность и цветность. 3. Общие допустимые примеси: хлориды, сульфатная зола, органические примеси. 4. Специфические недопустимые: бензосульфонат натрия – раствор в 10 мл дихлорэтана должен быть бесцветным и прозрачным. Количественное определение: Используют обратную йодометрию в слабокислой среде:
I2 + 2Na2S2O3 à 2NaI + Na2S4O6 HI + CH3COONa -> NaI + СН3СООН Реакцию ведут в присутствии ацетата натрия, чтобы связать выделяющийся HI и предотвратить обратимость процесса. Образующийся в процессе реакции йодопирин может адсорбировать на своей поверхности некоторое количество йода, поэтому добавляют спирт или хлороформ, которые растворяют образующийся йодопирин. Нефармакопейные: 1. Броматометрия в кислой среде:
2. Йодхлорметрия:
Хранение: список Б. В хорошо укупоренной таре, предохраняющей от действия света. Применение: Как и другие производные пиразолона, антипирин оказывает болеутоляющее, жаропонижающее и в той или иной степени противовоспалительное действие. По анальгезирующей и жаропонижающей активности препараты этой группы близки к производным салициловой кислоты. Производные пиразолона уменьшают проницаемость капилляров и препятствуют развитию воспалительной реакции. Форма выпуска: порошок и таблетки по 0,25 г. Amidopyrinum (Амидопирин)
1 -Фенил-2, 3-диметил-4-диметиламино-пиразолон-5. Получение: Сначала получают нитрозопирин (по реакциям получения антипирина), затем его восстанавливают и получают аминопирин, который метилируют и получают амидопирин:
Описание: Белые кристаллы или белый кристаллический порошок без запаха, слабогорького вкуса. Растворимость: Медленно растворим в воде (1:20), растворим в спирте, очень легко растворим в хлороформе. Подлинность: 1. + FeCl3 à сине-фиолетовое окрашивание, не исчезающее от добавления минеральной кислоты (отличие от анальгина). 2. + AgNO3 à вначале появляется сине-фиолетовое окрашивание, затем выпадает серый осадок восстановленного серебра. 3. При прибавлении K3Fe(CN)6 в кислой среде, а затем FeCl3 – синее окрашивание вследствие образования берлинской лазури:
H4Fe[(CN)6]3 + 4FeCl3 à Fe4[Fe(CN)6]3 + 12HCl Чистота: 1. Температура плавления. 2. Прозрачность и цветность. 3. Общая недопустимая примесь: хлориды. 4. Общая допустимая примесь: сульфатная зола и тяжелые металлы. Специфическая допустимая в пределах эталона – аминоантипирин, который можно обнаружить по помутнению водного раствора препарата при добавлении раствора бензальдегида:
Количественное определение: ГФ10 рекомендует метод кислотно-основного титрования в неводных средах. Амидопирин как слабое основание титруется в ледяной уксусной кислоте хлорной кислотой:
Индикатор тропеолин-ОО в точке эквивалентности наблюдается ярко-фиолетовое окрашивание. Параллельно проводим контрольный опыт. f=1/2. Хранение: список Б. В защищенном от света месте. Применение: Оказывает жаропонижающее, болеутоляющее и противовоспалительное действие. По фармакологическим свойствам амидопирин близок к антипирину, но активнее его. Применяют при головной боли, невралгиях, артритах, миозитах, хорее, иногда при остром суставном ревматизме. Форма выпуска: порошок; таблетки по 0,25 г и таблетки, содержащие амидопирина 0,25 г и кофеин-бензоата натрия 0,1 г. Analginum (Анальгин)
1-Фенил-2, 3-диметил-4-метиламинопиразолон-5-N-метансульфонат натрия. Получение: Аминоантипирин обрабатывают бензальдегидом. Полученный бензилиденаминоантипирин метилируют диметилсульфатом, в результате получают монометиламиноантипирин. При обработке монометиламиноантипирина смесью водных растворов формальдегида и бисульфита натрия получается анальгин:
Описание: Белый или белый с едва заметным желтоватым оттенком крупноигольчатый, кристаллический порошок без запаха. В присутствии влаги быстро разлагается. Водные растворы при стоянии желтеют. Растворимость: Легко растворим в воде (1: 1,5), трудно - в спирте, нерастворим в эфире, хлороформе и ацетоне. Подлинность: 1. Реакция на Na+. 2. При нагревании с минеральными кислотами анальгин выделяет сернистый газ и формальдегид, определяют по запаху: R-N(CH3)CH2SO3Na + HCl При добавление к подкисленному раствору препарата в спиртовой среде йодата калия наблюдается малиновое окрашивание (промежуточные продукты окисления). При дальнейшем добавлении реактива окраска усиливается и выделяется бурый осадок (I2): 5SO2 + 2KIO3 à I2 + K2SO4 + 4SO3 Чистота: 1. Прозрачность раствора. 2. Кислотность и щёлочность. 3. Потеря в массе при высушивании. 4. Общие допустимые примеси: тяжелые металлы, As. 5. Специфическая недопустимая: аминоантипирин (см. выше). Количественное определение: Методом прямой йодометрии в слабокислой среде: | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
| Поделиться: |
















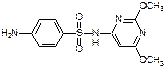








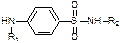







 f=1/2
f=1/2




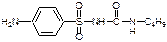


 этиленоксид
этиленоксид
 этиленсульфид
этиленсульфид
 этиленимин
этиленимин
 фуран
фуран
 тиофен
тиофен
 пиррол
пиррол
 пиразол
пиразол
 имидазол
имидазол
 1,3-тиазол
1,3-тиазол
 тиазолидин
тиазолидин
 оксазол-1,3
оксазол-1,3
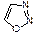 1,2,3-оксадиазол
1,2,3-оксадиазол
 1,3,7-тиадиазол
1,3,7-тиадиазол
 1,2,4-тиадиазол
1,2,4-тиадиазол
 1,2,3,4-тетразол
1,2,3,4-тетразол
 α-пиран
α-пиран
 g-пиран
g-пиран
 тетра-гидропиран
тетра-гидропиран
 пиридин
пиридин
 пиперидин
пиперидин
 пиридазин
пиридазин
 пиримидин
пиримидин
 пиразин
пиразин
 пиперазин
пиперазин
 1,3,5-триазин
1,3,5-триазин
 диоксин
диоксин
 тиазин
тиазин
 оксазин
оксазин
 морфолин
морфолин
 азепин
азепин
 1,2-диазепин
1,2-диазепин


 2Ag¯ + окисленная форма-NH4+ + 3NH3 + H2O
2Ag¯ + окисленная форма-NH4+ + 3NH3 + H2O
 CuOH + кислая Калиевая соль винной кислоты + кислая Натриевая соль винной кислоты + кислота из альдегида + 2H2O
CuOH + кислая Калиевая соль винной кислоты + кислая Натриевая соль винной кислоты + кислота из альдегида + 2H2O
























