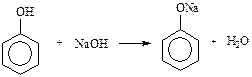Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
ІІ. Ненасичені вуглеводні етиленового рядуСодержание книги
Поиск на нашем сайте
Лабораторна робота №2. Одержання етилену і вивчення його властивостей
У пробірку з газовідвідною трубкою наливають 3-4 мл заздалегідь приготовленої суміші (1 об’єм етанолу і 3 об’єми концентрованої сірчаної кислоти). Суміш нагрівають, вона чорніє, виділяється етилен, з можливими домішками SO2 і CO2 (дослід проводити у витяжній шафі!). При взаємодії етанолу з концентрованою сірчаною кислотою утворюється етилсірчана кислота:
Етилсірчана кислота при нагріванні розкладається з утворенням етилену і сірчаної кислоти:
Далі вивчають окиснення, приєднання і горіння етилену, що утворився. Приєднання брому (виявлення наявності подвійного зв’язку). Етилен пропускають за допомогою газовідвідної трубки в пробірку з бромною водою. Колір бромної води зникає внаслідок приєднання брому по подвійному зв’язку за реакцією:
Проба на окиснення KMnO4 (реакція Є.Є. Вагнера). Етилен пропускають в пробірку, наповнену слабким розчином перманганату калію, підлуженим розчином соди. При цьому фіолетовий колір зникає і утворюється етиленгліколь:
Завдання: Занотуйте в протокол результати спостережень реакцій окиснення, приєднання та горіння.
ІІІ. Спирти Лабораторна робота №3. а) Відкриття води в етанолі В пробірці нагрівають до кипіння 2-3 мл етанолу і близько 0,5 г зневодненого мідного купоросу. При наявності води в спирті білий порошок сульфату міді забарвлюється в блакитний колір.
В звичайному етиловому спирті – ректифікаті міститься біля 5% води. Цю воду не можна відділити дробною перегонкою, бо вона утворює зі спиртом так звану азеотропну суміш. Азеотропні суміші двох рідин не розділюються перегонкою тому, що склад рідин і склад парів в цьому випадку однакові. Для розділу такої суміші потрібно один з її компонентів зв’язати хімічно. Зневоднений мідний купорос приєднує до себе воду, що є в спирті, і переходить в кристалогідрат:
б) Окиснення етанолу хромовою сумішшю У пробірці змішують 2 мл розчину біхромату калію, 1 мл розведеної сірчаної кислоти і 0,5 мл етанолу. Обережно нагрівають суміш. При цьому хром з шестивалентного відновлюється до тривалентного, а спирт окиснюється в оцтовий альдегід, який можна виявити за характерним різким запахом:
в) Одержання гліцерату міді У пробірку наливають 1 мл 3 % - вого розчину сульфату міді і додають 2 мл 10 % - вого розчину їдкого натру. Випадає блакитний осад гідрооксиду міді. До цієї суміші приливають 5-10 краплин гліцерину, осад розчиняється, а рідина забарвлюється у синьо-фіолетовий колір.
Багатоатомні спирти мають більш сильні кислотні властивості, ніж одноатомні спирти. Тому багатоатомні спирти утворюють алкоголяти не тільки при дії лужних металів, але, також, при дії гідрооксидів металів. Завдання: Занотуйте в протокол результати спостережень реакцій. ІV. Феноли Лабораторна робота №4. а) Реакція фенолів з хлорним залізом В окремі пробірки наливають по 1-2 мл 1%- вих розчинів фенолу, резорцину, гідрохінону, пірогалолу, α- та β-нафтолу (наведіть хімічні формули перерахованих сполук). В кожну пробірку додають по 2-3 краплі розчину хлориду заліза. Розчини фенолу і резорцину забарвлюються в фіолетовий колір, розчин пірогалолу – в буро-червоний. Розчин гідрохінону спочатку зеленіє, але потім дуже швидко стає бурим. Розчин α-нафтолу забарвлюється спочатку у рожевий колір, а при нагріванні з’являється темно-фіолетовий осад. Розчин β-нафтолу забарвлюється в темно-синій колір. Забарвлення розчинів виникає внаслідок утворення сильно дисоційованих комплексних фенолів трьохвалентного заліза за такою реакцією:
б) Утворення і розклад феноляту натрію В пробірку поміщають 0,2 г фенолу, додають 2 мл води і збовтують. Утворюється емульсія. До неї по краплях додають розведений розчин їдкого натру. Рідина в пробірці стає більш прозорою, тому що утворюється фенолят натрію, який добре розчиняється у воді. При підкисленні розведеною сірчаною кислотою розчин мутніє та знов утворюється емульсія. Виявляючи кислотні властивості, феноли при взаємодії з водним лугом утворюють феноляти:
Більшість фенолятів добре розчиняються у воді і не розкладаються нею. При дії кислот з розчинів фенолятів виділяються вільні феноли:
в) Дія бромної води на фенол В пробірку наливають 1 мл водного розчину фенолу і по краплях додають бромну воду до появи білого осаду. Бромування фенолу в водному розчині відбувається надзвичайно легко.
Завдання: Занотуйте в протокол результати спостережень реакцій.
V. Альдегіди та кетони Лабораторна робота №5.
|
||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 289; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.202.60 (0.006 с.) |