
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Назначение и принцип действия фотометра фотоэлектрического КФК - 3Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Анализ водных растворов Колориметрическим методом
Цель работы - определение концентрации веществ колориметрическим методом. I. ТЕРМИНЫ И ОПРЕДЕЛЕНИЯ
Стандартный раствор (ср) - это раствор, содержащий в единице объема определенное количество исследуемого вещества или его химико-аналитического эквивалента (ГОСТ 12.1.016 - 79).
Исследуемый раствор (ир ) - это раствор, в котором необходимо определить содержание исследуемого вещества или его химико-аналитического эквивалента (ГОСТ 12.1.016 - 79).
Градуировочный график - графическое выражение зависимости оптической плотности сигнала от концентрации исследуемого вещества (ГОСТ 12.1.016 - 79).
Предельно допустимая концентрация (ПДК ) вредного вещества - это концентрация, которая при ежедневной (кроме выходных дней) работе по 8 часов или при другой продолжительности рабочего дня, но не более 40 часов в неделю в течение всего рабочего стажа не может вызвать заболеваний или отклонений в состоянии здоровья, обнаруживаемых современными методами исследований, в процессе работы или в отдаленные сроки жизни настоящего или последующих поколений (ГОСТ 12.1.016 - 79).
Колориметрия - это метод количественного анализа содержания какого либо иона в прозрачном растворе, основанный на измерении интенсивности его окраски.
II. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Колориметрический метод анализа основан на связи двух величин: концентрации раствора и его оптической плотности (степени окрашенности). Окраска раствора может быть вызвана как присутствием самого иона (MnO4-,Cr2O72- ), так и образованием окрашенного соединения в результате химического взаимодействия исследуемого иона с реактивом. Например, слабоокрашенный ион Fe3 + дает кроваво-красное соединение при взаимодействии с ионами роданида SCH-, ион меди Cu2+ образует ярко-синий комплексный ион [Cu(NH3)4 ]2 + при взаимодействии с водным раствором аммиака. Окраска раствора обусловлена избирательным поглощением лучей света определенной длины волны: окрашенный раствор поглощает те лучи, длина волны которых соответствует дополнительному цвету. Например: дополнительными называют сине-зеленый и красный цвета, синий и желтый. Раствор роданида железа кажется красным, потому что он поглощает преимущественно зеленые лучи (l» 5000 Á) и пропускает красные; напротив, раствор зеленой окраски пропускает зеленые лучи и поглощает красные. Колориметрический метод анализа основан на способности окрашенных растворов поглощать свет в диапазоне волн от ультрафиолетового до инфракрасного. Поглощение зависит от свойств вещества и его концентрации. При этом методе анализа исследуемое вещество входит в состав водного раствора, поглощающего свет, а его количество определяется по световому потоку, прошедшему через раствор. Эти измерения проводятся при помощи фотоколориметров. Действие этих приборов основано на изменении интенсивности светового потока при прохождении через раствор в зависимости от толщины слоя, степени окраски и концентрации. Мерой концентрации является оптическая плотность (D). Чем выше концентрация вещества в растворе, тем больше оптическая плотность раствора и меньше его светопроницаемость Оптическая плотность окрашенного раствора прямо пропорциональна концентрации вещества в растворе. Она должна измеряться при длине волны, на которой исследуемое вещество имеет максимальное светопоглощение. Это достигается подбором светофильтров и кювет для раствора. Предварительный выбор кювет производят визуально соответственно интенсивности окраски раствора. Если раствор интенсивно окрашен (темный), пользуются кюветами с малой рабочей длиной волны. В случае слабо окрашенных растворов рекомендуются кюветы с большей длиной волны. В предварительно подобранную кювету наливают раствор, измеряют его оптическую плотность, включив в ход лучей светофильтр. При измерении ряда растворов кювету заполняют раствором средней концентрации. Если полученное значение оптической плотности составляет примерно 0,3-0,5, данную кювету выбирают для работы с этим раствором. Если оптическая плотность больше 0,5-0,6, берут кювету с меньшей рабочей длиной, если оптическая плотность меньше 0,2-0,3, выбирают кювету с большей рабочей длиной волны. На точность измерений большое влияние оказывает чистота рабочих граней кювет. Во время работы кюветы берут руками только за нерабочие грани, а после заполнения раствором внимательно следят за отсутствием на стенках кювет даже мельчайших пузырьков воздуха.
Согласно закону Бугера-Ламберта-Бэра, доля поглощенного света зависит от толщины слоя раствора h, концентрации раствора C и интенсивности падающего света I0
где I I h - толщина слоя раствора; C - концентрация раствора;
Логарифмируя это выражение, получаем:
где D - оптическая плотность раствора, является постоянной величиной для каждого вещества.
Оптическая плотность D характеризует способность раствора поглощать свет. Если раствор совсем не поглощает свет, то D = 0 и It =I Если раствор поглощает лучи света полностью, то D равняется бесконечности и I Если раствор поглощает 90 % падающего света, то D = 1 и It =0,1, так как выражение (2) равно единице. При точных колориметрических расчетах изменение оптической плотности не должно выходить за интервал 0,1 - 1. Для двух растворов различной толщины слоев и концентрации, но одинаковой оптической плотности можно записать: D = h1 C1
откуда
Для двух растворов одинаковой толщины, но разной концентрации можно написать:
D1 = h1 C1
откуда
Как видно из выражений (3) и (4), практически для определения концентрации раствора колориметрическим методом необходимо иметь стандартный раствор, то есть раствор с известными параметрами (C, D). Определение можно проводить по-разному: 1. Можно уравнять оптические плотности исследуемого и стандартного растворов, изменяя их концентрацию или толщину слоя раствора; 2. Можно измерить оптическую плотность этих растворов и рассчитать искомую концентрацию по выражению (4). Для реализации первого метода применяют специальные приборы - колориметры. Они основаны на визуальной оценке интенсивности проходящего света и поэтому их точность сравнительно невелика. Второй метод - измерения оптической плотности - осуществляется с помощью значительно более точных приборов - фотоколориметров и спектрофотометров и именно он используется в данной лабораторной работе. При работе на фотоколориметре чаще используют прием построения градуировочного графика: измеряют оптическую плотность нескольких стандартных растворов и строят график в координатах D = f(C). Затем измеряют оптическую плотность исследуемого раствора и по градуировочному графику определяют искомую концентрацию. Уравнение Бугера - Ламберта - Бэра справедливо только для монохроматического света, поэтому точные колориметрические измерения проводят с применением светофильтров - цветных пластинок, пропускающих лучи света в определенном диапазоне длин волн. Для работы выбирают светофильтр, который обеспечивает максимальную оптическую плотность раствора. Светофильтры, установленные на фотоколориметр, пропускают лучи не строго определенной длины волны, а в некотором ограниченном диапазоне. Вследствие этого погрешность измерений на фотоколориметре не более ±3 % от веса анализируемого вещества. Строго монохроматический свет применяется в специальных приборах - спектрофотометрах, у которых точность измерений выше. Точность колориметрических измерений зависит от концентрации раствора, наличия примесей, температуры, кислотности среды раствора, времени определения. Этим методом можно анализировать только разбавленные растворы, то есть такие, для которых зависимость D = f(C) - прямая. При анализе концентрированных растворов их предварительно разбавляют, а при расчете искомой концентрации вносят поправку на разведение. Однако точность измерений при этом понижается. Примеси могут влиять на точность измерений тем, что сами дают окрашенное соединение с добавляемым реактивом или затрудняют образование окрашенного соединения исследуемого иона. Метод колориметрического анализа в настоящее время применяется для проведения анализов в различных областях науки. Он позволяет точно и быстро проводить измерения, используя ничтожно малые количества вещества, недостаточные для объемного или весового анализа.
Таблица 1
ПРИЛОЖЕНИЕ 1. ЖЕЛЕЗО МЕДЬ СУЛЬФАТЫ Варианты заданий
Приложение 3 (для лаборанта) Растворы для выпонения вариантов лабораторной работы готовятся перед началом занятия в соответствии с приведенными таблицами. ВАРИАНТ 1
В предложенном растворе определить концентрацию иона Fe3+ и сделать вывод о соответствии ее с ПДК.
Анализ проводится согласно ГОСТ 4011-72. Вода питьевая. Методы измерения массовой концентрации общего железа.
Приборы и реактивы:
· прибор КФК - 3; · светофильтр синий l = 430 нм; · кюветы с толщиной слоя 50 мм; · колбы с стандартным и исследуемым раствором; · колбы для приготовления исследуемых растворов; · колба для слива растворов;
* сульфат железа Fe2(SO4); * роданид калия KSCN; * дистиллированная вода H2O.
Таблица 2
ВАРИАНТ 2 В предложенном растворе определить концентрацию иона Cu2+ диэтилдитиокарбаматом натрия и сделать вывод о соответствии ее ПДК. Анализ проводится согласно ГОСТ 4388-72. Вода питьевая. Методы определения массовой концентрации меди.
Приборы и реактивы:
· прибор КФК - 3; · светофильтр синий l = 430 нм; · кюветы с толщиной слоя 50 мм; · колбы с стандартным и исследуемым раствором; · колбы для приготовления исследуемых растворов; · колба для слива растворов; · сернокислая медь CuSO4 х 5H2O р-р 5%; · дистиллированная вода H2O; · соляная кислота HCl р-р1:1; · сегнетова соль KNaC4H4O6 х 4H2O, р-р 50%; · раствор аммиака 25%; · раствор крахмала 0,25%; · раствор диэтилдитиокарбамата натрия 5%. Таблица 3
ВАРИАНТ 3 В предложенном растворе определить концентрацию иона Cu2 + с реагентом пикрамин-эпсилон, сделать вывод о соответствии ее ПДК.
Приборы и реактивы:
· прибор КФК - 3; · светофильтр зеленый l = 540 - 550 нм; · кюветы с толщиной слоя 20 мм; · колбы со стандартным и исследуемым раствором; · колбы для приготовления исследуемых растворов; · колба для слива растворов;
· сернокислая медь CuSO4.5H2O; · дистиллированная вода H2O; · соляная кислота HCl; · раствор пикрамин-эпсилон; · раствор аскорбиновой кислоты.
Таблица 4
Вариант 4
В предложенном растворе определить концентрацию сульфатов (SO2)4- и сделать вывод о соответствии ее ПДК.
Приборы и реактивы: · прибор КФК - 3; · светофильтр синий l = 400 нм; · кюветы с толщиной слоя 50 мм; · колбы со стандартным и исследуемым раствором; · колбы для приготовления исследуемых растворов; · колба для слива растворов.
· соляная кислота HCl; · осадительная смесь: · хлористый барий; · дистиллированная вода; · стандартный раствор сульфатов. Таблица 5
Для приготовления каждого раствора смешиваются в колбе все компоненты и доводятся до объема 100 мл дистиллированной водой.
БиБЛИОГРАФИЧЕСКИЙ СПИСОК
Бронштейн Д.Л., Александров Н.Н. Современные средства измерения загрязнений атмосферы, - Л.: Гидрометеоиздат, 1989
Охрана окружающей среды: Учебн.// Под ред. Белова С.В .- М.:Высш.шк., 1991
ГОСТ 12.1.016 - 79. ССБТ. Воздух рабочей зоны. Требования к методам измерений концентраций вредных веществ.
ГОСТ 4011 - 72. Вода питьевая. Методы измерения массовой концентрации общего железа. ГОСТ 4011 - 72. Вода питьевая. Методы измерения массовой концентрации меди. Анализ водных растворов Колориметрическим методом
Цель работы - определение концентрации веществ колориметрическим методом. I. ТЕРМИНЫ И ОПРЕДЕЛЕНИЯ
Стандартный раствор (ср) - это раствор, содержащий в единице объема определенное количество исследуемого вещества или его химико-аналитического эквивалента (ГОСТ 12.1.016 - 79).
Исследуемый раствор (ир ) - это раствор, в котором необходимо определить содержание исследуемого вещества или его химико-аналитического эквивалента (ГОСТ 12.1.016 - 79).
Градуировочный график - графическое выражение зависимости оптической плотности сигнала от концентрации исследуемого вещества (ГОСТ 12.1.016 - 79).
Предельно допустимая концентрация (ПДК ) вредного вещества - это концентрация, которая при ежедневной (кроме выходных дней) работе по 8 часов или при другой продолжительности рабочего дня, но не более 40 часов в неделю в течение всего рабочего стажа не может вызвать заболеваний или отклонений в состоянии здоровья, обнаруживаемых современными методами исследований, в процессе работы или в отдаленные сроки жизни настоящего или последующих поколений (ГОСТ 12.1.016 - 79).
Колориметрия - это метод количественного анализа содержания какого либо иона в прозрачном растворе, основанный на измерении интенсивности его окраски.
II. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Колориметрический метод анализа основан на связи двух величин: концентрации раствора и его оптической плотности (степени окрашенности). Окраска раствора может быть вызвана как присутствием самого иона (MnO4-,Cr2O72- ), так и образованием окрашенного соединения в результате химического взаимодействия исследуемого иона с реактивом. Например, слабоокрашенный ион Fe3 + дает кроваво-красное соединение при взаимодействии с ионами роданида SCH-, ион меди Cu2+ образует ярко-синий комплексный ион [Cu(NH3)4 ]2 + при взаимодействии с водным раствором аммиака. Окраска раствора обусловлена избирательным поглощением лучей света определенной длины волны: окрашенный раствор поглощает те лучи, длина волны которых соответствует дополнительному цвету. Например: дополнительными называют сине-зеленый и красный цвета, синий и желтый. Раствор роданида железа кажется красным, потому что он поглощает преимущественно зеленые лучи (l» 5000 Á) и пропускает красные; напротив, раствор зеленой окраски пропускает зеленые лучи и поглощает красные. Колориметрический метод анализа основан на способности окрашенных растворов поглощать свет в диапазоне волн от ультрафиолетового до инфракрасного. Поглощение зависит от свойств вещества и его концентрации. При этом методе анализа исследуемое вещество входит в состав водного раствора, поглощающего свет, а его количество определяется по световому потоку, прошедшему через раствор. Эти измерения проводятся при помощи фотоколориметров. Действие этих приборов основано на изменении интенсивности светового потока при прохождении через раствор в зависимости от толщины слоя, степени окраски и концентрации. Мерой концентрации является оптическая плотность (D). Чем выше концентрация вещества в растворе, тем больше оптическая плотность раствора и меньше его светопроницаемость Оптическая плотность окрашенного раствора прямо пропорциональна концентрации вещества в растворе. Она должна измеряться при длине волны, на которой исследуемое вещество имеет максимальное светопоглощение. Это достигается подбором светофильтров и кювет для раствора. Предварительный выбор кювет производят визуально соответственно интенсивности окраски раствора. Если раствор интенсивно окрашен (темный), пользуются кюветами с малой рабочей длиной волны. В случае слабо окрашенных растворов рекомендуются кюветы с большей длиной волны. В предварительно подобранную кювету наливают раствор, измеряют его оптическую плотность, включив в ход лучей светофильтр. При измерении ряда растворов кювету заполняют раствором средней концентрации. Если полученное значение оптической плотности составляет примерно 0,3-0,5, данную кювету выбирают для работы с этим раствором. Если оптическая плотность больше 0,5-0,6, берут кювету с меньшей рабочей длиной, если оптическая плотность меньше 0,2-0,3, выбирают кювету с большей рабочей длиной волны. На точность измерений большое влияние оказывает чистота рабочих граней кювет. Во время работы кюветы берут руками только за нерабочие грани, а после заполнения раствором внимательно следят за отсутствием на стенках кювет даже мельчайших пузырьков воздуха.
Согласно закону Бугера-Ламберта-Бэра, доля поглощенного света зависит от толщины слоя раствора h, концентрации раствора C и интенсивности падающего света I0
где I I h - толщина слоя раствора; C - концентрация раствора;
Логарифмируя это выражение, получаем:
где D - оптическая плотность раствора, является постоянной величиной для каждого вещества.
Оптическая плотность D характеризует способность раствора поглощать свет. Если раствор совсем не поглощает свет, то D = 0 и It =I Если раствор поглощает лучи света полностью, то D равняется бесконечности и I Если раствор поглощает 90 % падающего света, то D = 1 и It =0,1, так как выражение (2) равно единице. При точных колориметрических расчетах изменение оптической плотности не должно выходить за интервал 0,1 - 1. Для двух растворов различной толщины слоев и концентрации, но одинаковой оптической плотности можно записать: D = h1 C1
откуда
Для двух растворов одинаковой толщины, но разной концентрации можно написать:
D1 = h1 C1
откуда
Как видно из выражений (3) и (4), практически для определения концентрации раствора колориметрическим методом необходимо иметь стандартный раствор, то есть раствор с известными параметрами (C, D). Определение можно проводить по-разному: 1. Можно уравнять оптические плотности исследуемого и стандартного растворов, изменяя их концентрацию или толщину слоя раствора; 2. Можно измерить оптическую плотность этих растворов и рассчитать искомую концентрацию по выражению (4). Для реализации первого метода применяют специальные приборы - колориметры. Они основаны на визуальной оценке интенсивности проходящего света и поэтому их точность сравнительно невелика. Второй метод - измерения оптической плотности - осуществляется с помощью значительно более точных приборов - фотоколориметров и спектрофотометров и именно он используется в данной лабораторной работе. При работе на фотоколориметре чаще используют прием построения градуировочного графика: измеряют оптическую плотность нескольких стандартных растворов и строят график в координатах D = f(C). Затем измеряют оптическую плотность исследуемого раствора и по градуировочному графику определяют искомую концентрацию. Уравнение Бугера - Ламберта - Бэра справедливо только для монохроматического света, поэтому точные колориметрические измерения проводят с применением светофильтров - цветных пластинок, пропускающих лучи света в определенном диапазоне длин волн. Для работы выбирают светофильтр, который обеспечивает максимальную оптическую плотность раствора. Светофильтры, установленные на фотоколориметр, пропускают лучи не строго определенной длины волны, а в некотором ограниченном диапазоне. Вследствие этого погрешность измерений на фотоколориметре не более ±3 % от веса анализируемого вещества. Строго монохроматический свет применяется в специальных приборах - спектрофотометрах, у которых точность измерений выше. Точность колориметрических измерений зависит от концентрации раствора, наличия примесей, температуры, кислотности среды раствора, времени определения. Этим методом можно анализировать только разбавленные растворы, то есть такие, для которых зависимость D = f(C) - прямая. При анализе концентрированных растворов их предварительно разбавляют, а при расчете искомой концентрации вносят поправку на разведение. Однако точность измерений при этом понижается. Примеси могут влиять на точность измерений тем, что сами дают окрашенное соединение с добавляемым реактивом или затрудняют образование окрашенного соединения исследуемого иона. Метод колориметрического анализа в настоящее время применяется для проведения анализов в различных областях науки. Он позволяет точно и быстро проводить измерения, используя ничтожно малые количества вещества, недостаточные для объемного или весового анализа.
Назначение и принцип действия фотометра фотоэлектрического КФК - 3
Фотометр фотоэлектрический КФК-3 (в дальнейшем - фотометр) предназначен для измерения коэффициентов пропускания и оптической плотности прозрачных растворов и прозрачных твердых образцов. Принцип действия фотометра основан на сравнении светового потока Ф0, прошедшего через стандартный раствор, по отношению к которому проводится измерение, и светового потока Ф, прошедшего через исследуемый раствор. Световые потоки Ф0 и Ф фотоприемником преобразуются в электрические сигналы U0, U и UТ (UТ - сигнал при неосвещенном приемнике), которые обрабатываются микро-ЭВМ фотометра и представляются на цифровом табло в виде коэффициента пропускания, оптической плотности, концентрации.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 1929; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.14.176.111 (0.009 с.) |


 (1)
(1)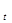 - интенсивность света, прошедшего через анализируемый раствор;
- интенсивность света, прошедшего через анализируемый раствор;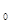 - интенсивность падающего света;
- интенсивность падающего света; - коэффициент поглощения - величина, постоянная для данного окрашенного соединения.
- коэффициент поглощения - величина, постоянная для данного окрашенного соединения. (2)
(2) и
и  (3)
(3) и
и  . (4)
. (4)


