
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лабораторная работа № 14. Определение константы диссоциации слабого электролита потенциометрическим методомСодержание книги
Поиск на нашем сайте
Цель работы: определить константу диссоциации гидроксида аммония. Сущность работы: экспериментально определив концентрацию методом ионометрии ионов Оборудование и реактивы. рН-метр; иономер; стеклянный электрод (или комбинированный электрод) для измерения рН; ионселективный электрод с аммониевой функцией; хлорсеребряный электрод сравнения (используется в паре со стеклянным или ионоселективным электродами); химический стакан объемом 100 мл – 9 шт. (для получения градуировочной зависимости – 4 шт., для измерения проб – 3 шт., для дистиллированной воды – 1 шт., для серной кислоты – 1 шт.); колбы: мерные объемом 100 мл – 7 шт. (для получения градуировочной зависимости – 4 шт., для измерения проб – 3 шт.); колбы конические объемом 250 мл для титрования – 2 шт.; бюретка для титрования объемом 25 мл – 1 шт.; пипетка Мора объемом 10 мл – 1 шт.; пипетка Мора объемом 5 мл – 1 шт.; груша или шприц – 1 шт.; штатив с лапкой – 1 шт.; штатив для электродов – 1 шт. серная кислота – 1 н. раствор; хлорид аммония – раствор 0,1 моль/кг; аммиак – раствор, разбавленный 1:3 для исследований. Выполнение работы I. Определение концентрации ионов аммония методом градуировочного графика 1. Приготовить серию контрольных растворов. Для этого стандартный раствор NН4С1 последовательно разбавить в 10; 100 и 1000 раз. = В мерную колбу на 100 мл № 1 отобрать при помощи мерной пипетки 10 мл стандартного 1 m раствора хлорида аммония, довести дистиллированной водой до метки, закрыть колбу пробкой и тщательно перемешать, переворачивая колбу вверх дном не менее 20 раз. В мерной колбе № 1 получится раствор, разбавленный в 10 раз, т.е. концентрацией 0,1 моль/кг. = Из мерной колбы на 100 мл № 1 в мерную колбу на 100 мл № 2 отобрать при помощи мерной пипетки 10 мл 0,1 m раствора, довести дистиллированной водой до метки, закрыть колбу пробкой и тщательно перемешать, переворачивая колбу вверх дном не менее 20 раз. В мерной колбе № 2 получится раствор, разбавленный в 100 раз, т.е. концентрацией 0,01 моль/кг. = Те же операции повторить с колбами № 2 и 3. Таким образом, в колбе № 3 будет раствор, разбавленный в 1000 раз.
2. В химические стаканы объемом 50 или 100 мл налить контрольные растворы, в отдельный стакан объемом 50 или 100 мл отобрать пробу раствора аммиака. 3. Подсоединить электроды к прибору: хлорсеребряный электрод – к гнезду вспомогательного электрода, ионоселективный электрод – к гнезду «изм». 4. Включить в сеть иономер, нажать кнопку «вкл.» на панели прибора. 5. Промыть электродную пару дистиллированной водой, протереть насухо кусочком фильтровальной бумаги, промыть исследуемым раствором. 6. Поместить электроды в измерительный стакан с самым разбавленным контрольным раствором, дождаться устойчивых показаний прибора и записать значение ЭДС. Примечание: для очень разбавленных растворов показания ЭДС могут устанавливаться в течении не менее 2-3 мин. 7. Измерить ЭДС остальных контрольных растворов следуя в направлении увеличения концентрации. При смене раствора электроды насухо протирать кусочком фильтровальной бумаги. 8. Раствор аммиака два раза последовательно разбавить в 10 раз. Получатся пробы: исходный раствор, раствор. Разбавленный в 10 раз и раствор, разбавленный в 100 раз. 9. Промыть электродную пару дистиллированной водой, протереть насухо кусочком фильтровальной бумаги. 10. Измерить ЭДС всех растворов аммиака, начиная с самого разбавленного. При смене раствора электроды насухо вытирать кусочком фильтровальной бумаги. Растворы оставить для определения концентрации ОН−. II. Определение концентрации гидроксид-ионов На рН-метре при помощи комбинированного электрода или пары стеклянный электрод – хлорсеребряный электрод измерить рН всех растворов аммиака. Результаты измерений ЭДС и рН занести в таблицу 2: III. Определение аналитической концентрации NH4OH 1. В две конические колбы для титрования отобрать по 5 мл раствора аммиака. 2. В каждую колбу добавить 3 – 4 капли метилового оранжевого и дистиллированную воду примерно до 20 мл. 3. Титровать раствором серной кислоты до перехода желтой окраски раствора в оранжевую. Содержание протокола лабораторной работы 1. Концентрация стандартного раствора хлорида аммония 2. Концентрация раствора серной кислоты (титранта) 3. Объем пробы раствора аммиака, взятой для его анализа титрованием Va, мл
5. Объем серной кислоты, израсходованный для титрования пробы аммиака:
6. Данные измерений ЭДС контрольных растворов NH4Cl
7. Результаты измерений ЭДС и рН растворов аммиака
|
||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 947; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.114.138 (0.008 с.) |

 и ОН− и установив аналитическую концентрацию водного раствора аммиака находят степень диссоциации и константу диссоциации по соотношению Оствальда.
и ОН− и установив аналитическую концентрацию водного раствора аммиака находят степень диссоциации и константу диссоциации по соотношению Оствальда.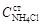 , моль/кг
, моль/кг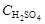 , экв/л.
, экв/л. , мл
, мл
 , мл
, мл
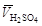 ,мл
,мл



